原发性胆汁性肝硬化患者外周血长链非编码RNA差异表达分析*
向国艳,樊 佳,叶震璇,付 雪,李红梅,张 华,4△
(1.贵州医科大学临检教研室,贵阳 550004;2.西南医科大学附属医院中医医院检验科,四川泸州 646000;3.贵州医科大学医学检验学院,贵阳 550004;4.贵州省人民医院检验科,贵阳 550002)
原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)是一种渐进性发展的慢性自身免疫性肝脏疾病,以肝脏汇管区淋巴细胞浸润、胆管上皮细胞特异性损伤及血清中出现高滴度抗线粒体抗体为特征[1]。好发于中年女性,起病隐匿且病程长。其病因尚不完全清楚,可能与遗传易感性及环境等因素有关。熊去氧胆酸(ursodeoxy-cholic acid,UDCA)是目前唯一被美国肝病学会(AASLD)、食品药品监督管理局(FDA)批准的用于治疗PBC的有效药物[2],但仍有患者治疗效果欠佳,最终需要肝脏移植。
长链非编码RNA(long non-coding RNA,lncRNA)是指一类核苷酸超过200个碱基、不编码蛋白质的功能性非编码RNA分子[3]。研究表明,lncRNA可通过表观遗传修饰与转录调控、转录后加工、翻译调控等多种机制,在细胞生命活动中发挥重要作用。其功能失调时与肿瘤、系统性红斑狼疮(SLE)和类风湿等[4-6]疾病的发生、发展都有着密切的关系。近年来关于lncRNA的研究发展迅猛,但也只是冰山一角,绝大部分lncRNA的功能仍然未知。lncRNA关于PBC的研究则更是鲜有报道,现有的研究也是采用基因芯片的方法[7]。而基因芯片的假阳性率很高,也不能发现新的转录本。因此,本研究采用Illumina高通量测序技术,检测并分析PBC患者和健康对照外周血单个核细胞中lncRNA的表达差异,为PBC的研究提供新的方向。
1 资料与方法
1.1一般资料 收集2017年8-12月就诊于贵州省人民医院的PBC患者30例(PBC组),男2例、女28例,平均年龄(50.20±10.94)岁。另选取同期于贵州省人民医院健康体检中心受检的30例健康者(对照组),男2例、女28例,平均年龄(54.00±11.64)岁。两组间年龄与性别分布比较,差异无统计学意义(P>0.05)。本研究经医院伦理委员会审查通过(2017109),且所有患者均知情同意。纳入标准:参照2009年AASLD推荐的诊断标准[2]。排除标准:系统性疾病引起的肝脏病变、自身免疫性疾病、药物和胆道梗阻等引起的肝脏病变等。
1.2材料与试剂 反转录试剂盒及SYBR GreenⅡ试剂盒购自大连TaKaRa公司;PCR引物由上海生工生物工程有限公司合成;QUBIT RNA ASSAY KIT购自美国Invitrogen公司;Ribo-ZeroTMMagnetic Kit(Epicentre)购自美国NEB公司;RNA 6000 Pico chip购自美国Agilent公司;lncRNA测序、图像采集、数据分析等由北京博奥晶典生物技术有限公司完成。
1.3方法
1.3.1PBMC的收集 采集PBC患者与对照组外周静脉血3~5 mL,3 500 r/min离心10 min,收集血浆于-80 ℃冻存备用。通过Ficoll分离法分离PBMC,并加1 mL Trizol冻存在-80 ℃备用。
1.3.2总RNA的提取、RNA文库建立及测序 Trizol法提取总RNA,QUBIT RNA ASSAY KIT对起始的总RNA进行准确定量,Ribo-ZeroTMMagnetic Kit(Epicentre)对总RNA中rRNA 进行分离去除,RNA 6000 Pico chip对去除 rRNA的总RNA进行质控,构建好去除rRNA的质控转录组测序文库后上机进行RNA-seq。
1.3.3测序结果的处理和分析 采用NGSQC软件对原始数据进行过滤和统计。Cuffquan和Cuffnorm软件进行表达水平分析,geometric方法对基因的表达进行标准化。差异RNA的筛选标准:|log2FC|≥1且P<0.05,即PBC组比对照组表达变化在2倍以上且P<0.05。对筛选出的差异RNA做层次聚类分析。基因本体(GO)功能分析与信号转导通路富集分析(KEGG分析)对差异表达mRNA的功能属性及生物学途径进行富集分析,显著富集是指P<0.05。根据差异表达基因、GO分析及KEGG分析的结果进行蛋白互作分析。经靶基因Cis-分析和Trans-分析预测可能与PBC相关的lncRNA。
1.3.4实时荧光定量PCR验证差异RNA的表达水平 选取PBC患者与健康对照各30例,经RNA/DNA/蛋白共提取试剂盒严格按照试剂说明书提取PBMC中的RNA,并用nondrop检测RNA的浓度和纯度。根据GeneBank设计引物,序列见表1。采用SYBR Green染料,通过2-ΔΔCt法分析目的基因的表达水平。每个样品做3个复孔,扩增条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,40个循环。

表1 lncRNA NONHSAT250451.1、EGR1和GAPDH引物
EGR1:早期生长反应因子1;GAPDH:3-磷酸甘油醛脱氢酶

A、B:分别为差异表达mRNA与lncRNA的火山图;C、D:分别为差异表达mRNA与lncRNA的聚类分析图;红色:上调;绿色:下调,黑色:无差异
图2 差异表达RNA的火山图与聚类分析图
2 结 果
2.1总RNA质检结果 用于转录组测序的10个RNA样品,RNA总量大于或等于5 μg,260 nm与280 nm处吸光度比值(A260/280)在1.8~2.1范围内。甲醛变性胶和Agilent 2100电泳检测结果显示,电泳条带清晰,rRNA比值(28 s/18 s)≥1.5∶1.0;RIN≥7。受检的所有RNA样品基本符合Illumina RNA-Seq样品建库的实验要求,对照组以D2和D3为例,实验组以T1和T2为例,见图1。
2.2差异表达RNA聚类分析 根据筛选标准(|log2 FC|≥1且P<0.05),差异的mRNA共5 143个(2 318个上调和2 825个下调),差异的lncRNA共716个(367个上调和349个下调)。差异表达RNA的火山图与聚类分析图,见图2。
2.3GO功能分析 差异基因在GO功能分析:其中Biological Process富集到3 213个term、Cell Component富集到230个term,以及Molecular Function富集到354个term。共富集到的3 797个term中多数与炎症、免疫活性及代谢等功能有关。差异基因和背景基因在GO功能分析的每个二级条目上的分布情况,见图3。
2.4KEGG分析 共显著富集到33个term,在organismal system中富集到与免疫系统相关信号通路有TCR信号通路、趋化因子信号通路等。在Environmental Information Processing中富集到了与免疫相关的信号通路有核因子-κB (NF-κB)信号通路、丝裂原活化蛋白激酶(MAPK)信号通路、Jak-STAT 信号通路、肿瘤坏死因子(TNF)信号通路等,见图4。
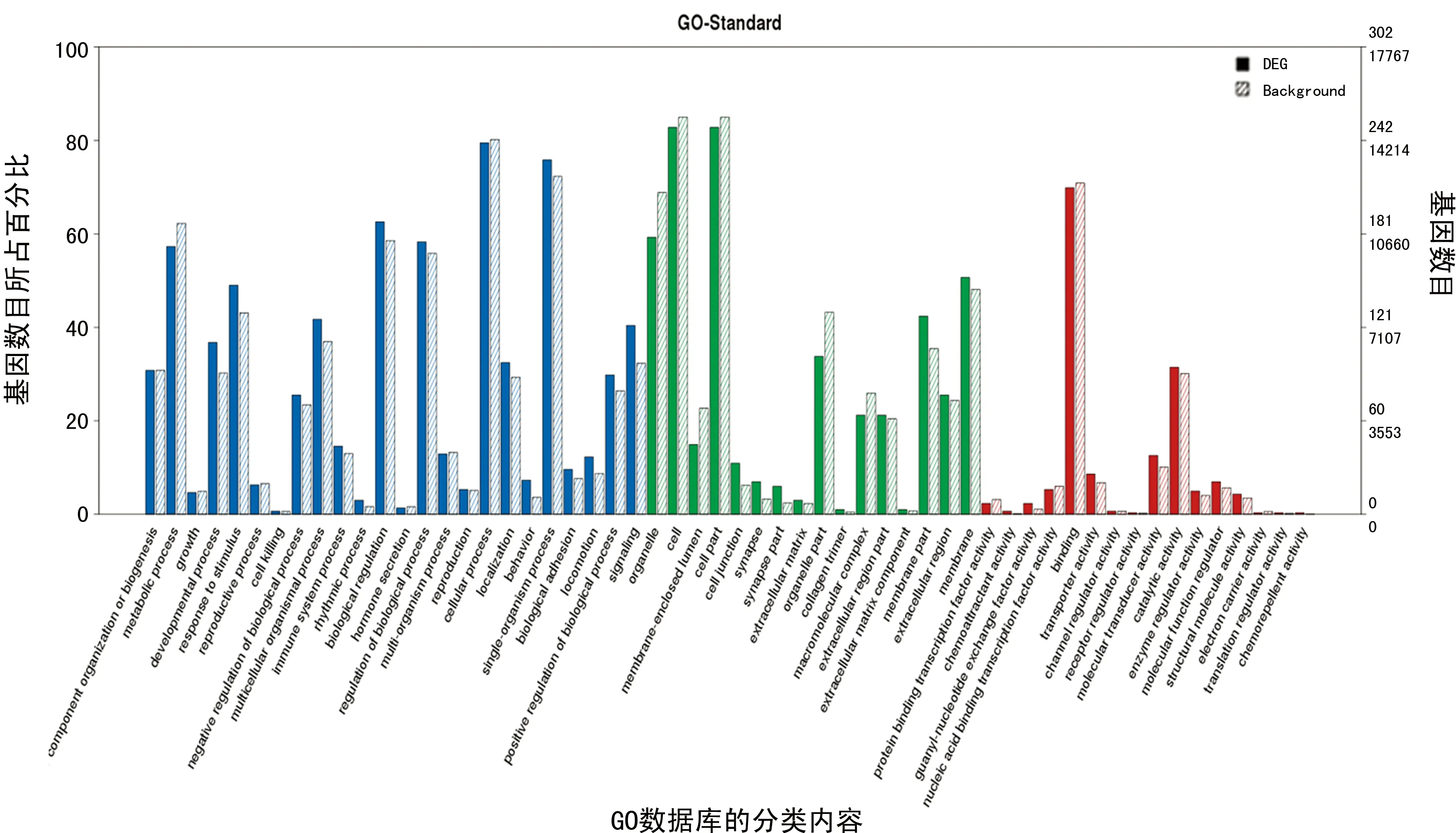
图3 GO二级频率图

图4 差异基因KEGG通路分类示意图

A:差异表达的蛋白互作网络总图;B:EGRI及其相关调控基因互作网络图
图5 蛋白互作网络图
2.5蛋白互作分析与靶基因预测 蛋白互作分析发现早期生长反应因子1(EGR1)是差异mRNA中唯一的转录因子,且与白细胞介素(IL)-1β、IL-6、IL-2等炎性因子及MAPK13、叉头蛋白3(FOXO3)等相互作用,见图5。另外,靶基因Cis-分析预测到lncRNA NONHSAT250451.1对EGR1具有靶向调控作用。
2.6lncRNA NONHSAT250451.1与EGR1表达情况 PBC组患者PBMC中lncRNA NONHSAT250451.1与EGR1表达分别为对照组的7.26、3.91倍,差异均有统计学意义(P<0.05),见图6。
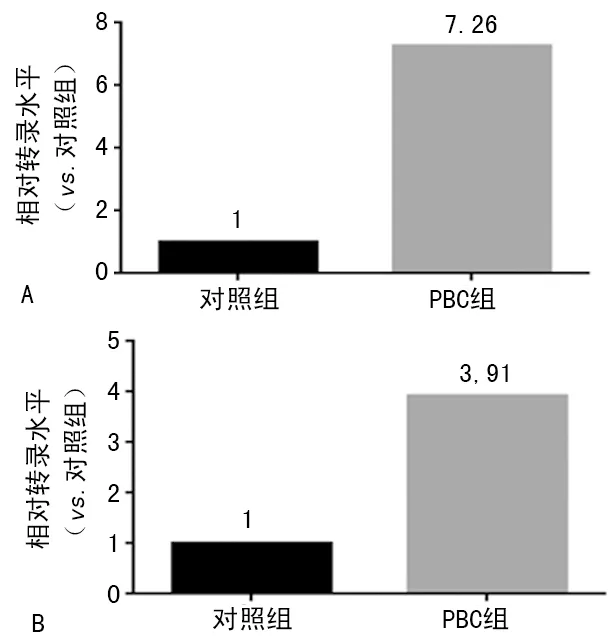
A:lncRNA NONHSAT250451.1;B:EGR1
图6 lncRNA和EGR1的相对表达情况
3 讨 论
PBC是一种以免疫介导的肝内小胆管渐进性破坏、慢性胆汁淤积为特征的肝脏疾病[1]。2015年被更名为原发性胆汁性胆管炎,这更准确地反映了绝大多数患者的疾病自然史[8]。目前PBC的发病机制尚不完全清楚,较为公认的假说是在遗传及环境等因素相互作用下,机体免疫耐受屏障破坏而引发PBC。可见PBC具体发病机制有待于继续探索。
lncRNA是指一类核苷酸超过200个碱基、不编码蛋白质的功能性非编码RNA分子。研究发现异常表达的lncRNA参与了多种疾病的发生,如PCA3是一个前列腺癌特异表达的lncRNA,在前列腺癌患者尿液中异常升高,已经用于临床前列腺癌诊断[4]。lncRNA GAS5、linc0597和lnc-DC等在SLE患者血浆中高表达,有望成为SLE新的诊断标志物[5]。可见,疾病中差异表达的lncRNA有可能成为疾病的诊断标志物和潜在的药物治疗靶点。本研究通过高通量测序技术,筛选PBC患者外周血PBMC中差异表达的lncRNA,寻找可能与PBC发病相关且特异的lncRNA。
研究显示,共富集到差异表达的lncRNA 716个,差异表达的mRNA 5 143个。GO功能分析与KEGG分析发现,显著差异表达的mRNA与炎症、免疫活性、代谢等功能及多种免疫信号通路相关(如TCR、NF-κB和Jak-STAT等信号通路)。免疫细胞及免疫相关信号通路(如TCR信号通路)的异常激活都可能是参与PBC发病的原因之一[9]。其中,差异表达基因EGR1与免疫细胞增殖、分化有关,其激活与否受TCR信号通路的影响[10]。因此笔者猜想EGR1可能与PBC发病相关。而且蛋白互作分析发现,EGR1与IL-1β、IL-2、IL-6和FOXO3等相互作用。FOXO3可以与FOXP3结合导致机体调节性T淋巴细胞(Treg)数量异常[11],进而打破体内免疫平衡促进自身免疫性疾病的发生。IL-1β、IL-2、IL-6等炎性因子也都与PBC的发病相关[12-13]。另外,有研究发现EGR1可以直接与辅助性T 淋巴细胞1(Th1)细胞特异性的转录因子T-bet的启动子区结合,促进T-bet转录,进而促进Th1细胞增殖及干扰素-γ(IFN-γ)的大量释放[10]。而KAWATA等[14]发现IFN-γ的缺失极大地抑制了胆管炎的发展,说明Th1介导的免疫炎性反应在致PBC肝脏病变过程中具有重要作用。Th1/Th2比例失衡是PBC主要发病机制之一[15]。可见,EGR1可能是通过影响Th1/Th2比例,以及与多种炎性因子的相互作用来参与PBC的发生。
靶基因预测结果发现,lncRNA NONHSAT250451.1在EGR1基因上游4 297 bp左右的位置处以Cis调控(Antisense)的方式对EGR1进行调控。而且,通过NONCODE数据库确定NONHSAT250451.1确实为lncRNA。因此笔者推测,lncRNA NONHSAT250451.1可能是通过调控EGR1的表达来参与PBC的发生,其在PBC中发挥的作用有待于进一步的探讨。实时荧光定量PCR发现,lncRNA NONHSAT250451.1与EGR1在PBC患者PBMC中的表达水平较对照组分别高出7.26、3.91倍,与测序结果一致。该结果进一步证实lncRNA NONHSAT250451.1与EGR1在PBC患者中存在明显的差异,有望成为PBC的诊断标志物和药物治疗靶点候选者之一。另外,本研究还发现了许多显著差异表达的lncRNA,如XLOC_000016上调了21.27倍,XLOC_117137上调了19.22倍,XLOC_072647下调了22.23倍,XLOC_039465下调了14.32倍。这些lncRNA在PBC中均未见报道,但是它们在PBC组中的表达差异非常显著,可能对PBC的发生、发展有着重要的调控作用,在后续的研究中值得进一步的挖掘。
综上所述,本研究发现了很多差异表达的lncRNA,并经文献找到可能与PBC发病相关的mRNA,猜想与之相关的lncRNA可能也与PBC的发生相关。本实验发现了EGR1及对其有靶向调控作用的lncRNA NONHSAT250451.1。在后续的实验中将进一步探讨lncRNA NONHSAT250451.1在PBC发病机制中的作用,期望为以后PBC的诊断和治疗提供新思路。

