剪切应力强度对内皮细胞Piezo1表达的影响
赵一蔚,任培乐,于凤旭,代红燕,聂永梅
1.新疆医科大学基础医学院生理学教研室,新疆乌鲁木齐830011;2.西南医科大学附属医院心脏大血管外科,四川泸州646000;3.新疆医科大学基础医学院机能中心实验室,新疆乌鲁木齐830011
前言
血管内皮细胞处于血管内腔面,是血流与血管壁相互作用的界面,对机械刺激、炎症信号以及血液循环中激素水平的变化敏感[1]。正常的血管内皮细胞是维持心血管系统稳态的前提条件,其功能异常是心血管疾病早期的重要特征,与动脉粥样硬化、高血压及心衰等疾病的发生、发展关系密切[2]。在机械刺激中剪切应力作为主要的力学刺激,不仅影响内皮细胞形态和功能,还可以调节内皮细胞中基因的表达[3]。当剪切应力≥15 dyne/cm2时,可以促进内皮细胞中血管舒张因子、生长抑制因子和抗氧化剂等的表达,同时可以抑制血管收缩因子、生长因子、炎症介质等的表达,使内皮细胞不易受损。而低剪切应力(±4 dyne/cm2)时,内皮细胞形态呈多角形,排列不规则,易受化学物质的刺激,分泌血管紧张素转换酶等血管活性物质、炎症介质、生长因子、粘附分子,使内皮细胞损伤;促进细胞增生、细胞黏附,诱导内皮细胞功能紊乱,具有促动脉粥样硬化的作用[4-5]。
研究发现Piezo1是一种机械敏感性阳离子通道[6]。该通道表现出参与细胞发育、血管容量调节、细胞迁移,以及细胞增殖和延长等生物学作用,在血管发育形成过程中也有重要参与,目前受到科学家们的关注[7]。已证实在发生动脉粥样硬化过程中,内皮细胞受到显著损害;剪切应力作用下,血管内皮细胞中机械离子通道Piezo1有表达,那么在受到不同强度剪切应力刺激时,Piezo1的生成与表达会有何种变化,尚未有报道。本实验通过加载不同强度剪切应力,从基因和蛋白质水平检测Piezo1表达情况,研究流体剪切应力强度对内皮细胞中Piezo1表达的影响,进而了解流体剪切应力强度是否可以影响Piezo1的表达。
1 材料与方法
1.1 主要试剂
M199培养基、PBS缓冲液、胰酶、双抗青/链霉素合剂(Hyclone,美国),胎牛血清(Gibco,美国),人纤维黏连蛋白(CORNING,美国),TRIzoL总RNA提取试剂(Thermo Fisher Scientific,美国),PCR 反转录试剂盒(Thermo Fisher Scientific, 美国),QuantiFast SYBER Greeen PCR Kit(QIAGEN, 美国),Piezo1 引物、β-actin 引物(生工生物,中国上海),RIPA 裂解液(Thermo Fisher Scientific,美国),PMSF(博士德生物, 中国武汉),蛋白酶抑制剂(Thermo Fisher Scientific,美国),BCA 法蛋白定量试剂盒(Pierce,美国),SDS-PAGE凝胶制备试剂盒(Solarbio,中国),4×蛋白上样缓冲液(Solarbio, 中国),预染蛋白分子量Marker(Thermo Fsher Scientific,美国),GAPDH 兔抗多克隆抗体(GOODHERE,中国),兔源抗Piezo1多克隆抗体(Abcam,美国),辣根酶标记山羊抗兔(中杉金桥, 中国北京),SuperSignal West Femto 高灵敏度化学发光底物(Thermo Fisher Scientific,美国)。
1.2 细胞培养
EA.hy926 人脐静脉内皮细胞株(来自上海细胞库)进行常规体外培养,于含10%胎牛血清、1%双抗的M199 完全培养基中,在37 ℃、5% CO2培养箱中培养。
1.3 剪切应力加载
将已经过消毒处理的载玻片(75 mm×25 mm),放入10 cm 培养皿中。将1 mL 纤维黏连蛋白(Fibronectin, FN)铺于载玻片上,再将培养皿移至37 ℃恒温培养箱中,静置30 min,回收FN。将消化后的细胞1 mL(1×106个/mL)均匀种植于载玻片上。将培养皿轻轻放至37 ℃、5%CO2培养箱中培养。待细胞贴壁后,加10 mL M199 生长液到培养皿中,待细胞长满后,将载玻片放置于平行板流槽中,分别加载不同强度剪切应力(根据装置低中高档各设置两组,对应应力依次为0、2.37、4.14、7.11、9.47、14.21、17.76 dyne/cm2)处理2 h。
平行板流室系统是由四川大学设计,提供相关标测数据,成都西木子公司制造。安装后流室的尺寸为:长185 mm,宽95 mm,高0.8 mm。流入孔与流出孔之间的距离为215 mm。实验装置包括恒流泵、流通管、流室、灌流瓶(图1)。用无血清M199培养液作为灌流液体,其粘度为0.72 mPa·s。力学加载过程中储液瓶始终置水浴锅中保持37 ℃,培养液中维持pH 值为7.0,为排除流体静水压的影响,整个装置系统应处在同一个水平面上。

图1 流室系统简图Fig.1 Schematic diagram of flow chamber system
1.4 实时荧光定量PCR
收集细胞,1 000 r/min 离心弃上清,加入1 mL TRizol 试剂混匀。将匀浆样品在室温放置5 min,4 ℃、13 000 r/min 离心10 min,取上清。加入0.2 mL氯仿,4 ℃、13 000 r/min 离心10~15 min,取出水相RNA(约500 μL),加入等体积异丙醇。4 ℃、13 000 r/min离心10 min,去上清,加入30 μL75%乙醇(Rnase-Free ddH2O 配置)洗涤沉淀。用NANODROP 2000 Spectrophotometer核酸定量仪对提出的RNA进行浓度和纯度检测。采用Thermo RevertAid™第一链cDNA合成试剂盒合成cDNA。实时荧光定量PCR,具体操作根据Thermo Scientific Maxima SYBR Green/ROX qPCR Master Mix(2×)说明书进行。引物序列:Piezo1,F:5'-gcagccgagagaaagagaag-3',R:5'-agagcagtgggaaccagatg-3';β- actin,F:5'- ggtagtcaccaaggcattcatt- 3',R:5'-ctccttaatgtcacgcacgat-3'。配置20 μL体系,按如下条件进行扩增:50 ℃2 min;95 ℃10 min;95 ℃15 s;60 ℃30 s;72 ℃30 s ;40 个循环后延伸20 s。对扩增产物进行溶解曲线分析。
1.5 Western-blot
自平行板流槽取出玻片,用遇冷的PBS液洗2次,并吸出;加入1 mL PBS刮下细胞,移入1.5 mL无菌的EP管中,高速离心3~5 min,吸出PBS。在EP管中按比例加入蛋白裂解液,冰上孵育30 min,期间漩涡振荡3~4次。之后,4 ℃、12 000 r/min离心20 min,将上清转移到无菌EP管。用BCA试剂盒检测蛋白样品浓度。蛋白变性。SDS-PAGE蛋白质电泳,80 mA恒流,4 ℃过夜转膜,5%脱脂奶粉封闭6 h,加入一抗(1:1 000),4 ℃孵育过夜。取出常温放置30 min,洗涤3 次,每次10 min。加二抗(1:1 000),摇床振荡,室温避光孵育2 h。吸出二抗。蒸馏水洗涤1次,5 min。1:1配置显色液,将显色液敷于PVDF上约3 min,使用Bio-Rad化学发光成像仪中拍照。蛋白分子质量:Piezo1为286 kD;GAPDH为37 kD。
1.6 统计学处理
实验重复3 次,使用SPSS 17.0 统计软件对参数进行单因素方差分析,两两比较采用SNK法,P<0.05为差异有统计学意义。
2 结果
2.1 剪切应力强度影响EA.hy926中Piezo1的基因表达
加载不同强度剪切应力,处理细胞,qRT-PCR 方法检测Piezo1 mRNA 表达情况,使用2-ΔΔCT进行结果分析。对照组与处理组相比,只有在刺激强度为4.14 dyne/cm2时,Piezo1 mRNA 的表达显著降低(图2),与静止状态比较有显著统计学差异(P<0.05)。其他处理组与对照组比较均无差异。
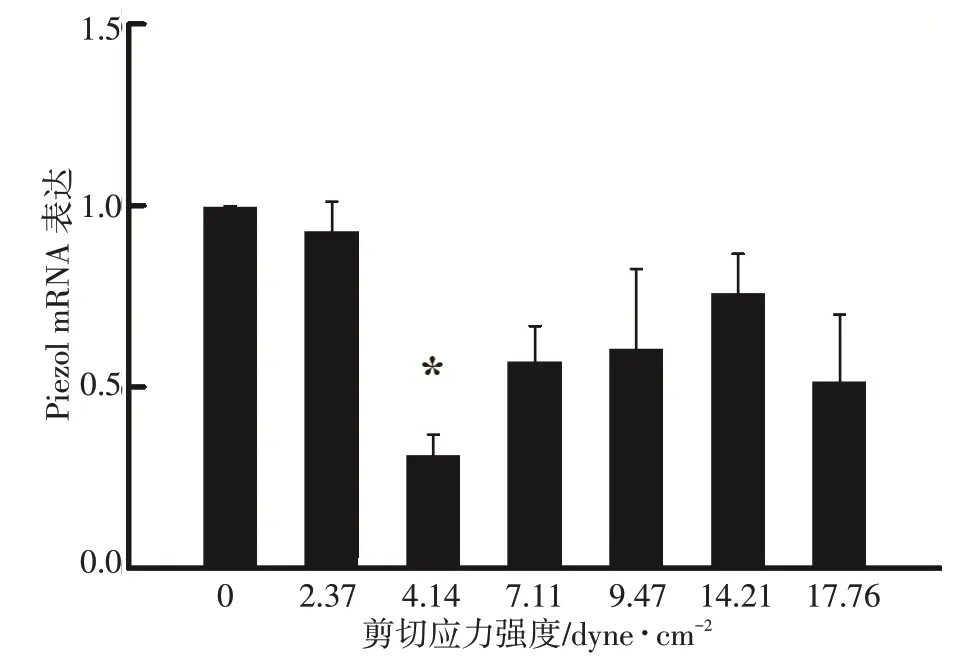
图2 不同强度剪切应力对Piezo1 mRNA表达的影响Fig.2 Effects of shear stress of different intensities on the expression of Piezo1 mRNA
2.2 剪切应力强度影响EA.hy926 中Piezo1 的蛋白表达
收集各组细胞,Western-blot 方法进行蛋白测定。通过Image pro plus6.0 对结果进行灰度扫描,定量分析发现蛋白表达与基因表达结果相一致。在刺激强度为4.14 dyne/cm2时,Piezo1 蛋白表达量最低(图3),与对照组比较有统计学差异(P<0.05)。其余处理组与对照组比较均无差异。
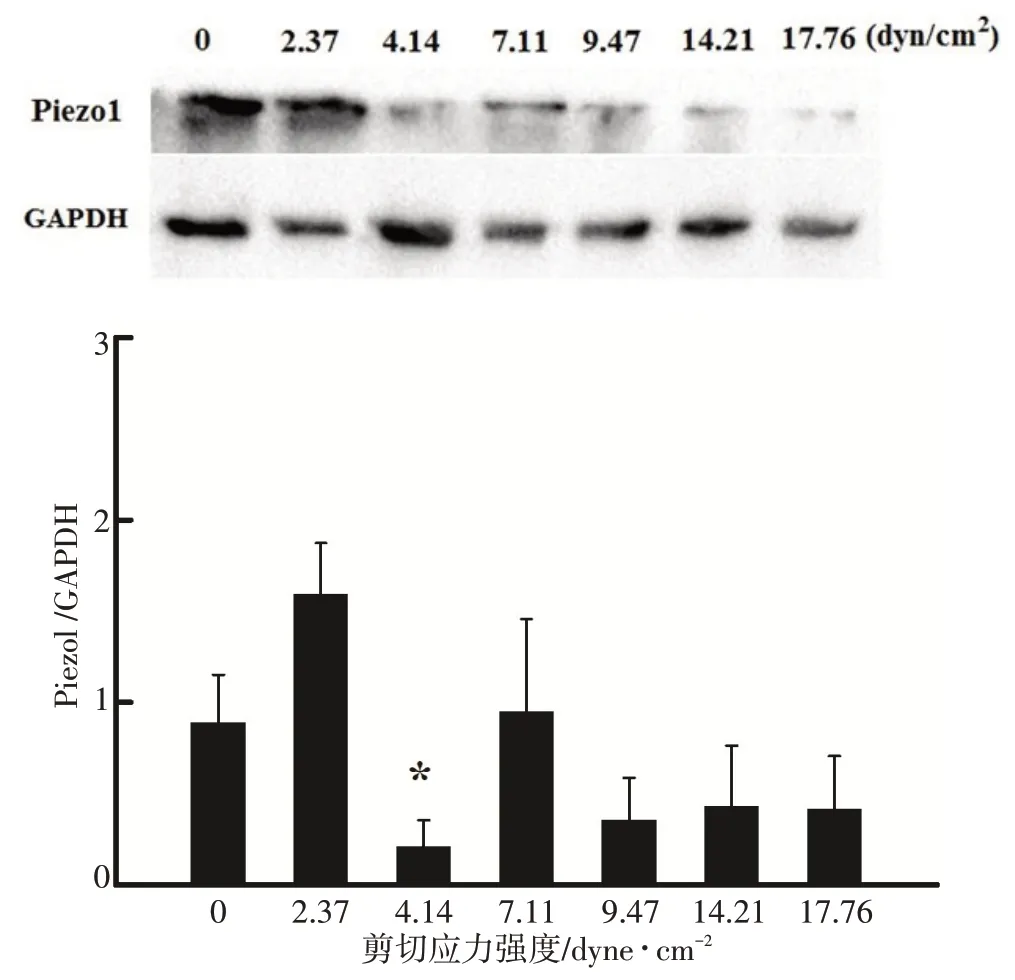
图3 不同强度剪切应力对Piezo1蛋白表达的影响Fig.3 Effects of shear stress of different intensities on the expression of Piezo1 protein
2.3 低剪切应力刺激影响EA.hy926细胞形态
静止状态细胞呈长梭形(图4a)。低剪切应力(4.14 dyne/cm2)刺激后细胞形态不规则,局部可见细胞间隙增大,细胞有脱落现象(图4b)。
3 讨论
3.1 剪切应力影响内皮细胞中Piezo1的表达

图4 光学显微镜下EA.hy926细胞株形态Fig.4 Morphology of EA.hy926 cell lines under optical microscope
血流动力学作为一个重要因素,参与血管的生理和病理调节活动。内皮细胞持续受到血管的力学作用,其中剪切应力(是血流经过血管时内皮细胞受到的与血管壁平行的力)为主要的力学刺激因素之一。内皮细胞在不同区域的血管中,受到的剪切应力也不尽相同。动脉粥样硬化的好发部位,如动脉分叉处和血管弯曲处等为±4 dyne/cm2。正常或稍高的剪切应力(≥10~15 dyne/cm2)可上调内皮细胞的抗炎作用[8]。有研究显示在剪切应力作用下Piezo1 作为力学感受器在小鼠内皮细胞中表达,其表达参与到剪切应力诱导的Ca 的流动以及细胞迁移[9-10]。Piezo1蛋白参与细胞发育、血管容量调节、细胞迁移,以及细胞增殖和延长等作用[11]。那么Piezo1 是否在人内皮细胞中表达?剪切应力是否也会影响内皮细胞中Piezo1的表达?基于此,本研究选取人脐静脉内皮细胞株EA.hy926 作为研究对象[12],分别设置不同强度力刺激内皮细胞。经检测发现,在静止状态下人脐静脉内皮细胞中有Piezo1表达;通过不同强度力学刺激,观察到强度刺激在4.14 dyne/cm2时Piezo1变化最明显,其基因与蛋白表达均显著降低;相关性分析结果显示,Piezo1表达与剪切应力的强度梯度无相关性,Piezo1对强度为4.14 dyne/cm2最为敏感。原因分析可能需要选择不同的力作用时间来检测其生物特性。
3.2 剪切应力影响内皮细胞中Piezo1 表达的临床意义
2010年Coste等[6]研究发现Piezo1是机械敏感阳离子通道,由Piezo1/FAM38A基因编码,由包含了30个跨膜区域约2 500个氨基酸构成,参与多种生理学过程。类似于许多对机械敏感的内生性阳离子通道,通过GsMTx4可以抑制Piezo1的活性[13]。Miyamoto等[14]发现膀胱上皮中Piezo1缺失时的应力诱导会引起Ca流动减少,以及ATP释放减少。Piezo1在皮肤、膀胱、肾、肝、内皮细胞、牙周组织细胞及红细胞中有广泛表达[15]。Li等[16]研究显示Piezo1在小鼠发育血管的内皮细胞中表达,Piezo1基因的缺失会导致小鼠胚胎发育的致命性损伤,在妊娠中期造成血管重构缺陷。Piezo1是血管发育的重要因素,体外层流剪切应力作用下内皮细胞中Piezo1缺失,表现出细胞排列缺陷,这些提示Piezo1的机械力传导与细胞的形态学调节有关[9]。静止状态下,人脐静脉内皮细胞缺少Piezo1时,表现为eNOS蛋白总量减少,血管内皮生长因子诱发的Ser-1177(增强eNOS活动的关键因子)的磷酸化水平降低,以及内皮细胞迁移受到抑制[11]。Huang等[17]通过研究发现MiR-103a在急性心梗患者中明显升高,而这一过程可能是通过调节Piezo1的表达来实现的。Piezo1的结构和功能影响高血压的发生过程[18]。运动过程中血流可以影响Piezo1这一机械通道,最终引起血管的收缩过程[19]。本课题组前期研究明确动脉粥样硬化好发部位的流体剪切应力在4 dyne/cm2左右[20]。4 dyne/cm2强度比10 dyne/cm2强度明显刺激内皮细胞MCP-1蛋白增高[21]。低剪切应力诱导IL-8表达,且4.2 dyne/cm2时的蛋白量最高[22]。Fractalkine在动脉粥样硬化中也起重要作用,而低剪切应力可以诱导内皮细胞Fractalkine表达上调,这一过程有低剪切应力激活的p38信号分子参与[23]。本实验显示低剪切应力4.14 dyne/cm2可以明显降低Piezo1在内皮细胞中的表达,提示Piezo1可能参与低剪切应力诱导的动脉粥样硬化过程。
本研究通过对内皮细胞进行不同强度的力学刺激,发现低剪切应力4.14 dyne/cm2降低Piezo1在内皮细胞的表达,这为了解复杂的生命发育过程提供了新方式和观点。然而剪切应力是如何刺激Piezo1 表达,Piezo1又是否以及如何参与动脉粥样硬化的发生发展过程,还需要进一步深入研究。

