菌酶协同发酵水解大米蛋白ACE抑制肽及其活性的研究
邹俊哲,林凯,谯飞,杨旭,刘红彦,杨艳艳,刘汉民,韩雪,*,张兰威,5,*
(1.中国海洋大学基础教学中心,山东青岛266003;2.哈尔滨工业大学化工与化学学院,黑龙江哈尔滨150090;3.哈尔滨市食品工业研究所有限公司,黑龙江哈尔滨150090;4.中恩(天津)营养科技有限公司,天津300000;5.华羚生物技术研究中心,甘肃兰州730000)
目前,中国肾病患者已超过一亿人,肾脏作为人体内蛋白重吸收的主要器官,一旦受到损伤或病变后,日常蛋白的摄入尤其是植物蛋白就会对肾病患者造成代谢负担。低蛋白饮食可以减轻肾脏负担并且减缓肾脏病变的几率[1]。长久以来,大米已成为中国人餐桌上的主食,但肾病患者因受到疾病的困扰,不能过多的摄入大米蛋白[2],进而严重影响了肾病患者的生活品质、心理健康和社会关系等[3]。大米中含有约为7.5%的大米蛋白,在制备低蛋白大米时,大米蛋白会以蛋白水解物形式转入到脱除液中,脱除液的排放会对环境造成污染。然而,脱除液中的蛋白及多肽是一种可利用资源,因此有效的利用大米蛋白脱除液,能够实现其废物利用并增加其附加值。
多种蛋白序列中均包含有血管紧张素I 结构类似的多肽序列。目前,利用各种蛋白酶对油菜籽蛋白[4]、大豆蛋白[5]和蘑菇[6]等不同蛋白进行水解,分离纯化出了多种具有血管紧张素转换酶(angiotensin I-converting enzyme,ACE)抑制活性的多肽,并且具有良好的降压活性。有研究利用乳酸杆菌继续处理经蛋白酶脱蛋白后的大米,但研究发现乳酸菌并没有进一步脱除大米蛋白[7]。因此,利用菌酶组合脱除大米蛋白时,应考虑使用何种蛋白酶和菌进行组合及菌酶脱蛋白的先后顺序等影响因素。近年来,利用食源性蛋白制备ACE 抑制肽在治疗高血压方面已成为研究热点[8]。本文主要目的是考察植物乳杆菌2-18 及枯草芽孢杆菌Y、枯草芽孢杆菌Y4-2 和蛋白酶联合使用对大米中大米蛋白脱除率的影响,同时考察了大米蛋白脱除液的ACE 抑制活性,为大米蛋白的利用提供试验方法并且奠定理论研究基础。
1 材料与方法
1.1 材料、试剂与仪器
试验用大米由天津市宝坻区喜旺米加工有限公司提供;枯草芽孢杆菌Y(Bacillus subtilisY)、枯草芽孢杆菌Y4-2(Bacillus subtilisY4-2)由天然发酵的纳豆中分离获得,植物乳杆菌2-18(Lactobacillus plantarum2-18)由江米发酵酒中分离获得,贮藏于哈尔滨工业大学乳品科学实验室。
胃蛋白酶(800 U/mg)、ACE(1 UN)、马尿酰-组氨酰-亮氨酸水合物(N-Hippuryl-His-Leu hydrate,HHL)、Leu-Leu(色谱纯):美国Sigma 公司,风味蛋白酶、菠萝蛋白酶(500 U/mg)、酸性蛋白酶、碱性蛋白酶(200 U/mg):诺维信(中国)生物技术有限公司;乙酸乙酯(分析纯):天津科密欧试剂有限公司;细胞色素C、抑肽酶、血管紧张素II、氧化型谷胱甘肽(色谱纯):阿拉丁试剂有限公司。
3-30K 高速冷冻离心机:美国Sigma 公司;5BG 生物发酵罐:上海保兴生物设备工程有限公司;Millipore8400 超滤杯:美国密理博公司;L-8800 氨基酸自动分析仪:日本日立公司;UV-5100 分光光度计:上海光谱仪器有限公司。
1.2 菌体在大米发酵体系中生长曲线的测定
发酵前Bacillus subtilisY、Bacillus subtilisY4-2 和Lactobacillus plantarum2-18 分别在MRS 液体培养基中进行活化,然后以3%(体积分数)接种量接种于大米发酵体系中培养10 h。Lactobacillus plantarum2-18培养温度为40 ℃,Bacillus subtilisY、Bacillus subtilisY4-2 培养温度为37 ℃。分别培养到2、4、6、8、10 h 时,分别吸取1 mL 发酵液,经稀释后涂布于MRS 固体培养基上,37 ℃培养48 h 后进行菌落计数统计,绘制菌体在大米发酵体系中的生长曲线。
1.3 菌体产蛋白酶酶活的测定
菌体培养过程中分别在特定时间(2、4、6、8、10 h)收集培养液进行菌体产蛋白酶酶活的测定。首先,将培养液于4 000 r/min 离心5 min 去除菌体等杂质,取上清液。然后,将培养液稀释一定倍数后,按照He 等测定酶活方法测定3 株菌产蛋白酶的酶活力[9]。
1.4 菌发酵大米蛋白水解率的测定
将大米洗涤后加入等量的去离子水(1∶1,kg/kg),预热到相应的发酵温度,Bacillus subtilisY,Bacillus subtilisY4-2 发酵温度为37 ℃,Lactobacillus plantarum2-18 发酵温度为40 ℃。Bacillus subtilisY、Bacillus subtilisY4-2 和Lactobacillus plantarum2-18 的接种量为5%(mL/L)。在115 r/min 振荡条件下发酵9 h,过滤获得滤液。用去离子水清洗发酵后的大米,清洗后的大米于120 ℃下烘干6 h,得到脱蛋白大米。参考Guo等的方法使用凯氏定氮测定大米的蛋白脱除率[10],同时提取大米蛋白发酵液进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶电泳分析[11]。
1.5 菌酶组合发酵水解大米蛋白
选取碱性蛋白酶(alcelase,A)、酸性蛋白酶(acid protease,Ac)、风味蛋白酶(flavourzyme,F)、菠萝蛋白酶(bromelain,B)、胰蛋白酶 (trypsin,T)和胃蛋白酶(pepsin,P)结合Bacillus subtilisY、Bacillus subtilisY4-2 和Lactobacillus plantarum2-18 进行菌酶组合发酵水解大米蛋白,酶反应最适条件如表1所示。
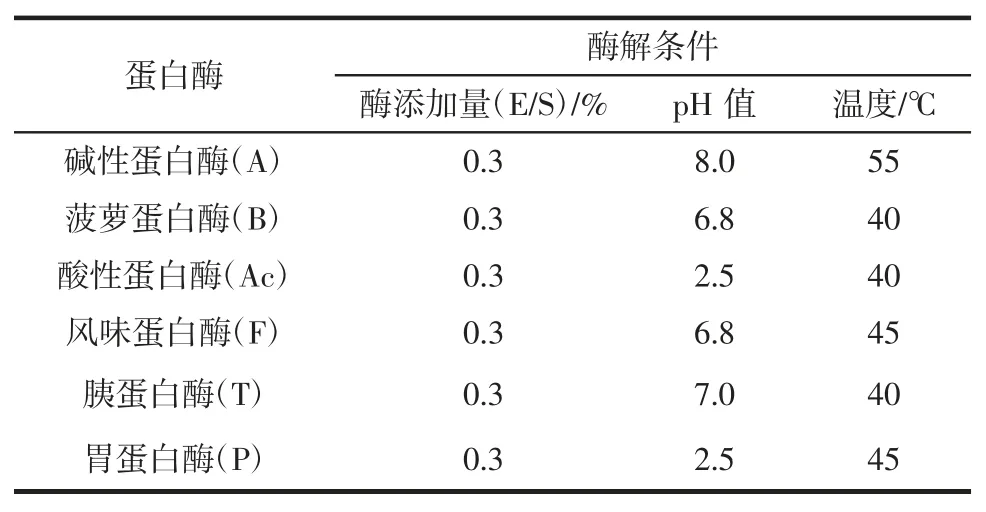
表1 蛋白酶最适酶解条件Table 1 Optimized parameters for the hydrolysis of enzymes
菌酶组合分别为Y+B/F+A、Y+B/F+Ac/P、Y4-2+B/F+A、Y4-2+B/F+Ac/P、2-18+Ac/P+B/F 分步脱除大米蛋白。以2-18+Ac/P+B/F 组合分步脱除大米蛋白为例:将Lactobacillus plantarum2-18 以5%(L/L)接种于大米发酵液中,于40 ℃115 r/min 条件下发酵9 h,过滤收集滤液,用去离子水清洗经Lactobacillus plantarum2-18 发酵的大米;调整pH 值至2.5,加入0.3%(E/S)胃蛋白酶/酸性蛋白酶,控制温度为40 ℃30 r/min 条件下发酵18 h,过滤收集滤液,用等量蒸馏水清洗大米;调整大米发酵液pH 值至6.8,温度为45 ℃,加入0.3%(E/S)风味蛋白酶/菠萝蛋白酶,于45 ℃30 r/min条件下发酵18 h,过滤收集过滤液,用蒸馏水清洗大米。同时测定大米蛋白脱除率。将Lactobacillus plantarum2-18 发酵液与2 次蛋白酶酶解液收集合并,经8 000 r/min 离心10 min,去除菌体和颗粒等杂质。最后经冷冻干燥后,将样品置于-20 ℃备用。
1.6 大米蛋白水解液氨基酸分析
取大米蛋白水解样品(100 mg)于样品管中,向样品管中加入2 mL 浓HCl(6.0 mol/L),样品管于真空条件下110 ℃水解22 h。待温度降至室温后,向样品管中加入10 mL NaOH(6.0 mol/L),最后使用去离子水定容至25 mL。样品溶液与HCl(0.02 mol/L)以1∶1(mL/mL)混合,经0.22 μm 滤膜过滤后,使用氨基酸自动分析仪进行氨基酸组成分析。氨基酸检测条件:标准分析柱4.6 mm×60.0 mm,反应柱温度为57.0 ℃,反应器温度为136 ℃。必需氨基酸(essential amino acid,EAA)评价:采用氨基酸比值(ratio of amino acid,RAA)系数法对大米蛋白水解肽进行营养评价,计算公式如下所示:

1.7 大米蛋白水解液中多肽分子量分布的测定
样品处理:将大米蛋白发酵水解液经冷冻干燥后,用流动相配制成1 g/L 的溶液,然后经0.22 μm滤膜过滤后,采用体积排阻色谱分析大米蛋白发酵水解液多肽分子量的分布。分子量分布曲线利用含有Leu-Leu(分子量:226 Da)、氧化型谷胱甘肽(分子量:615 Da)、血管紧张素Ⅱ(分子量:1 046 Da)、抑肽酶(分子量:6 500 Da)和细胞色素C(分子量:12 500 Da)的混合标准品进行绘制。
体积排阻色谱条件:色谱柱为TSK gel G2000 SWXL(300 mm×7.8 mm)凝胶柱;流动相:乙腈∶水∶三氟乙酸(mL/mL/mL)=10∶90∶0.1;检测波长为220 nm;泵流速设为0.5 mL/min;柱温箱温度为30 ℃;进样体积为10 μL[12]。
1.8 大米蛋白发酵水解液ACE抑制活性的测定
参考Lin 等[13]的方法测定ACE 抑制率测:取25 μL样品加入125 μL 的马尿酰组氨酸亮氨酸(N-hippuril-L-histidy-L-leucine,HHL),于37 ℃水浴预热5 min,加入20 μL 的ACE(0.1 U/mL)。将上述混合溶液置于37 ℃水浴孵育1 h,然后加入350 μL HCl(1 mol/L)用于终止反应。向试管中加入1.7 mL 乙酸乙酯用于萃取生成的马尿酸,将上述溶液充分旋涡振荡15 s 后,4 000 r/min 离心5 min,静置放置分层后,取上层清液1 mL 置于120 ℃干燥箱内烘干,冷却后加入1 mL 去离子水溶解,超声5 min 后于228 nm 处测定吸光值。ACE 抑制活性通过下式计算:
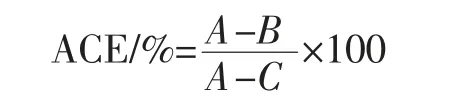
式中:A为空白组(即将25 μL 样品换成缓冲液)吸光值;B为样品组吸光值;C为ACE 失活组(即在加入ACE 之前先加入350 μL HCl,使ACE 失活)吸光值。
1.9 数据分析
本研究每组试验均重复3 次。利用SPSS 软件对试验数据进行统计分析,采用单因素方差分析(oneway ANOVA)中Duncan's 法进行分析,显著性水平设定为P<0.05。
2 结果与讨论
2.1 Bacillus subtilis Y、Bacillus subtilis Y4-2和Lactobacillus plantarum 2-18在大米发酵液中生长曲线分析
通常考察菌体在基质中的生长曲线用于分析菌体生长情况。本试验菌体发酵大米蛋白液较为浑浊,因此采用平板计数法对Bacillus subtilis Y、Bacillus subtilisY4-2 和Lactobacillus plantarum2-18 在大米发酵液中的生长情况进行分析。将不同时间的发酵液经平板计数,结果如图1所示。

图1 B.subtilis Y、B.subtilis Y4-2和L.plantarum 2-18在大米发酵液中的生长曲线Fig.1 Growth curve of B.subtilis Y,B.subtilis Y4-2 和L.plantarum 2-18 in rice
由图1结果可知,3 株菌在大米发酵过程中均能够较好的生长。Bacillus subtilisY4-2 和Lactobacillus plantarum2-18 经过8 h 的生长,活菌数均能够达到108CFU/mL 数量级,生长优于Bacillus subtilisY。
2.2 Bacillus subtilis Y、Bacillus subtilis Y4-2和Lactobacillusplantarum 2-18在大米发酵液中蛋白酶活的分析
图2为Bacillus subtilisY,Bacillus subtilisY4-2 和Lactobacillus plantarum2-18 在不同发酵时间,大米发酵液中蛋白酶酶活的检测结果。
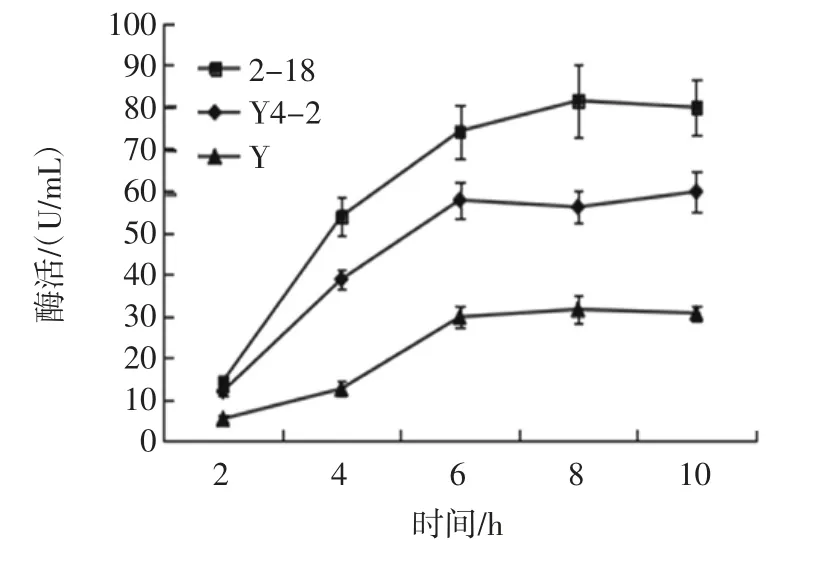
图2 B.subtilis Y、B.subtilis Y4-2和L.plantarum 2-18在大米发酵液中蛋白酶酶活Fig.2 The enzyme activity of Bacillus subtilis Y,B.subtilis Y4-2 and L.plantarum 2-18 in the rice fermentation liquid
由结果可知,Lactobacillus plantarum2-18 产生的蛋白酶酶活高于Bacillus subtilisY 和Bacillus subtilisY4-2 产生的蛋白酶酶活,同时芽孢杆菌产生的蛋白酶酶活具有显著差异。Bacillus subtilisY、Bacillus subtilisY4-2 和Lactobacillus plantarum2-18 在发酵6 h 后酶活的增加均趋于平缓,Bacillus subtilisY 和Bacillus subtilisY4-2 的酶活分别为(30.6±2.0)U/mL 和(59.7±4.7)U/mL,Lactobacillus plantarum2-18 的 酶 活 为(79.9±6.5)U/mL。因此,考虑到3 株菌产生的蛋白酶酶活力,选择产蛋白酶酶活相对稳定的时间(9 h)进行后续实验。
2.3 Bacillus subtilis Y、Bacillus subtilis Y4-2和Lactobacillus plantarum 2-18对大米蛋白脱除率的分析
为了考察3 株菌对大米蛋白的脱除能力,本试验研究了经Bacillus subtilisY,Bacillus subtilisY4-2 和Lactobacillus plantarum2-18 发酵后大米蛋白电泳图及其蛋白脱除率,图3为脱蛋白大米蛋白电泳图,图4为3 株菌对大米蛋白脱除率的影响。
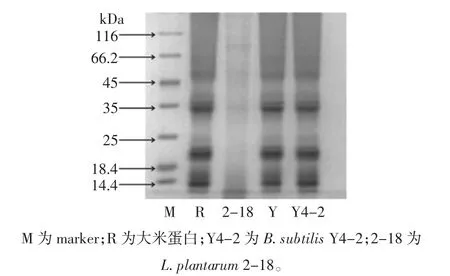
图3 大米经B.subtilis Y、B.subtilis Y4-2和L.plantarum 2-18发酵液电泳图Fig.3 SDS-PAGE of fermentation liquid produced by B.subtilis Y,B.subtilis Y4-2 and L.plantarum 2-18
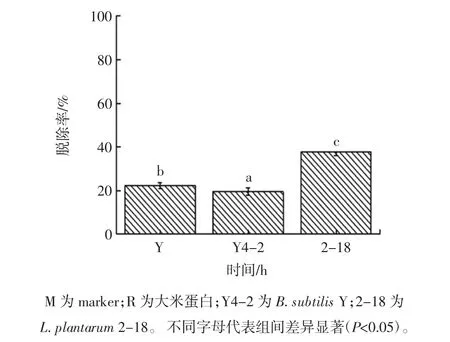
图4 大米经B.subtilis Y、B.subtilis Y4-2和L.plantarum 2-18发酵后蛋白脱除率Fig.4 Protein removal rate of fermentation liquid produced by B.subtilis Y,B.subtilis Y4-2 and L.plantarum 2-18
通过SDS-PAGE 试验发现,大米蛋白发酵液电泳条带主要分布在10、20、35、50 kDa 附近区域。通过对比经3 株菌发酵后的大米蛋白水解产物电泳图可以发现,其中Lactobacillus plantarum2-18 发酵后的大米蛋白显著减少。通过考察3 株菌对大米蛋白脱除率的影响(图4)发现,Bacillus subtilisY 和Bacillus subtilisY4-2 水解大米蛋白的能力较弱,分别为(22.35±1.30)%和(19.56±1.60)%,Lactobacillus plantarum2-18 的蛋白脱除率可达到(37.68±1.70)%,该结果与电泳试验结果一致。与Bacillus subtilisY 和Bacillus subtilisY4-2相比,Lactobacillus plantarum2-18 具有更强的水解大米蛋白能力。
2.4 菌酶组合发酵水解对大米蛋白效果的分析
试验选取了如图5所述的菌酶组合,考察了不同菌酶组合对大米蛋白脱除率的影响。

图5 不同菌酶组合对大米脱除率的影响Fig.5 Determination of protein removal rate by different combinations of bacterium with enzymes
通过测定不同菌酶组合对大米蛋白的脱除率可以发现,相比于菌体单独作用大米进行脱蛋白而言,菌酶组合能够更有效的增加大米蛋白的脱除率。当菌体单独进行大米脱蛋白试验时,Lactobacillus plantarum2-18 的大米蛋白脱除率仅为(37.68±1.70)%,而当Lactobacillus plantarum2-18 与胃蛋白酶/酸性蛋白酶和菠萝蛋白酶/风味蛋白酶共同处理大米进行脱蛋白时,大米蛋白脱除率可达(91.32±1.60)%。因此,将进一步考察Lactobacillus plantarum2-18+风味蛋白酶/菠萝蛋白酶+胃蛋白酶/酸性蛋白酶组合得到的大米蛋白发酵水解液的相关性质。
2.5 菌酶组合发酵水解大米蛋白液氨基酸分析及其营养学评价
对Lactobacillus plantarum2-18+胃蛋白酶/酸性蛋白酶+菠萝蛋白酶/风味蛋白酶组合进行大米脱蛋白获得的大米蛋白发酵水解液进行了氨基酸组成成分分析,见表2。
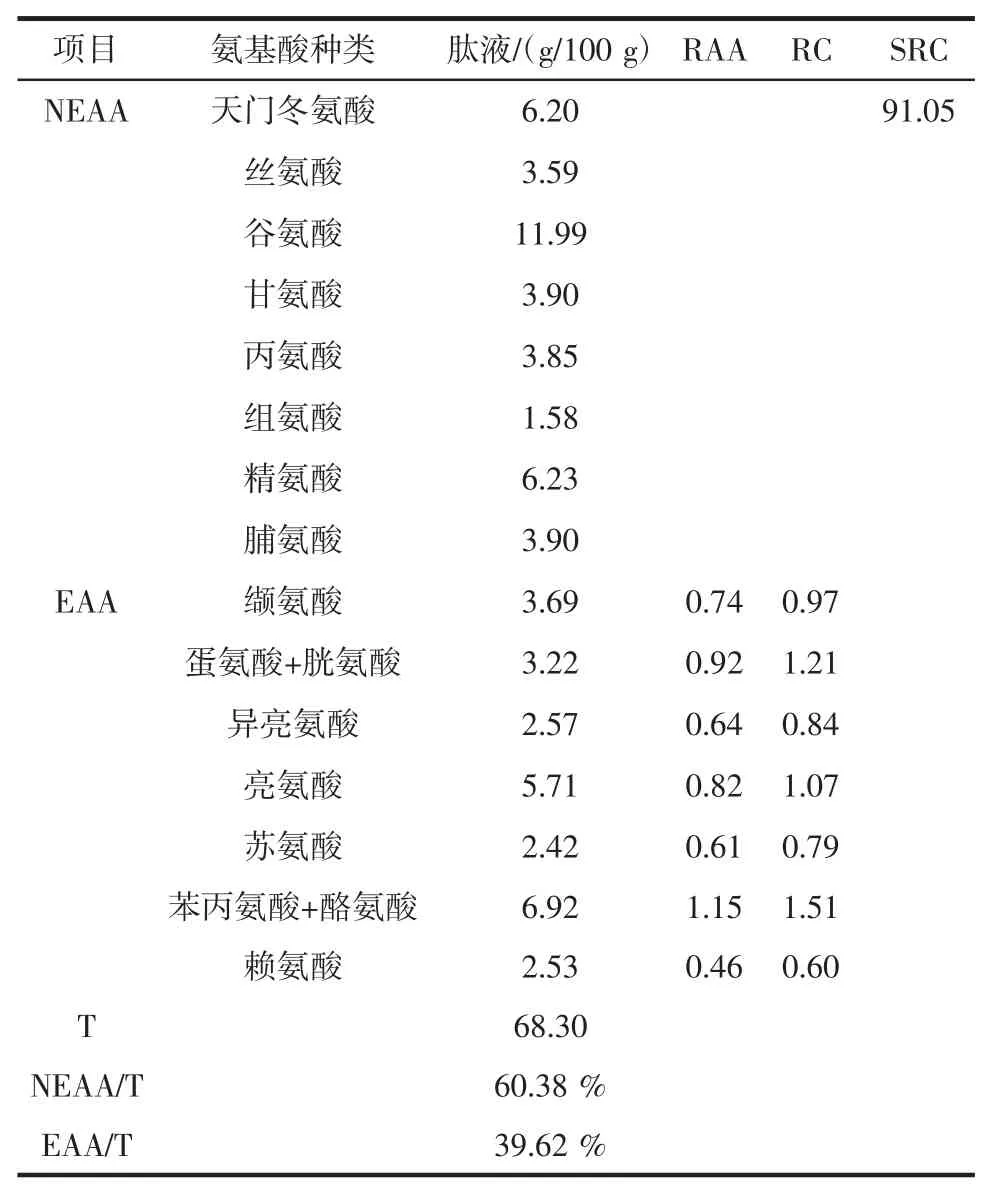
表2 大米蛋白发酵水解液氨基酸组成及RAA、RC和ARC值Table 2 The amino acids composition of removal liquid of rice and its RAA,RC,SRC values
通过对Lactobacillus plantarum2-18+胃蛋白酶/酸性蛋白酶+菠萝蛋白酶/风味蛋白酶组合获得的大米蛋白发酵水解液进行氨基酸分析,共检测到17 种氨基酸,其中必需氨基酸(除色氨酸)占39.62%,非必需氨基酸占60.38%。该组合大米蛋白发酵水解液SRC 值为91.05,远高于猪肉组织(74)和牛肉组织(76)中蛋白的SRC 值。同时,氨基酸组成分析结果可知,含硫氨基酸及芳香族氨基酸和亮氨酸RC 值均高于1,为过剩氨基酸;而赖氨酸为蛋白脱除液中的限制氨基酸,其RC 值为0.6。亚洲人主要摄入的植物蛋白为大米蛋白,相比于其他植物蛋白,大米蛋白富含多种必需氨基酸,如精氨酸、赖氨酸、蛋氨酸和苯丙氨酸等[14-15]。研究表明,大米蛋白具有较低的致敏性,易于肠道消化,可作为婴儿食用蛋白[16-17]。
2.6 菌酶大米-蛋白发酵水解液肽的分子量分布
利用体积排阻色谱测定了不同标准品(Leu-Leu、氧化型谷胱甘肽、血管紧张素Ⅱ、抑肽酶和细胞色素C)的相对保留时间见图6,标准物的分子质量与其保留时间的关系见图7和样品的体积排阻色谱分布见图8。

图6 标准品体积排阻色谱洗脱曲线Fig.6 The size exclusion chromatography of mixed standard subject

图7 标准物的分子质量对数与其保留时间的关系Fig.7 Relationship of lg(MW)of standard subject and retention time
由图6可知,不同标准物具有良好的分离度;由图7可知,分子量的对数(lgMW)对保留时间曲线方程其相关系数R2为0.977,表明该校正曲线具有良好的线性相关;根据图8获得体积排阻色谱图峰保留时间,确定样品蛋白分子量分布见表3。

表3 大米蛋白肽的分子量分布Table 3 The distribution of molecular weight of peptides
由表3可知,大米蛋白菌酶发酵水解液中蛋白分子量分布范围为:<1 000 Da(22.82%)、1 000 Da~1 500 Da(41.66 %)、1 500 Da~3 000 Da(24.34 %)、>3 000 Da(11.18%)。试验结果表明,在利用菌酶组合发酵水解大米蛋白的同时,大分子蛋白被水解生成多肽。

图8 样品体积排阻色谱谱图Fig.8 The size exclusion chromatography of sample
2.7 米蛋白菌酶发酵水解液ACE抑制活性分析
Lactobacillus plantarum2-18、胃蛋白酶/酸性蛋白酶、菠萝蛋白酶/风味蛋白酶及其组合发酵水解大米蛋白液肽分析可知,多肽分子量主要分布在1 000 Da ~3 000 Da 之间,前人研究表明具有ACE 抑制活性的肽分子量通常小于3000 Da[18],本研究测定了Lactobacillus plantarum2-18、胃蛋白酶/酸性蛋白酶、菠萝蛋白酶/风味蛋白酶及其组合发酵大米产生的脱蛋白液(<3 000 Da)的ACE 抑制活性,结果见图9。
由图9可知,菌、酶单独作用时,大米蛋白发酵水解液均具有一定的ACE 抑制活性,其ACE 抑制率分别为 (20.15±3.56)%(Lactobacillus plantarum2-18)、(30.21±2.120)%(酸性蛋白酶/胃蛋白酶)和(24.43±3.21)%(菠萝蛋白酶/风味蛋白酶)。而当菌酶组合,大米蛋白发酵水解液的ACE 抑制活性显著升高,经过Lactobacillus plantarum2-18+风味蛋白酶/菠萝蛋白酶+胃蛋白酶/酸性蛋白酶分步脱蛋白得到的大米蛋白发酵水解液ACE 抑制率达到(91.95±1.63)%。利用菌酶组合发酵水解大米蛋白,不仅能够提升蛋白水解液的生物学功能,同时还能够降低大米中的蛋白含量使其满足肾病患者的饮食需求[19-20]。

图9 不同菌酶组合的发酵水解液的ACE抑制率Fig.9 ACE inhibitory activities of the hydrolysates produced by different combinations of bacterium with enzymes
3 结论
研究利用菌酶单独或组合方式对大米脱蛋白效果及大米蛋白发酵水解液相关性质进行了研究。Lactobacillus plantarum2-18+风味蛋白酶/菠萝蛋白酶+胃蛋白酶/酸性蛋白酶组合具有良好的大米蛋白脱除效果,蛋白脱除率可达(91.32±1.60)%。通过对该菌酶组合获得的大米蛋白发酵水解液进行分子量分布分析,确定蛋白肽分子量主要集中于1 000 Da~3 000 Da 之间。对该蛋白发酵水解液进行超滤分级,确定其中小于3 000 Da 蛋白肽的ACE 抑制活性最高,抑制率达(91.95±1.63)%,具有良好的开发前景。

