自然腔道取出标本手术对直肠癌患者术后康复及免疫功能的影响分析
尹义学,蔡彬彬,司亮,范正业
(1. 甘肃省陇南市第一人民医院 肿瘤外科,甘肃 陇南 746000;2. 甘肃省陇南市白龙江林业管理局中心医院 超声科,甘肃 陇南 746000)
直肠癌是临床常见的消化系统恶性肿瘤,手术是其首选的治疗方法,但传统的开腹手术创伤大、术后并发症多、恢复缓慢,已逐渐被临床摒弃[1]。腹腔镜手术近年来得到飞速发展,在直肠癌根治术中发挥着越来越重要的作用。但其需要经腹部切口取出切除的肿瘤标本,不可避免的需要扩大腹部原切口或另外做辅助切口,可增加机体氧化应激反应,进而影响患者的免疫功能,增加术后疼痛、切口相关并发症,进而影响手术效果和术后康复进程[2]。
经自然腔道取出标本手术(natural orifice specimen extraction surgery,NOSES)是近年来研究比较热门的术式,不需行腹部辅助切口,而是在内镜辅助下,在膀胱、直肠、阴道、胃等空腔脏器壁上人造穿孔,完成相应的治疗操作,避免腹壁切口造成的创伤,较传统腹腔镜手术的创伤更小,更有利于患者的恢复[3]。本研究分析NOSES对直肠癌患者术后康复的影响及患者体内免疫功能的变化,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取我院于2015年2月—2016年12月收治的98例直肠癌患者的临床资料进行分析,根据手术方法不同分为观察组和对照组。观察组49例行NOSES直肠癌根治术,其中男27例,女22例;年龄40~68岁,平均(43.27±10.61)岁;肿瘤大小:平均(3.34±1.12)cm;肿瘤距肛缘:平均(13.89±4.41)cm;TNM分期:I期21例,II期25例,III期3例。对照组49例行传统腹腔镜直肠癌根治术,其中男36例,女13例;年龄38~71岁,平均(43.29±10.59)岁;肿瘤大小:平均(3.78±1.11)cm;肿瘤距肛缘:平均(12.13±5.72)cm;肿瘤(TNM)分期:I期19例,II期23例,III期7例。纳入标准:⑴ 符合《中下段直肠癌外科治疗规范》[4]中的相关诊断标准;⑵ 均经病理活检及纤维直肠镜检查确诊为直肠癌;⑶ 年龄38~71岁;⑷ 均符合手术指征,无手术禁忌证者。排除标准:⑴ 术前已行放化疗治疗者;⑵ 出现远处转移者;⑶ 伴有其他恶性肿瘤者;⑷ 直肠癌复发者;⑸ 凝血功能障碍者;⑹ 合并精神疾病者。两组直肠癌患者性别构成比、年龄、肿瘤分期比较,具有均衡性(均P>0.05)。
1.2 手术方法
对照组采用传统腹腔镜结直肠癌根治术治疗,行气管插管全身麻醉。患者取截石位,经脐戳孔建立人工气腹,气腹压14 mmHg(1 mmHg=0.133 kPa)左右。置入腹腔镜探查腹腔,在左、右麦氏点各作一操作孔,在左下腹脐耻连线中点作观察孔。腹腔镜下明确肿瘤病灶大小、位置,切除切除病变肠管及其周围脂肪组织、淋巴结。
观察组采用NOSES结直肠癌根治术,行气管插管全身麻醉。患者取截石位,经脐戳孔建立人工气腹,气腹压14 mmHg左右。置入腹腔镜探查腹腔,离断肠系膜下血管根部,清扫系膜淋巴结,锐性分离骶前间隙。中、高位直肠癌在离断肿瘤两侧肠管后,在切口保护套辅助下将标本由直肠镜经肛门拖出,再由肛门将钉钻头送入腹腔,在腔内闭合远端直肠,经肛门置入将圆形吻合器完成腔内吻合。低位直肠癌根据TME原则处理,腹腔镜下游离直肠系膜,切断近端肠管,由肛门置入卵圆钳钳夹肠管断端,将直肠向外翻出,直视下切断远端肠管,去除标本。置入钉钻头将其固定于近端肠管末端,体外闭合远端直肠断端。处理完毕后将其翻转至体内,将吻合器置入肛门完成腔内吻合。
1.3 观察指标
观察两组患者术后排气时间、手术时间、术中出血量、淋巴清扫数目比较,手术前后E-选择素、内皮素(ET)、细胞黏附分子1(sVCAM-1)、基质金属蛋白酶9(MMP-9)、免疫球蛋白IgG、IgM、IgA水平,以及并发症发生情况。
1.4 检测方法
分别于手术前后抽取患者空腹静脉血,以3 500 r/min离心10 min,分离血清后检测E-选择素、ET、sVCAM-1、MMP-9、免疫球蛋白IgG、IgM、IgA水平,检测方法为酶联免疫吸附法,检测仪器:美国伯腾公司ELX800多功能酶标仪,试剂盒生产厂家:南京建成生物工程研究所。
1.5 统计学处理
采用SPSS 20.0处理,E-选择素、ET、免疫功能指标等计量指标采用均数±标准差(±s)描述,组间比较采用独立样本t检验,并发症比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者手术相关指标比较
术后观察组患者排气时间短于对照组;手术时间、术中出血量、淋巴清扫数目与对照组比较,差异均无统计学意义(均P>0.05)(表1)。
表1 两组患者手术相关指标比较(n=49,±s)Table 1 Comparison of the surgical variables between the two groups of patients (n=49,±s)

表1 两组患者手术相关指标比较(n=49,±s)Table 1 Comparison of the surgical variables between the two groups of patients (n=49,±s)
组别 手术时间(min)术中出血量(mL)淋巴清扫数目(枚)术后排气时间(d)对照组122.78±21.3989.66±4.43 15.17±4.10 3.31±0.85观察组126.01±16.7591.05±4.52 14.52±4.87 2.62±0.79 χ2 0.832 1.537 0.715 4.162 P 0.204 0.064 0.238 0.000
2.2 两 组 患 者E-选 择 素、ET、sVCAM-1、MMP-9水平比较
两组患者术前E-选择素、ET、sVCAM-1、MMP-9组间比较,差异均无统计学意义(均P>0.05);术后观察组患者E-选择素、ET、sVCAM-1、MMP-9水平低于对照组(均P<0.05)(表2)。
2.3 两组患者免疫功能指标比较
两组患者术前免疫功能指标(lgG、lgM、lgA)组间比较,差异无统计学意义(均P>0.05);术后观察组患者各项免疫功能指标均高于对照组(均P<0.05)(表3)。
表2 两组患者E-选择素、ET、sVCAM-1、MMP-9水平比较(n=49,±s)Table 2 Comparison of the levels of E-selectin, ET, sVCAM-1 and MMP-9 between the two groups of patients (n=49,±s)
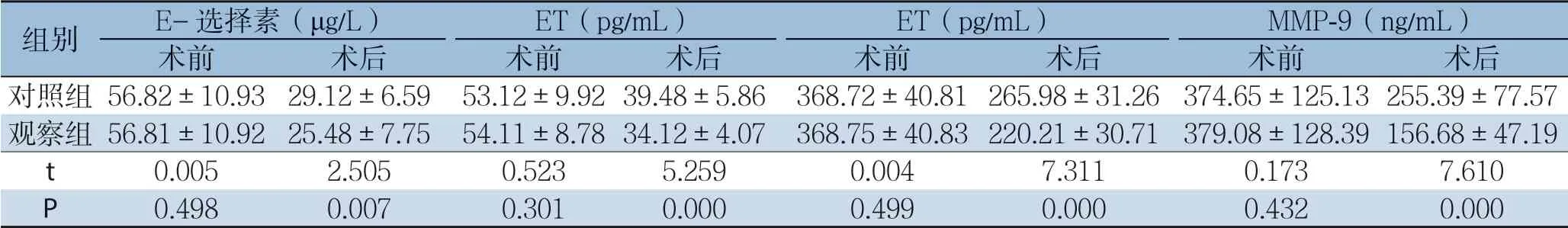
表2 两组患者E-选择素、ET、sVCAM-1、MMP-9水平比较(n=49,±s)Table 2 Comparison of the levels of E-selectin, ET, sVCAM-1 and MMP-9 between the two groups of patients (n=49,±s)
组别 E-选择素(μg/L) ET(pg/mL) ET(pg/mL) MMP-9(ng/mL)术前 术后 术前 术后 术前 术后 术前 术后对照组56.82±10.93 29.12±6.59 53.12±9.9239.48±5.86 368.72±40.81265.98±31.26 374.65±125.13255.39±77.57观察组56.81±10.92 25.48±7.75 54.11±8.7834.12±4.07 368.75±40.83220.21±30.71 379.08±128.39156.68±47.19 t 0.005 2.505 0.523 5.259 0.004 7.311 0.173 7.610 P 0.498 0.007 0.301 0.000 0.499 0.000 0.432 0.000
表3 两组患者免疫功能指标比较(n=49,±s)Table 3 Comparison of the immune function parameters between the two groups of patients (n=49, ±s)

表3 两组患者免疫功能指标比较(n=49,±s)Table 3 Comparison of the immune function parameters between the two groups of patients (n=49, ±s)
组别 lgG(U/mL) lgM(U/mL) lgA(U/mL)术前 术后 术前 术后 术前 术后对照组 136.41±32.12 115.69±19.74 172.23±47.15 136.86±23.58 152.92±35.45 133.88±25.48观察组 136.82±41.12 126.05±20.14 172.62±51.83 164.52±26.34 154.41±38.14 147.35±28.29 t 0.055 2.572 0.039 5.477 0.200 2.477 P 0.478 0.006 0.485 0.000 0.421 0.008
2.4 两组患者并发症情况比较
观察组患者并发症发生率低于对照组(8.16% vs. 18.37%),但两组并发症发生率差异无统计学意义(P>0.05)(表4)。

表4 两组患者并发症情况比较[n=49,n(%)]Table 4 Comparison of the complications between the two groups of patients [n=49, n (%)]
3 讨 论
腹腔镜手术具有微创优势,近年来在盆腹腔各类疾病的治疗中应用比较广泛,尤其是在直肠癌的治疗中具有一定的优势[5]。NCCN《直肠癌临床实践指南》中将腹腔镜辅助结直肠癌根治术作为推荐治疗方案[6]。随着腹腔镜技术的发展,其在直肠癌切除范围、淋巴结清扫彻底性、术后生存时间等方面均具有与开腹手术相当的效果,而在手术创伤、术后转移、复发等方面更具优势[7]。
传统的腹腔镜手术切除病灶组织后往往需要延长腹部切口取出,增加手术创伤,还会影响腹壁美观,遗留明显的瘢痕[8]。NOSES是指在内镜辅助下经自然腔道标本取出标本,既能保证肿瘤的根治性切除效果,还可避免腹壁切口创伤,比传统的腹腔镜结直肠癌根治术更加美观、微创[9]。
本研究中采用NOSES治疗者术后排气时间短于采用传统腹腔镜手术治疗者,两组手术时间、术中出血量、淋巴清扫数目比较,差异不具有统计学意义。这一结果提示,NOSES用于直肠癌可促进患者术后肛门排气,达到与传统手术相同的肿瘤学根治性效果,同时不增加手术难度和术中出血风险。这一结果与已有的临床研究结论一致[10]。
恶性肿瘤的侵袭、转移是一个多步骤、多环节、多分子参与的复杂过程。内皮细胞损伤后与癌细胞发生黏附作用是引起术后转移的重要环节[11]。E-选择素是一种由内皮细胞合成的表面蛋白,在正常组织内皮细胞中不表达,当受到炎症因子刺激后表达显著增加,内皮细胞活化后合成并转运至细胞表面,参与恶性肿瘤的侵袭和转移过程[12]。武韬等[13]采用E-选择素为评价指标,探讨了痰热清联合生长抑素静滴对大肠癌合并肠梗阻术后脓毒症患者血清可溶性E-选择素水平的影响,发现痰热清注射液联合生长抑素治疗大肠癌合并肠梗阻术后ICU脓毒症可减轻炎症反应,保护血管内皮功能。sVCAM-1是免疫球蛋白超家族成员,在细胞表面广泛存在,参与细胞间黏附过程。sVCAM-1可抑制自然杀伤细胞活性,帮助肿瘤细胞逃避机体的免疫监视,进而有利于肿瘤细胞的浸润、转移[14-15]。王艳成[16]采用sVCAM-1作为评价手术创伤的指标,探讨术前新辅助化疗对结肠癌组织中恶性分子表达及根治手术所致创伤程度的影响。MMP-9可降解细胞外基质,有利于肿瘤细胞的转移,血清MMP-9水平可反映肿瘤恶性程度和侵袭能力[17]。罗冲等[18]探究了MMP-9在结直肠癌组织中的表达情况及其与临床预后之间的关系,发现MMP-9在结直肠癌组织中表达升高,MMP-9可以作为今后治疗和预后结直肠癌的新靶点。刘亚彬[19]等探讨了MMP-9活性水平、蛋白水平及基因多态性与华北地区结直肠癌发病风险的关系,发现MMP-9的活性及蛋白表达与结直肠癌发生及进展密切相关。
本研究中采用NOSES治疗者术后E-选择素、ET、sVCAM-1、MMP-9水平低于采用传统腹腔镜手术治疗者。这一结果提示,NOSES用于直肠癌可更好的防止术后转移风险。这可能与其对机体自身抗肿瘤能力的抑制作用轻微、对内皮细胞损伤程度更小有关[20]。氧化应激反应由手术创伤引起,患者术后应激状态对术后康复、肿瘤病情控制具有重要意义。氧化应激反应可引起大量活性氧簇的产生,造成过氧化损伤,机体免疫功能受到抑制[21-23]。免疫球蛋白IgG、IgM、IgA是反映机体体液免疫功能的指标,直肠癌患者由于肿瘤病情本身的影响以及手术创伤引起的氧化应激反应影响,机体免疫功能处于紊乱状态[24-25]。
本研究中采用NOSES治疗者术后IgG、IgM、IgA免疫功能指标水平高于采用传统腹腔镜手术治疗者。这一结果提示,NOSES用于直肠癌可保护机体免疫功能,这与其手术创伤更小、应激反应更轻微有关。
本研究中采用NOSES治疗者术后切口液化、输尿管损伤、吻合口瘘、尿滞留等并发症发生率低于采用传统腹腔镜手术治疗者。这一结果提示,NOSES用于直肠癌可减少并发症风险,有利于患者术后康复。
综上所述,NOSES用于直肠癌可促进患者排气,达到与传统手术相同的肿瘤学根治目的,且可抑制应激因子的表达,对机体免疫功能影响较小,安全性高。

