米曲霉HDF-7产蛋白酶水解大豆蛋白及其制酱的初步研究
丁 昊,于艳颖,凌宏志,宋 刚,平文祥,葛菁萍*
(1.黑龙江大学 生命科学学院 黑龙江省普通高校微生物重点实验室,黑龙江 哈尔滨 150080;2.黑龙江大学 农业微生物技术教育部工程研究中心,黑龙江 哈尔滨 150080)
豆酱是一类传统发酵食品[1],以大豆为主要原料,经煮制、压块、制曲发酵制成。其中含有多种人体所需营养成分[2],经微生物发酵后使其容易被人体消化,并可改善人体肠道功能[3]。许多微生物在豆酱发酵过程中起着重要作用,包括芽孢杆菌、乳杆菌、霉菌、酵母菌等[4-5],其中米曲霉(Aspergillus oryzae)是发酵过程中的主要微生物[6]。
王哲等[7]研究发现,传统豆酱制作工艺制曲时间长且受季节限制,通常需要2~4个月,后续为达到最佳风味还需充分发酵3个月。虽然有文献报道[8-9],利用传统方法制酱,控制发酵条件,使得酱发酵至成品的时间大大缩短,由180d缩短至50 d,但还是较酶法制酱时间长。何立涛等[10]研究发现,利用酶法制酱去除制曲步骤,可以使豆酱出品率提高20%。目前,用于制酱的商品酶制剂大多来源于青霉(Penicillium)、黑曲霉(Aspergillusniger)、枯草杆菌(Bacillussubtilis)。CASTRO R J S D等[11]通过使用分离的米曲霉LBA01产生的蛋白酶对大豆分离蛋白进行催化,结果显示,该蛋白酶具有很好的催化活性;曾小波[12]通过研究两株米曲霉蛋白酶在酸性条件下对大豆蛋白的水解能力,结果显示,两株米曲霉所产的蛋白酶均具有较强的水解能力,且均随着pH值的升高,水解程度提高。目前,关于应用米曲霉蛋白酶制酱的研究还未见报道。
本研究以传统豆酱中筛选得到的米曲霉HDF-7为出发菌株,通过盐析、凝胶过滤对其所产的蛋白酶进行分离纯化,利用纯化后的蛋白酶对大豆蛋白进行水解,分析蛋白质的降解情况及氨基酸含量的变化,并将其应用于豆酱的制作,为其在工业制酱的研究发展提供依据,同时促进酶制剂市场的发展。
1 材料与方法
1.1 材料与试剂
1.1.1 样品与试剂
米曲霉HDF-7:黑龙江大学微生物重点实验室,分离自豆酱;大豆蛋白粉:淘宝商城;氢氧化钠(分析纯):天津市光复科技发展有限公司;盐酸(分析纯):沈阳市派尔精细化工制品厂;氨水(分析纯):北京化工厂。其他试剂均为国产分析纯。
1.1.2 培养基
查氏琼脂培养基:蔗糖30 g/L,硫酸镁0.5 g/L,硝酸钠2 g/L,硫酸亚铁0.01 g/L,磷酸氢二钾1 g/L,琼脂20 g/L,氯化钾0.5 g/L。
发酵培养基:酵母提取物3 g/L,葡萄糖10 g/L,麦芽浸膏3 g/L,大豆蛋白胨5 g/L。
以上培养基pH值均自然,用蒸馏水配制,121℃高温湿热灭菌20 min。
1.2 仪器与设备
Air TECH超净工作台:苏净集团安泰有限公司;HQL300A柜式恒温冷冻摇床:中国科学院武汉科学仪器厂;TGL-16B台式离心机:上海安亭科学仪器厂;BG-verMINI迷你垂直电泳仪:北京百晶生物技术有限公司;L-8800氨基酸自动分析仪:日本HiTACHI公司;凝胶层析介质Sephedex G-50:瑞典Amersham公司;732湿强酸性阳离子交换树脂:美国Sigma公司。
1.3 方法
1.3.1 粗酶液的制备
将米曲霉HDF-7斜面于28℃培养箱中培养5 d,加入10 mL无菌生理盐水,洗脱孢子。孢子悬液经无菌擦镜纸过滤于无菌三角瓶(含玻璃珠)中,28℃、300 r/min条件下振荡0.5 h,孢子浓度调至107个/mL。
按1%的接种量将孢子悬液接种于发酵培养基中,28℃、180 r/min条件下培养2 d,离心,上清液即为粗酶液,采用福林-酚试剂测定其蛋白酶活力[13],重复测定3次。
1.3.2 蛋白酶的分离纯化
采用不同饱和度的硫酸铵(0、10%、20%、30%、40%、50%、60%、70%、80%)对粗酶液进行盐析,确定最适硫酸铵饱和度;采用葡聚糖凝胶G-50层析法对硫酸铵盐析沉淀进行分离、纯化;采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)对纯化的米曲霉HDF-7蛋白酶进行检测;回收纯化后的单一蛋白条带,送至上海基康公司进行N端氨基酸测序,测序结果在美国国立生物技术信息中心(national center for biotechnology information,NCBI)进行比对,具体步骤参照文献[14]。
1.3.3 蛋白酶水解大豆蛋白的研究
将2 g大豆蛋白粉加入10 mL去离子水中,50℃条件下水浴溶解10 min,然后加入5 mL蛋白酶酶液(40 U/mL),迅速混匀,反应2 h。待反应结束后,煮沸10 min,使蛋白酶完全变性失活。煮沸后样品静置、冷却,10 000 r/min条件下常温离心20 min,弃沉淀,取上清液待测,以不加酶液的样品作为空白对照。
大豆蛋白质降解分析:利用SDS-PAGE对酶解前后大豆蛋白成分的分子质量大小的分布进行比较。具体步骤参照文献[15]。
氨基酸含量的变化:参照文献[16]对732湿强酸性阳离子交换树脂进行前处理。取5 g处理后的树脂于烧杯中,加入20 mL大豆蛋白水解液,37℃水浴振荡1 h,弃样液。去离子水清洗树脂2~3次,树脂中加入15 mL氨水(5 mol/L),37℃水浴振荡10 min,取清液。氨水洗脱一次,融合两次洗液并采用沸水浴蒸干。用0.02 mol/L HCl定容至50 mL,混匀,获得样品。以原盐酸溶液为空白对照组,利用氨基酸自动分析仪进行检测。
1.3.4 酶法制酱初步研究
原料预处理:100 g大豆蛋白粉中加入15%的盐水100 mL,充分搅匀后于121℃条件下高压灭菌15 min。
豆酱的发酵:原料冷却至40~45℃后,按照15 U/g原料加入纯化的蛋白酶,充分搅拌均匀,保温发酵。发酵3 d后升温至50℃,继续保温发酵4 d,期间每天搅拌一次。
1.3.5 豆酱的感官评价
以曲法制得的豆酱(宝泉牌)作对照,邀请数位试吃人员对豆酱的色、香、味及发酵形态进行整体性评价[17]。
1.3.6 豆酱理化指标的测定
总酸的测定:参照GB/T 5009.39—2003《酱油卫生标准的分析方法》;食盐的测定:参照GB5009.42—2016《食品安全国家标准食盐指标的测定》;铅的检测:参照GB5009.12—2010《食品安全国家标准食品中铅的测定》;总砷的测定:参照GB 5009.11—2014《食品安全国家标准食品中总砷及无机砷的测定》;总氨基酸态氮的测定:参照GB/T5009.40—2003《酱卫生标准的分析方法》;总黄曲霉毒素B1的测定:参照GB 5009.22—2016《食品安全国家标准食品中黄曲霉毒素B族和G族的测定》。
1.3.7 豆酱微生物指标的测定
大肠菌群的测定:参照GB 4789.3—2016《食品安全国家标准食品微生物学检验大肠菌群计数》;致病菌的测定:参照GB 4789.4—2016《食品安全国家标准食品微生物学检验沙门氏菌检验》、GB4789.10—2010《食品安全国家标准食品微生物学检验金黄色葡萄球菌检验》、GB 4789.5—2012《食品安全国家标准食品微生物学检验志贺氏菌检验》。
2 结果与分析
2.1 蛋白酶纯化结果
2.1.1 (NH4)2SO4盐析饱和度的确定
(NH4)2SO4沉淀蛋白酶的盐析曲线见图1。
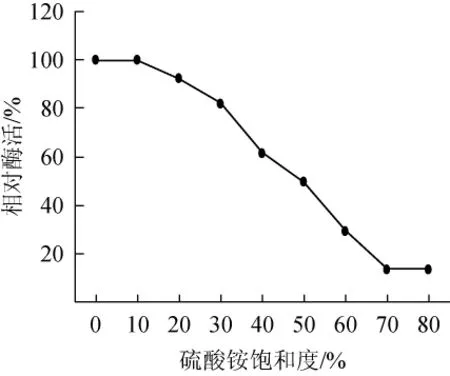
图1 蛋白酶硫酸铵盐析曲线Fig.1 Salting-out curve of ammonium sulfate of protease
由图1可知,随着硫酸铵溶液饱和度逐渐上升,上清液中剩余酶活也逐渐降低,当饱和度达到70%时,剩余酶活最低,为(3.34±0.24)U/mL,相对酶活为(13.53±0.96)%;当饱和度达到80%时,剩余酶活为(3.39±0.25)U/mL,相对酶活为(13.73±1.01)%,变化不明显,因此,硫酸铵沉淀蛋白酶的最佳饱和度是70%。
2.1.2 Sephadex G-50层析
利用Sephadex G-50对盐析沉淀进行层析,结果见图2。
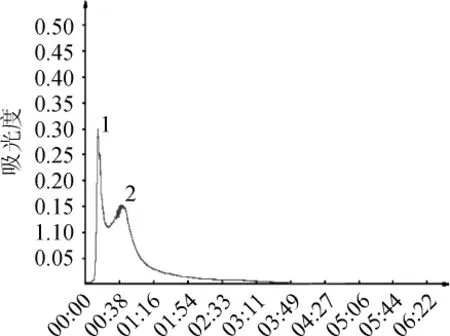
图2 蛋白酶Sephadex G-50层析柱洗脱曲线Fig.2 Elution profile of protease on Sephadex G-50 column
由图2可知,盐析沉淀经Sephadex G-50层析后得到洗脱峰1和2,根据层析原理可知,洗脱峰1的分子质量大于洗脱峰2,对两峰的收集液的蛋白酶活进行测定发现,酶活主要集中在洗脱峰1中,留存洗脱峰1的收集液以备后续检测。
2.1.3 SDS-PAGE结果
将纯化后的蛋白酶进行SDS-PAGE,经染色脱色后得到图3。
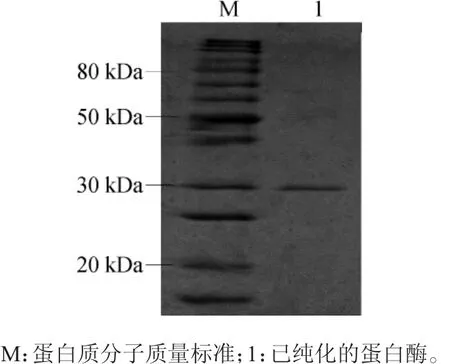
图3 纯化后蛋白酶的SDS-PAGE结果Fig.3 SDS-PAGE result of protease after purification
由图3可知,洗脱峰1经SDS-PAGE检测后,为单一条带,说明此蛋白酶已达到电泳纯。根据蛋白质Marker可推测,此蛋白酶分子质量为30 kDa左右。
2.1.4 氨基酸序列分析
切下目标条带(30kDa)送至上海基康公司进行N端氨基酸测序,得到含12个氨基酸的序列:GGGNDYVILNAQ。将此氨基酸序列在NCBI上比对后发现,其与米曲霉(Aspergillus oryzae)RIB40的中性蛋白酶(ACCESSION:AAT68480)的N端序列具有很高的相似度。
2.2 蛋白酶水解大豆蛋白的研究
2.2.1 大豆蛋白质降解产物的分析
大豆蛋白主要是球蛋白,根据不同分子质量可分为2S、7S、11S和15S四组[18],其中以7S和11S为主。主要成分有胰蛋白酶抑制剂、细胞色素C、大豆凝集素、解脂酶、β-淀粉酶、7S球蛋白、11S球蛋白[19]。大豆蛋白经水解后,产物以糖基化氨基酸和氨基酸为主。刘汝萃等[20]利用碱性蛋白酶水解大豆分离蛋白发现,酶解主要发生在7S和11S的酸性亚基上,但随着酶解时间的延长,7S亚基条带变化并不显著。
利用纯化的米曲霉蛋白酶HDF-7对大豆蛋白进行水解,采用SDS-PAGE对水解产物进行分析,结果见图4。
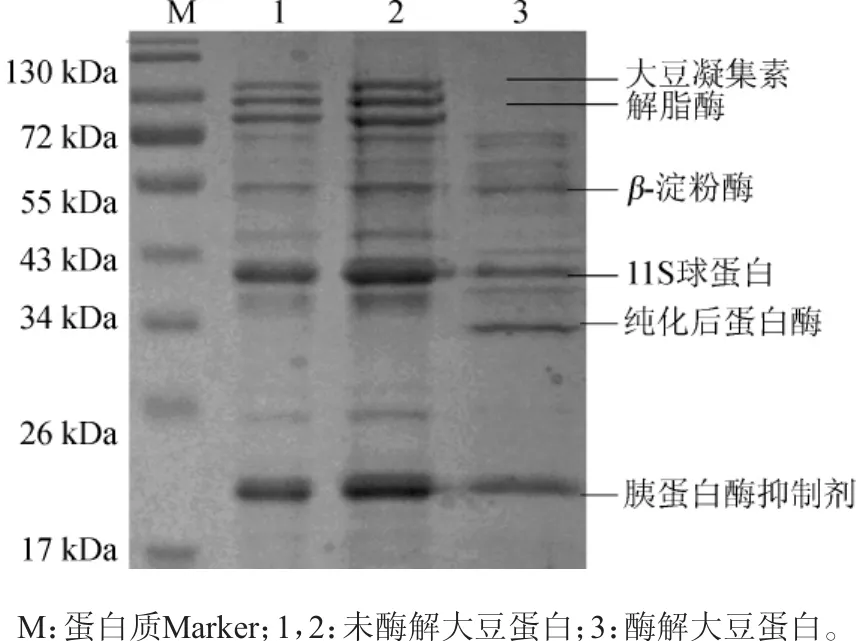
图4 酶解前后大豆蛋白的SDS-PAGE结果Fig.4 SDS-PAGE results of soybean protein before and after enzymatic hydrolysis
由图4可知,根据蛋白分子质量推测大豆蛋白经米曲霉HDF-7蛋白酶酶解后,其中大豆凝集素、解脂酶及一些球蛋白被水解,而胰蛋白酶抑制剂和β-淀粉酶无明显变化,且一些小分子蛋白也未被水解。
大豆凝集素是一种糖蛋白,是一种抗营养因子,具有凝集和促分裂的生物学活性,可由小肠上皮进入循环系统进而诱发免疫反应,破坏机体正常代谢,导致小肠粘膜损伤,内源氮的大量损失,体蛋白加强分解等一系列反应[21]。本实验提取的米曲霉HDF-7蛋白酶能有效水解大豆凝集素,阻止其抗营养作用,使大豆蛋白营养成分更易被吸收,并大大减少对机体的不良影响。
2.2.2 氨基酸含量的变化
由于氨基酸是一种多官能团分子,食用后可与风味受体结合产生特定风味。因此,豆酱中的游离氨基酸的种类和数量对其品质显得尤为重要[22-23]。利用732湿强酸性阳离子交换树脂提取大豆蛋白的水解产物,用氨基酸自动分析仪测定水解产物中各种氨基酸的含量,大豆蛋白酶解前后氨基酸种类的谱图分别见图5和图6。酶解前后各种氨基酸含量的变化结果见表1。
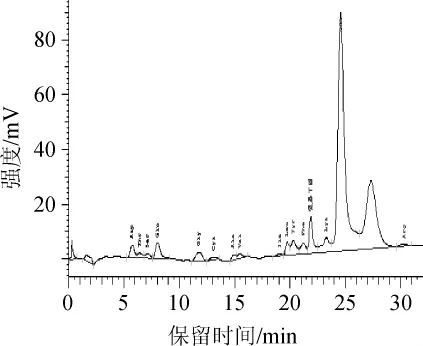
图5 大豆蛋白酶解前氨基酸分析色谱图Fig.5 Chromatogram of amino acid analysis before enzymatic hydrolysis of soybean protein
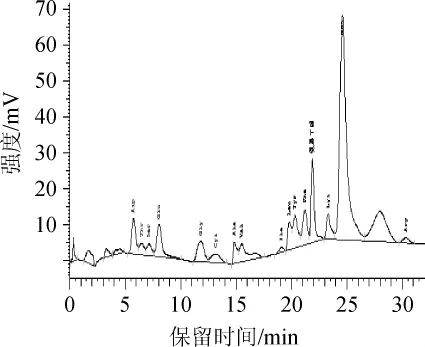
图6 大豆蛋白酶解后氨基酸分析色谱图Fig.6 Chromatogram of amino acid analysis after enzymatichydrolysis of soybean protein
由表1可知,大豆蛋白经米曲霉HDF-7蛋白酶酶解后,总氨基酸含量较酶解前增加18.2%,其中半胱氨酸、丙氨酸、缬氨酸、精氨酸含量明显提高(P<0.01)。立体构型不同的氨基酸含有不同的味道[24],丙氨酸含有很强的甜味,而精氨酸有苦味,缬氨酸有微甜但略苦的味道,因此,米曲霉HDF-7蛋白酶是一种有潜在应用价值的生物催化剂。
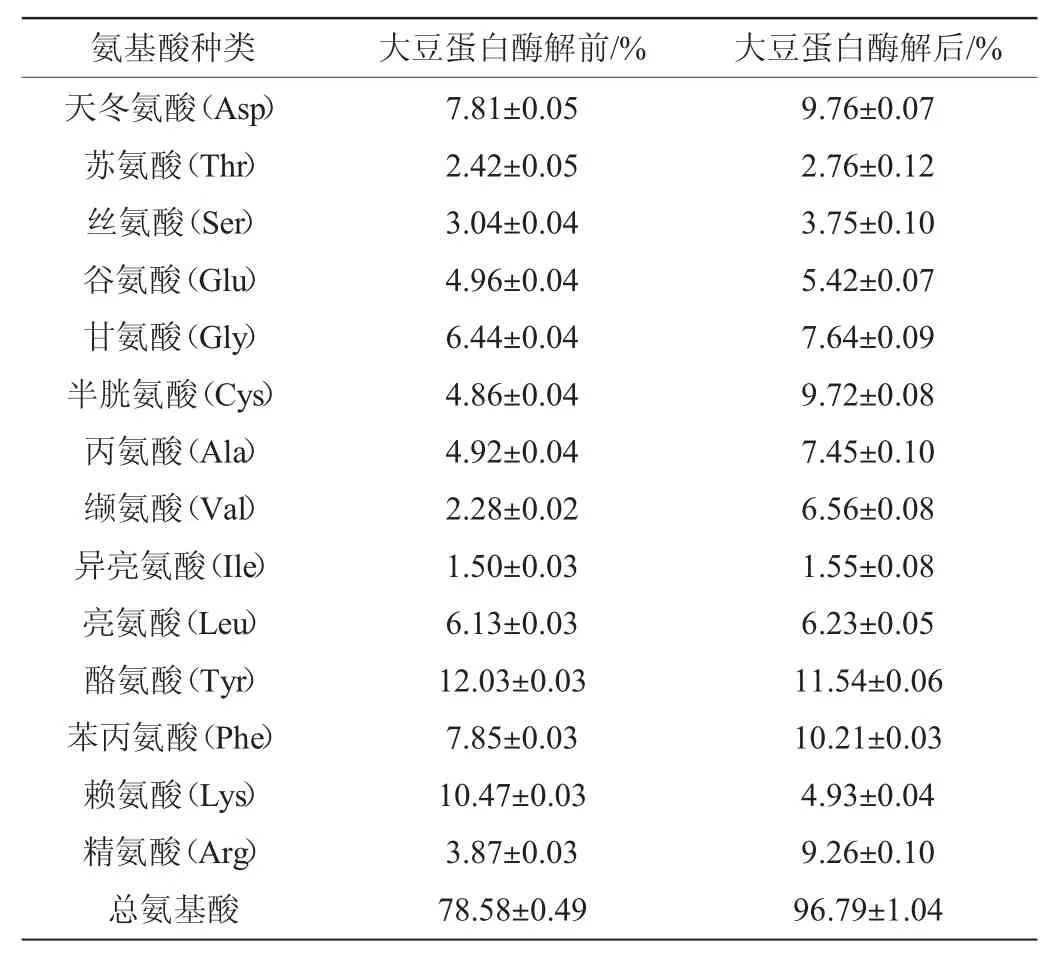
表1 大豆蛋白酶解前后氨基酸含量的变化Table1 Changes of amino acid contents of before and after enzymatic hydrolysis of soybean protein
2.3 豆酱的感官评价
传统豆酱色泽大体呈深红或深棕褐色、酱体光亮细腻,酱香浓香绵柔,无不良刺激气味,鲜味突出、咸甜适宜,粘稠适度、均匀、无杂质。但是传统豆酱制作耗时费工(20 d),因此,尝试直接将纯化的蛋白酶加入大豆豆粉中制酱,对其进行感官评价,结果见表2。

表2 豆酱的感官品评结果Table 2 Results of sensory evaluation of soybean sauce
由表2可知,与传统的曲法制得的豆酱相比,酶法制得的豆酱呈酱褐色,口感适宜,咸而不腻,具有酱、酯香,且酱整体偏稀,鲜味也比较适中。总体来说,其风味、外观与传统豆酱差别不大,但传统曲法制酱耗时长,酶法制酱时间短(7 d),工艺较简单。
2.4 豆酱理化指标的测定
豆酱中总酸含量为1.78g/100g,符合国标中总酸含量≤2.0 g/100 g的要求;食盐含量为45 g/100 g,符合国标中食盐含量≥12.0 g/100 g的要求;铅含量为0.02 mg/kg,符合国标中铅含量≤0.5 mg/kg的要求;总砷含量为0.1 mg/kg,符合国标中总砷含量≤0.5 mg/kg的要求;总氨基酸态氮含量为0.97g/100g,符合国标中氨基酸态氮含量≥0.3 g/100 g的要求;黄曲霉毒素B1含量<5 μg/kg,符合国标中黄曲霉毒素B1含量≤5 μg/kg的要求。
2.5 豆酱微生物指标的测定
豆酱中大肠菌群呈阴性,符合国标中大肠菌群量≤30 MPN/100 g的要求;未检出沙门氏菌、金黄色葡萄球菌、志贺氏菌等致病菌,符合豆酱中致病菌不得检出的要求。
3 结论
采用盐析法、凝胶过滤法分离纯化得到米曲霉HDF-7蛋白酶,该蛋白酶对大豆蛋白水解后,大豆凝集素、解脂酶及一些球蛋白被水解,且总氨基酸含量较水解前增加18.2%,其中丙氨酸、缬氨酸、半胱氨酸和精氨酸的含量明显提高。采用该蛋白酶制作的豆酱除粘着性不高,呈现稀态外,其风味、外观与传统豆酱差别不大,理化指标和微生物指标均符合相关国标要求,且大大缩短了制酱时间(7d),为其在工业制酱的研究发展中提供依据,同时对酶制剂市场的发展具有促进作用。

