乙烯性质实验的再改进
应春晓
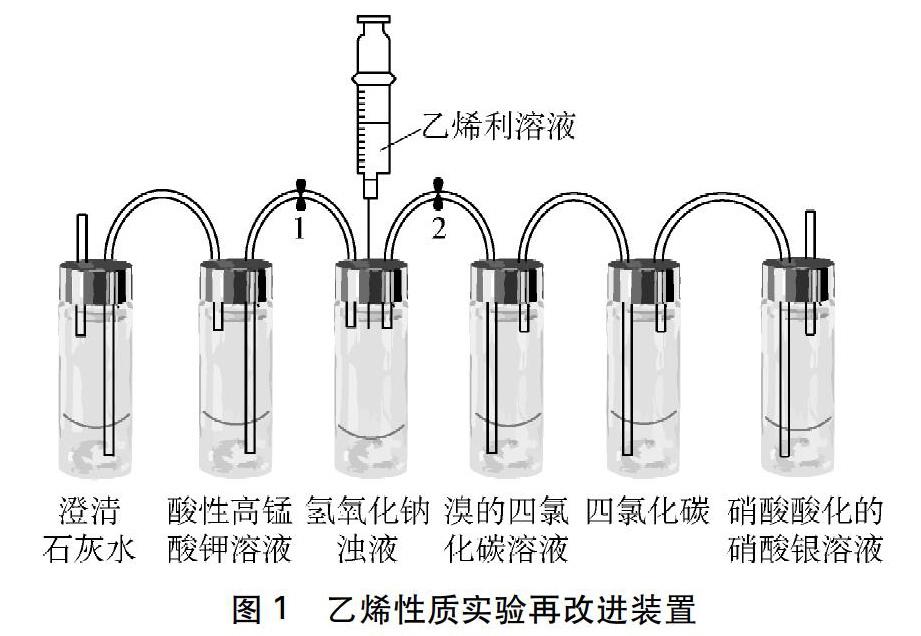

摘要: 从药品配置(乙烯利制乙烯)、实验原理、微型化装置三个方面对苏教版《化学2》中的乙烯性质实验作改进,通过多次试验探究影响改进实验效果的各个因素,充分挖掘该实验的探究价值和知识价值,加强了对学生化学学科素养的培养。
关键词: 乙烯利制乙烯; 乙烯性质实验; 实验改进
文章编号: 10056629(2019)4006903中图分类号: G633.8文献标识码: B
苏教版中乙烯的性质实验安排在化学2专题3第一单元第二节“石油炼制乙烯”的“活动与探究”栏目中,实验内容如下: (1)把乙烯气体通入酸性高锰酸钾溶液中;(2)把乙烯气体通入溴的四氯化碳溶液中。我们可以看到: (1)教材中没有提供乙烯的制法。实验室中常采用乙醇和浓硫酸共热制得乙烯,《有机化学基础》(选修)中采用在催化剂五氧化二磷或氧化铝作用下加热乙醇制乙烯。这些制法都具有需要加热、副产物多、实验耗时长等特点,不利于学生实验的开展[1]。(2)教材中的实验只能证明乙烯和溴、高锰酸钾可以反应,但其原理大多是通过教师从理论的角度去讲授,学生初学有机反应普遍觉得比较抽象、难以接受。(3)教材中没有给出实验装置。因此,有必要对教材原有实验进行再改进。
1 实验改进方案
1.1 乙烯利制乙烯的药品配置
彭梭等[2]采用25%乙烯利溶液和氢氧化钠固体反应制乙烯。该制法不需要加热,且可以快速地获得较多高纯度乙烯,使学生实验具有了安全性和可操作性。其反应原理如下:
但此方法不适用于本文采用的微型化装置。因为,乙烯利和氢氧化钠反应会放出大量的热,导致反应过于剧烈,使得反应液很容易冲出容积仅为10mL的反应瓶。因此,须对该制法的药品配置作改进,具体方案见下文各表。
1.2 增加反应原理探究
研究者对乙烯实验的改进,多数以反应药品改进[3]、催化剂和脱水剂改进[4]、实验装置改进[2]这三个方向为主,很少涉及反应原理探究。本改进设计了探究其反应原理的实验,可以使学生更加深刻地认识到乙烯和溴、酸性高锰酸钾反
应的本质。实验内容及其原理如下:
(1) 将乙烯和酸性高锰酸钾反应后产生的气体通入澄清石灰水中,如发现其变浑浊,则可以证明乙烯被酸性高锰酸钾氧化成二氧化碳,从而证明该反应是氧化反应。
(2) 将乙烯和溴反应后产生的气体先通入四氯化碳再通入硝酸酸化的硝酸银溶液中,如发现无浑浊现象,则证明没有溴化氢生成,说明该反应原理不同于烷烃与卤素发生的碳氢键断裂的取代反应,从而引入新的有机反应类型——加成反应。
(说明: 溴化氢的检验不能在反应后的溶液中加硝酸酸化的硝酸银,因为溴化氢难溶于四氯化碳而易挥发出来,也不能将产生的气体直接通入硝酸酸化的硝酸银溶液中,因为溴蒸气也容易挥发出来与水反应生成氢溴酸对结果造成干扰。因此,笔者先将反应产生的气体通入四氯化碳除去溴蒸气,再通入硝酸酸化的硝酸银溶液中检验溴化氢。)
1.3 微型化反应装置
本实验采用图1装置进行实验。该装置操作简单,特别适用于学生实验。课前用一次性输液针管将6个西林瓶(有胶塞的注射剂瓶)的橡胶塞按图1连接好,课堂上只需在瓶中加入相应试剂,盖上连接好的橡胶塞,再用注射器加入乙烯利溶液,反应即可开始。反应结束后只需打开橡胶塞更换瓶中的试剂即可进行重复实验。同时该装置还具有以下优点: 微型化设计可以节约试剂、减少反应时间;注射器可调节反应进程,防止反应过于剧烈;充分考虑了防倒吸,安全可靠;无环境污染。
2 儀器和试剂
10mL量筒、一次性输液针管、5mL注射器、10mL西林瓶
40%乙烯利溶液(网购)、氢氧化钠、0.01%酸性高锰酸钾溶液、澄清石灰水、5%溴的四氯化碳溶液、四氯化碳、0.1mol·L-1硝酸酸化的硝酸银溶液
3 实验的操作步骤及实验现象
按图1安装仪器检查其气密性后添加相应的试剂。实验1: 打开开关1,关闭开关2,将注射器中的乙烯利溶液(每次定量1mL)加到氢氧化钠浊液中,观察酸性高锰酸钾溶液的颜色变化和澄清石灰水有无浑浊;实验2: 打开开关2,关闭开关1,观察溴的四氯化碳溶液颜色变化和硝酸酸化的硝酸银有无浑浊。
4 实验数据及分析
实验过程中发现以下几个因素可以影响实验效果。
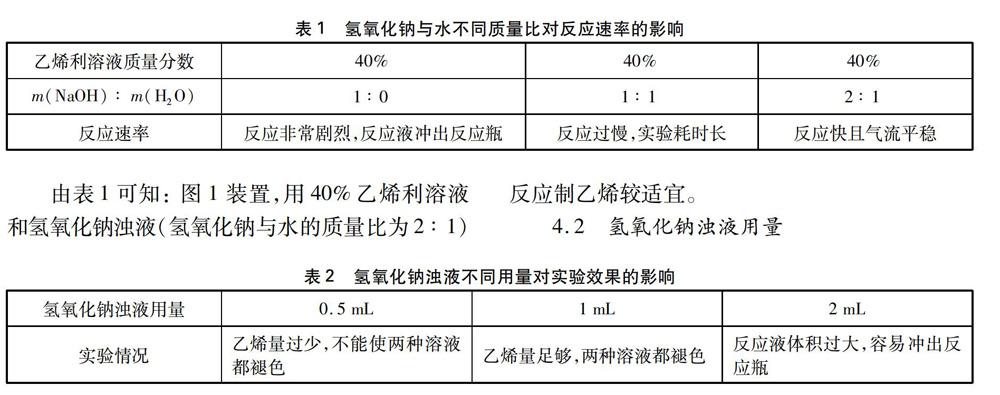
4.1 氢氧化钠与水的质量比
4.2 氢氧化钠浊液用量
4.3 酸性高锰酸钾、溴的四氯化碳溶液用量
由表3可知: 酸性高锰酸钾溶液的量选择1.5mL为宜,量太少或太多都会导致实验耗时过长。量太少耗时长可能的原因是: 二氧化碳的生成量减少,使得气流中二氧化碳浓度降低,导致二氧化碳与石灰水的反应速率降低而增加实验耗时;量过大而耗时长可能的原因是: 气流经过高锰酸钾溶液时温度降低,或者因溶解损失增加而减少了二氧化碳的逸出量,使得二氧化碳与石灰水的反应速率降低而增加实验耗时。溴的四氯化碳溶液用量越大实验耗时越大,但其用量并不一定越少越好。应保证假设乙烯和溴发生取代反应生成溴化氢的量,可以被0.1mol·L-1硝酸银溶液检测到。计算过程如下:
假设溴的四氯化碳溶液用量为1mL,溴的四氯化碳溶液密度约为1.5g·mL-1,可计算出1mL 5%溴的四氯化碳溶液中,m(Br2)=1mL×1.5g·mL-1×5%=0.05g, n(Br2)=0.05g÷160g·mol-1=3×10-4mol,则进入3mL硝酸银溶液中的n(HBr)=n(Br-)=3×10-4mol, c(Br-)=0.1mol·L-1,则c(Br-)×c(Ag+)=0.1×0.1=×10-2,远远大于Ksp(AgBr)=5.0×10-13。因此,溴的四氯化碳溶液用量可以用1mL,甚至在操作方便、实验现象明显的前提下可以更少。
另外,需要指出的是,乙烯的气流快慢,也会影响实验耗时。乙烯利与氢氧化钠反应越剧烈,气体温度就越高、气流越快,反应速率也就越快。笔者在做酸性高锰酸钾溶液、溴的四氯化碳溶液的用量影响实验耗时的实验时,都采用一次性加1mL乙烯利溶液(不振荡)的方法,以尽量排除这个因素的干扰,但并不能保证百分百无干扰,因此笔者提供的实验耗时数据可能存在一些误差。
5 结语
乙烯可以使酸性高锰酸钾溶液褪色,反应后的气体可以使澄清石灰水浑浊;乙烯也可以使溴的四氯化碳溶液褪色,反应后的气体(除去溴蒸气)不能使硝酸酸化的硝酸银变浑浊。因此,本改进实验可以达到探索乙烯反应原理的教学目标;本实验一般在3分钟之内即可完成,适合课堂上学生分组实验的开展;本实验单次消耗的试剂: 氢氧化钠浊液用量1mL,乙烯利溶液1mL,酸性高锰酸钾溶液1.5mL,石灰水2mL,溴的四氯化碳溶液1mL。试剂用量小,污染少,符合绿色化学要求。
参考文献:
[1]陆金华. 乙烯实验室简易制法的探究[J]. 中学生数理化, 2014, (5): 14~15.
[2]彭梭, 刘延婷, 陈肖宇, 王后雄. 乙烯的实验室制备及性质检验的实验改进[J]. 化学教育, 2016, 37(13): 50~52.
[3]张洁心. 实验室制备乙烯气体的改进方法[J]. 实验教学与仪器, 2013, (12): 34~35.
[4]张熙. 乙醇脱水制乙烯: 碱性氧化物能否作催化剂[J]. 化学教学, 2013, (1): 60~62.

