蝉拟青霉液体发酵条件优化
张学秋, 余晓斌, 刘咏梅
(江南大学 生物工程学院,江苏 无锡 214122)
蝉花是我国传统名贵滋补中药材,是药食兼用虫生真菌,由蝉的幼虫感染蝉拟青霉属真菌形成[1],与冬虫夏草具有相似的活性成分和功能,可作为互补药材[2]。蝉花中含有丰富的活性物质,如多糖、核苷类、虫草酸、氨基酸、脂肪酸、环肽类、麦角固醇等,具有滋补保健、镇静催眠、免疫调节、改善肾功能、抗肿瘤等多种药理作用[3-5]。天然蝉花资源短缺,研究发现人工培养的蝉花与天然蝉花营养成分十分接近,蝉拟青霉为蝉花的无性型阶段,可采用人工培养的方法进行工业化生产,因此可通过液体发酵蝉拟青霉来方便、快速地提取制备生物活性物质,克服天然蝉花资源不足的缺点[6]。多糖是蝉花的主要活性成分之一,具有抗肿瘤、增强免疫、抗氧化、改善肾功能等多种药理作用[7-8],在功能性食品开发和医疗保健方面有着非常好的应用前景。谢飞等[9]研究表明,蝉花多糖在体内外均具有明显的抗肿瘤活性,而且能够增强免疫调节。目前关于蝉拟青霉液体发酵产胞内多糖的研究较多,但是关于蝉拟青霉胞外多糖的研究较少,且对蝉拟青霉液体发酵的研究尚处于摇瓶培养阶段,因此本研究对摇瓶培养条件下蝉拟青霉的液体发酵条件进行了优化,并采用发酵罐扩大培养,可为蝉拟青霉液体发酵的工业化生产提供参考,从而为蝉拟青霉胞内活性物质和胞外多糖的开发及应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株来源 蝉拟青霉菌株(Paecilomycescicadae),本实验室保藏。
1.1.2 培养基(质量分数,%) 斜面培养基:土豆20,葡萄糖2,琼脂2,pH自然;种子培养基:葡萄糖4,玉米粉2,MgSO4·7H2O 0.15,KH2PO40.22,麸皮1,装液量75 mL/250 mL摇瓶;优化前基础发酵培养基:葡萄糖4,牛肉膏0.5,MgSO4·7H2O 0.05,KH2PO40.1,麸皮0.5,装液量75 mL/250 mL摇瓶。以上培养基均121 ℃、0.1 MPa灭菌20 min,葡萄糖等还原糖115 ℃单独灭菌。文中“%”均表示质量分数。
1.1.3 试剂 葡萄糖、牛肉膏、酵母膏、MgSO4·7H2O、KH2PO4、麸皮、乙醇、浓硫酸、苯酚,以上试剂均为分析纯。
1.1.4 仪器与设备 高速离心机(H1850,湖南湘仪实验室仪器开发有限公司);紫外可见分光光度计(日立U-3900,日本日立株式会社);生化培养箱(上海博讯实业有限公司医疗设备厂);电热鼓风干燥箱(上海一恒科学仪器有限公司);恒温调速摇床(强乐实验设备有限公司)。
1.2 方法
1.2.1 培养方法 挑取3~4环斜面活化的菌株于种子培养基中,25 ℃、180 r/min培养3 d得种子液,将种子液按10%接种量接入发酵培养基中,25 ℃、180 r/min培养5 d[10]。
1.2.2 分析检测方法 ①多糖含量检测:发酵液离心取上清,加入其3倍体积无水乙醇4 ℃静置,离心取沉淀,加水溶解并适当稀释后,硫酸苯酚法检测多糖含量[11]。②生物量检测:取一定体积发酵液,于8 000 r/min离心10 min,将菌丝体沉淀用去离子水洗涤数次后置于60 ℃干燥箱中烘干至恒重,称重并计算生物量。③发酵液中残糖检测:3,5-二硝基水杨酸试剂(DNS)法测残糖含量。
1.2.3 单因素实验优化发酵培养基 以优化前发酵培养基为基础,胞外多糖含量及生物量为指标,进行发酵培养基优化[12]。①碳源对蝉拟青霉发酵的影响:分别以葡萄糖、麦芽糖、蔗糖、果糖、乳糖为碳源,添加量4%,其他条件相同,筛选最佳碳源;确定最佳碳源后,添加浓度分别为2%、4%、6%、8%、10%,确定最佳碳源浓度[13]。②氮源对蝉拟青霉发酵的影响:分别以牛肉膏、酵母膏、蛋白胨、牛肉膏和蛋白胨、牛肉膏和酵母膏、酵母膏和蛋白胨为氮源,其他条件相同,添加量1%,筛选最佳氮源;确定最佳氮源后,添加浓度分别为0.25%、0.5%、1%、1.5%、2%,确定最佳氮源浓度;③无机盐对蝉拟青霉发酵的影响:添加MgSO4·7H2O的浓度分别为0.05%、0.1%、0.2%、0.3%、0.4%,确定最佳MgSO4·7H2O浓度;添加KH2PO4的浓度分别为0.05%、0.1%、0.2%、0.3%、0.4%,确定最佳KH2PO4浓度。以上实验均做3个平行,计算均值及误差。
1.2.4 正交实验设计 通过单因素实验确定了各组分的最佳浓度,但只将各组分的最佳添加量组合在一起未必可以获得最佳发酵效果,必须将每个因素的每个水平都互相组合进行全面的实验。针对发酵过程中蔗糖、牛肉膏、酵母膏、MgSO4·7H2O及KH2PO4对蝉拟青霉发酵的影响,选择这几个因素进行5因素4水平的正交实验,具体因素和水平如表1所示。

表1 正交实验因素及水平
1.2.5 小型发酵罐实验 ①分批发酵时不同初糖浓度对蝉拟青霉发酵的影响:采用5 L小型发酵罐进行蝉拟青霉的扩大培养,在5 L发酵罐中加入3 L最佳发酵培养基,121 ℃灭菌30 min,发酵温度25 ℃,转速200 r/min,接种量10%,通气量1.0 L/min,每隔8 h取样测定菌体生物量、多糖及残糖含量[14],分析不同初糖浓度4%、5%、6%、8%对发酵过程中菌体生长、碳源消耗及多糖合成的影响。②补料分批发酵对蝉拟青霉发酵的影响:在5 L发酵罐中加入3 L最佳发酵培养基,但控制初糖浓度为3.5%,121 ℃灭菌30 min,发酵温度25 ℃,转速200 r/min,接种量10%,通气量1.0 L/min,每隔8 h取样分析发酵液中残糖含量,当发酵液中残糖含量降至1.5%时开始补料,将100 mL 60%蔗糖水溶液经121 ℃灭菌后一次性补加入罐中,使发酵液中蔗糖浓度为3.5%,发酵过程中每隔8 h取样测定菌体生物量、多糖及残糖含量,分析补料发酵对蝉拟青霉发酵的影响。
2 结果与分析
2.1 单因素实验优化发酵培养基
2.1.1 碳源对蝉拟青霉发酵的影响 碳源筛选结果如图1所示,以蔗糖为碳源时生物量最高达24 g/L,多糖含量最高为5.28 g/L,其次是葡萄糖,说明菌体容易利用蔗糖和葡萄糖,而蔗糖易分解且来源方便、价格低,因此以蔗糖为最佳碳源分别添加不同浓度,当蔗糖浓度为6%时多糖含量和菌体干重均最高,菌体干重为21.2 g/L,多糖含量5.2 g/L,继续增加蔗糖浓度对菌体生长有抑制作用,过多的糖会加重菌体呼吸使发酵液中溶解氧降低,不能满足菌体生长需求,影响代谢产物多糖的合成,因此最适碳源浓度为6%。

图1 不同碳源及碳源浓度对胞外多糖含量和生物量的影响Fig.1 Effects of different carbon source and carbon source concentration on exopolysaccharides production and biomass
2.1.2 氮源对蝉拟青霉发酵的影响 选择3种氮源牛肉膏、蛋白胨、酵母膏,分别单独添加及相互组合,结果如图2所示,采用牛肉膏和酵母膏(质量比1∶1)复合氮源时,菌体干重最高达25.4 g/L,多糖含量也最高为5.35 g/L,说明复合氮源比单一氮源效果好,复合氮源可以提供菌体更多不同的生长因子,有利于菌体生长。以牛肉膏和酵母膏(质量比1∶1)作为氮源,添加不同浓度发现氮源最适浓度为0.5%,此时菌体生物量达到最高为23.2 g/L,多糖含量最高为5.19 g/L,而氮源浓度过高会使发酵后期氮素积累,抑制菌体代谢及多糖合成。

图2 不同氮源及氮源浓度对胞外多糖含量和生物量的影响Fig.2 Effects of different nitrogen source and nitrogen source concentration on exopolysaccharides production and biomass
2.1.3 无机盐对蝉拟青霉发酵的影响 本研究考察了无机盐KH2PO4和MgSO4·7H2O的浓度对胞外多糖含量和生物量的影响,如图3所示,MgSO4·7H2O的浓度为0.4%时,菌体生物量达到最大为28.4 g/L;浓度0.1%时多糖含量最高为5.41 g/L,当KH2PO4的浓度为0.2%时,菌体生物量最高达29.6 g/L,而多糖含量最高是在其浓度为0.1%时。

图3 无机盐浓度对胞外多糖含量和生物量的影响Fig.3 Effects of different concentration of inorganic salt on exopolysaccharides production and biomass
2.2 正交实验结果
正交实验结果如表2所示,五因素列的极差分别是3.161、0.302、0.725、0.882、1.1,即A﹥E﹥D﹥C﹥B,因素A蔗糖的极差最大说明蔗糖水平对发酵的影响最大,它的第4水平对应多糖产量最高。由表2可知,正交试验的最优方案为A4B4C1D4E3,但是16次试验中并没有分析出来最优方案,而与最优方案最接近的是16号试验,按照最优方案补充试验,结果测得多糖含量5.96 g/L,生物量42 g/L,效果优于16号试验,因此确定方案A4B4C1D4E3为最佳发酵培养基,即蔗糖8%,牛肉膏0.75%,酵母膏0.125%,MgSO4·7H2O 0.3%,KH2PO40.2%。
2.3 小型发酵罐扩大培养
2.3.1 蝉拟青霉菌体的生长曲线 采用5 L小型发酵罐进行蝉拟青霉的扩大培养,菌体的生长曲线如图4所示,发酵初期菌体活力旺盛,延滞期较短,很快进入快速生长阶段,此时碳源主要用于菌体生长,代谢产物积累较少;发酵约40 h后菌体仍处于快速生长期,此时多糖积累速度加快,碳源同时用于菌体生长及胞外多糖合成,消耗速度加快;发酵72 h后菌体到达稳定期,多糖积累速度变缓至趋于稳定,碳源消耗缓慢。结果表明蝉拟青霉菌体活力旺盛,生长速度较快且胞外多糖的合成是和菌体生长相偶联的。
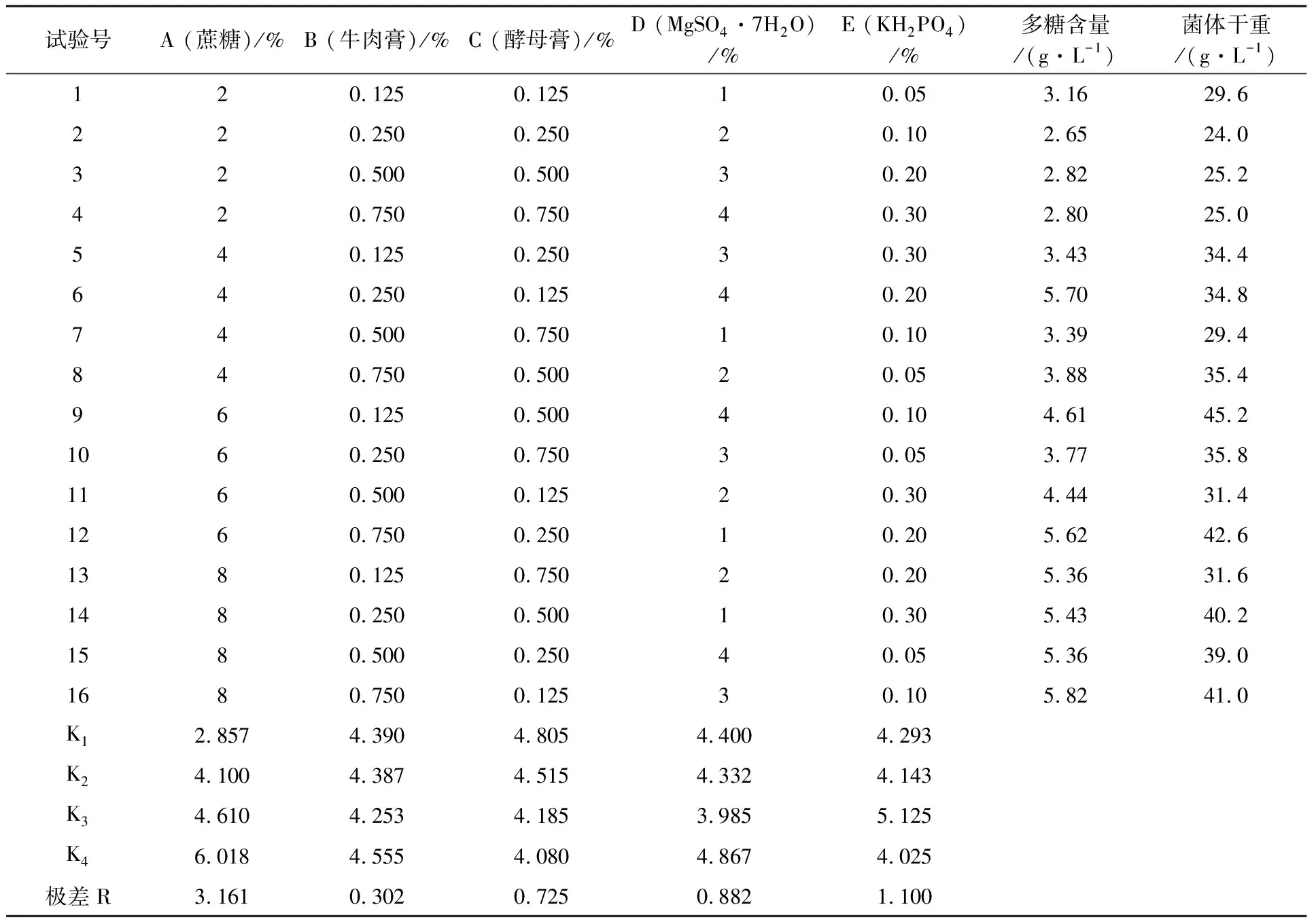
表2 正交实验结果与分析

图4 蝉拟青霉的生长曲线Fig.4 The growth curve ofPaecilomyces cicadae
2.3.2 不同初糖浓度对菌体干重的影响 考察不同初糖浓度4%、5%、6%、8%对菌体干重的影响,结果如图5所示,初糖浓度为4%时,菌体生长速度最快,生物量增加也最快,进入稳定期时间较早,说明在较低初糖浓度下利于菌体生长;初糖浓度为5%时,菌体生长速度也较快,生物量最高达38 g/L;初糖浓度为6%时,菌体生长速度相对较慢,进入稳定期时间延长,最终生物量较低;初糖浓度8%时,菌体生长速度最慢,说明高初糖浓度对菌体生长有一定抑制作用。
2.3.3 不同初糖浓度对胞外多糖含量的影响 考察不同初糖浓度4%、5%、6%、8%对多糖含量的影响,结果如图6所示,初糖浓度为4%时,多糖积累速度最快但含量不是最高,说明碳源不足不能同时满足菌体生长和多糖合成的需要,菌体较早终止生长代谢进入稳定期;初糖浓度为5%时,菌体生物量最高,多糖含量也最高为5.5 g/L,说明菌体量多其多糖代谢也旺盛;初糖浓度为6%时,由于较高初糖浓度对菌体生长有抑制作用,且产生一定底物抑制效应不利于多糖积累,因此发酵结束时多糖含量相对较低;初糖浓度8%时多糖积累速度最慢且含量最低,进一步说明高初糖浓度抑制多糖合成。

图6 不同初糖浓度对胞外多糖含量的影响Fig.6 The effect of different initial sugar concentration on the production of extracellular polysaccharides
2.3.4 不同初糖浓度对残糖变化的影响 不同初糖浓度的残糖变化如图7所示,初糖浓度为4%时,较低初糖浓度有利于菌体生长代谢,耗糖速度较快,发酵结束后残糖量最少;初糖浓度为5%时,菌体生长及多糖合成都较旺盛,对碳源消耗较大,发酵结束时残糖量较少;初糖浓度为6%时,较高初糖浓度对菌体生长有抑制作用,发酵初期降糖速度缓慢,之后随菌体生长及代谢速度加快耗糖速度也开始加快,但较高糖浓度会产生一定底物抑制效应影响多糖代谢,菌体对蔗糖利用率较低使发酵结束时残糖量相对较高;初糖浓度为8%时,底物抑制效应愈显著,残糖量越高。
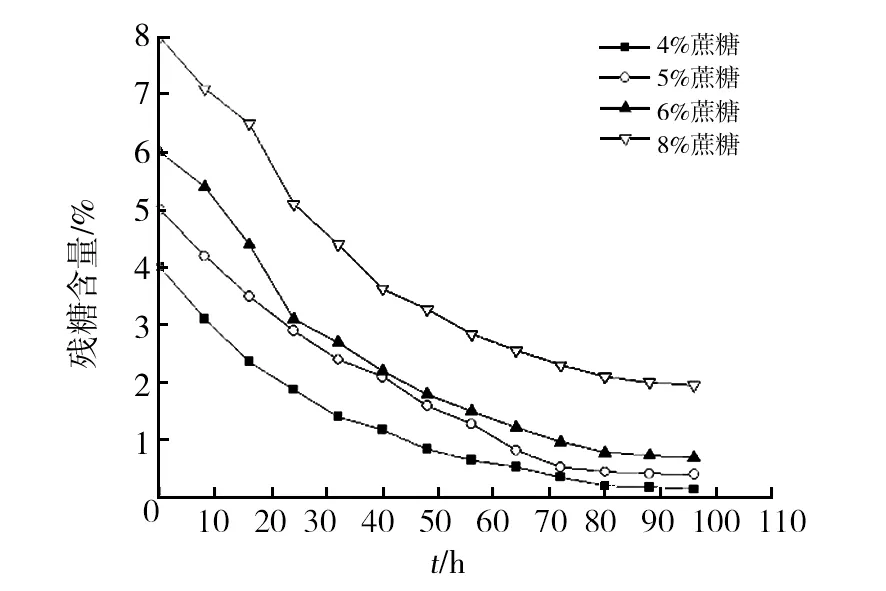
图7 不同初糖浓度对残糖变化的影响Fig.7 The effect of different initial sugar concentration on the change of residual sugar concentration
2.3.5 补料分批发酵 在分批发酵过程中,发酵初始糖浓度过高会抑制菌体生长代谢,而初始糖浓度过低又不能同时满足菌体生长及代谢的需要,因此尝试补料分批发酵,结果如图8所示。发酵初期在较低初糖浓度下菌体生长速度较快,当发酵约32 h残糖降到1.5%以下时开始补料,补料后菌体生长速度明显增加,胞外多糖合成速度也开始加快,菌体进入稳定期的时间较早。发酵结束时菌体量高达40 g/L,多糖含量最高达到5.89 g/L,均高于分批发酵。因此采用补料分批发酵有助于提高发酵水平,充分利用碳源以避免原料浪费。
图8 补料分批培养时的发酵过程曲线Fig.8 The fermentation process curve of fed-batch cultivation
3 讨 论
由于目前关于蝉拟青霉胞外多糖的研究较少,本研究通过单因素及正交实验对蝉拟青霉发酵产胞外多糖的发酵培养基进行了优化,确定了最佳发酵培养基并发现蔗糖是影响发酵的最主要因素,该条件下获得了较高的多糖含量及生物量,较优化前提高了一倍,可为蝉花真菌发酵产胞外多糖的研究提供参考。
目前对蝉拟青霉液体发酵的研究尚处于摇瓶培养阶段,因此本研究采用5 L发酵罐进行蝉拟青霉的扩大培养,发现发酵罐培养时最适初糖浓度为5%,8%初糖浓度会产生抑制作用,这与摇瓶发酵有所不同。可能原因:一是由于发酵罐培养较摇瓶培养通风溶氧好,菌体延滞期缩短、生长更快且合成多糖时间相对较早,对碳源消耗快,但初糖浓度过高导致发酵液中渗透压过高,影响菌体对营养物质的吸收利用,从而抑制菌体生长,菌体量少其代谢产生多糖也少,而摇瓶培养时由于菌体延滞期较长生长速度慢,对碳源消耗较慢,所以抑制作用相对不明显;二是发酵罐培养时菌体合成多糖时间相对较早,存在一定产物抑制效应,且初糖浓度过高还会产生底物抑制效应,而摇瓶培养时多糖合成较晚且对碳源消耗慢,因此产物及底物的抑制效应相对不明显。通过在发酵过程中补料发现,补料分批的发酵效果优于分批发酵,不仅提高了多糖产量还避免了原料浪费。本研究对蝉拟青霉液体发酵产胞外多糖发酵工艺的优化,大幅提高了胞外多糖产量及生物量,降低了生产成本,可为蝉拟青霉液体发酵的工业化应用提供参考,从而为蝉拟青霉胞内活性物质和胞外多糖的开发及应用奠定基础。

