小型猪近交系鉴定研究进展*
冯书堂 牟玉莲 王太平 庄爱萍
(1.中国农业科学院北京畜牧兽医研究所,北京 100193)(2.北京盖兰德生物科技有限公司, 北京 100007)
由于近交系动物遗传稳定、反应灵敏、生物学特性一致性好,能提供精确、科学的检测结果,已广泛应用于生命科学众多领域,如单克隆抗体制备等,并由此创建了多项具有划时代意义的理论学说,带来了年收益达上亿元的生物医药价值[1]。哺乳动物近交系动物,已成为解决人类疑难病症和生命基础科学领域研究中不可或缺的技术平台之一。
自Clarence C. Little于1909年研究建立了第一个近交系鼠以来[2],先后建立了同工酶蛋白质鉴定研究、生化标记鉴定研究、微卫星变异和异体皮肤移植鉴定技术方法,如,相关生理生化标记、DNA指纹图、皮肤移植、DNA遗传标记、SNP分析等分子遗传学的方法[3]。随着哺乳动物近交系小鼠遗传鉴定的研究方法标准的建立,大大加快了哺乳动物遗传近交系培育与应用研究的步伐,目前已培育出数百种近交系鼠类等小型哺乳动物。
由于大型哺乳动物猪在生殖、生理、代谢等的诸多特异性,上世纪50年代虽大规模地开展了近交系猪培育研究未获得成功,所以其鉴定研究也未有建树。随着近50年来中国在大型哺乳动物近交系猪资源创新研究中取得了突破性进展,参照近交系鼠国际公认的技术方法,先后开展了同工酶蛋白质、DNA遗传标记、特异等位基因、SNP分析和异体皮肤移植鉴定技术等方法[4-10],使大型哺乳动物近交系实验用小型猪鉴定研究取得了重大进展。分述如下:
1 创建了猪近交系异体皮肤移植鉴定方法
皮肤移植是鉴定近交系鼠类最经典、有效的方法, 国内外有关近交系鼠异体皮肤移植鉴定已有许多报道[10]。依据近交系鼠皮肤移植鉴定技术原理,结合实验用小型猪的生理种质特性,中国的Mu等与解放军304医院合作研究[11],以近交系F20为材料,率先开展了五指山小型猪近交系异体皮肤移植鉴定方法研究,未发生免疫反应,证明五指山小型猪近交系培育成功。创建了近交系猪的异体皮肤移植鉴定方法,其技术要点如下:(1)需对试验组(异体皮肤移植)和对照组(自体皮肤移植)公母猪合理安排;(2)测试用猪大小限制在3.5月龄以内;(3)皮瓣移植面积不小于4 cm×6 cm;(4)每周需对皮肤创面观察一次,连续4周。早期7~14 d,主要观察移植创面皮肤颜色、血运建立及移植皮肤的存活率等;移植14 d以后,观察移植创面无明显红肿、渗出、水泡、脱屑、脱落、溃疡、坏死等排斥反应现象;(5)观察期同时对其进行外周血与免疫相关细胞、生长因子等测定,进行移植皮肤和正常皮肤免疫组化H.E、Masson染色等超微结构变化观测。依据上述5种研究结果,实验猪与对照组两组间是否反应一致,最终可判断为测试猪异体皮肤移植未发生免疫排斥反应,即可判断该测试近交系猪培育成功。这一鉴定方法,为大型哺乳动物近交系的鉴定提供了科学依据。截至目前,国外虽有近交系猪异体皮肤移植研究论文[11-12],但国内、外均未见如此全方位、系统的近交系猪异体皮肤移植鉴定技术方法的报道。
2 建立了猪近交系鉴定基因组水平鉴定标准
据国内、外研究报道,通过利用Illumina猪高密度SNP芯片(6万个SNPs)对猪、牛、鸡、鼠等动物遗传资源进行遗传学评估与开发利用已屡见不鲜,但用于近交系猪鉴定还未见报道。我国冯书堂等[3],曾将此技术用于近交系猪F17~F22共6个世代的遗传检测研究,并以非近交系海南五指山猪为对照组,共计112个样品,研究结果证明,分布于近交系18对常染色体上的50 418个有效SNPs中,该近交系群体F20SNPs已被固定的比例高达80.0%以上。随着世代的推进,几乎在所有的染色体上都有一些区域有规律地被慢慢固定,杂合度由大到小直至为0,而非近交系海南五指山猪群体几乎所有染色体区域均表现高度杂合,50 418个有效SNPs呈弥漫性、均匀性、无规律地分布于18个染色体上,发现了近交系猪“不纯合”基因的遗传现象,揭示了近交系猪群体基因杂合度均为1的分子遗传特征。利用猪近交系鉴定基因组水平验证策略及手段,证明培育出的近交系是一种新的遗传种质资源,如图1所示。
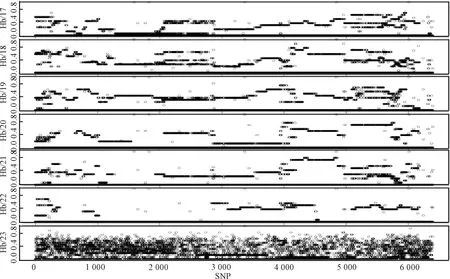
图1 近交系WZSP与非近交系海南WZSP 1号染色体上50 418个SNPs的纯合度分析(选自:遗传,2016.28(3):178)Fig.1 Homozygosity analysis of 50 418 SNPs between the inbred lineWZSP and non-inbred line Hainan WZSP on Chr. 1
依据Illumina猪高密度SNP芯片分析结果,可将WZSP近交系与WZSP非近交系区分开来,并提出了该近交系与非近交系 WZSP的鉴定标准,已分别授权国家发明专利(ZL201410152864.5;ZL201410562272.0; US9029090B2)等[13-15]。
3 建立了五指山小型猪近交系其他多种鉴定方法
据报道利用SNP位点分析、微卫星标记、特异性等位基因等对不同猪品种进行遗传分析已有多年并有许多报道[9,16-18],已建立了多种近交系猪的鉴定方法:
3.1 同工酶蛋白质鉴定研究[9]
在众多的蛋白质和微卫星标记中,以哪些标记作为遗传控制的标准?我国科学研究人员李奎等,参照前人在猪品种中做过的标记位点,建立的方法,以及哺乳动物实验动物小鼠和大鼠的位点的标准,考察这些位点在染色体的分布。选择可以代表实验用猪特点的6种标记,如表1。
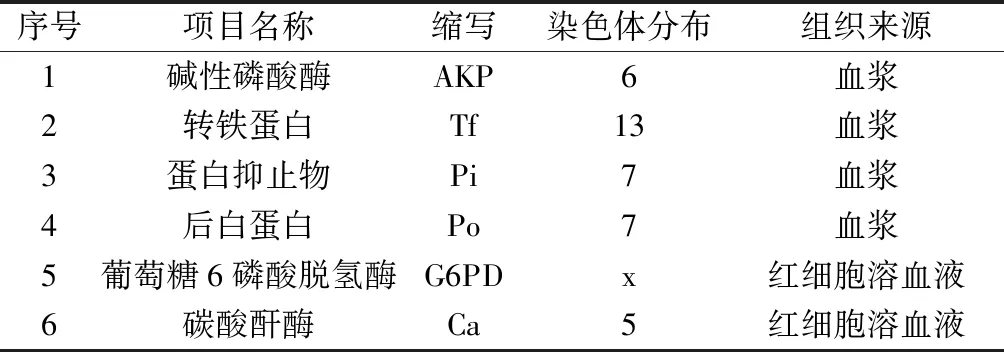
表1 蛋白质标记、染色体分布、组织来源Table 1 Protein markers, chromosomedistribution, tissue sources
蛋白质标记检测采用了最常用的电泳方法,对该近交系与贵州小型猪、广西巴马小型猪比对,研究发现:依据三品系实验用小型猪在6个蛋白质标记等位基因频率的分布差异性,发现AKP蛋白质标记AA型,可作为该近交系与贵州、广西巴马小型猪品系间鉴定方法之一[9]。
3.2 特异性微卫星分子遗传标记研究
我国冯书堂等报道[9]在微卫星检测、 选用微卫星标记研究中,选择、提出21个具有通用性、多态丰富性、有效性:如下四个特点微卫星位点,具有通用性:属于美国猪基因组协作计划推荐的第11组用于遗传多样性和亲缘鉴定研究的微卫星标记。具有分布广:选择的21个位点在猪单倍体中的每条染色体中都有,且1号和3号染色体的两个标记分布于染色体的不同臂,这些引物在普通猪群的多态性都很好,等位基因数最少的为4;其中的14对标记S0155、SW240、SW72、SW0227、S0005、S0228、S0101、S0355、SW911、SW951、S0386、S0090、SW769、SW857,研究证明被用来进行奥地利猪种(长白、皮特兰和大白猪)的亲子鉴定,其中10对引物进行多重PCR的鉴定结果的可靠性都在99%以上。
研究所用S0155,CGA,SW240,S0005等21对微卫星标记,分别在1q、1q、2p、5q染色体位点上、分别具有6、12、8和10个等位基因数,研究表明,可以得到用于三个小型猪品种准确分辨的座位有SW24,SW951,S0005,S0101,SW769,S0355,SW902,SW72,S0218,S0090,CGA。三个小型猪品种中特有等位基因共96个,其中贵州小型猪有49个,WZSP近交系有22个,广西巴马小型猪有25个,这些片段可以用作三个小型猪品种个体的遗传鉴定。尤其S0005位点只wzsp近交系完全纯合,可作为该近交系与贵州、广西小型猪之间的鉴定标准与方法[9]。不同品种的猪的基因型检测结果见表2。
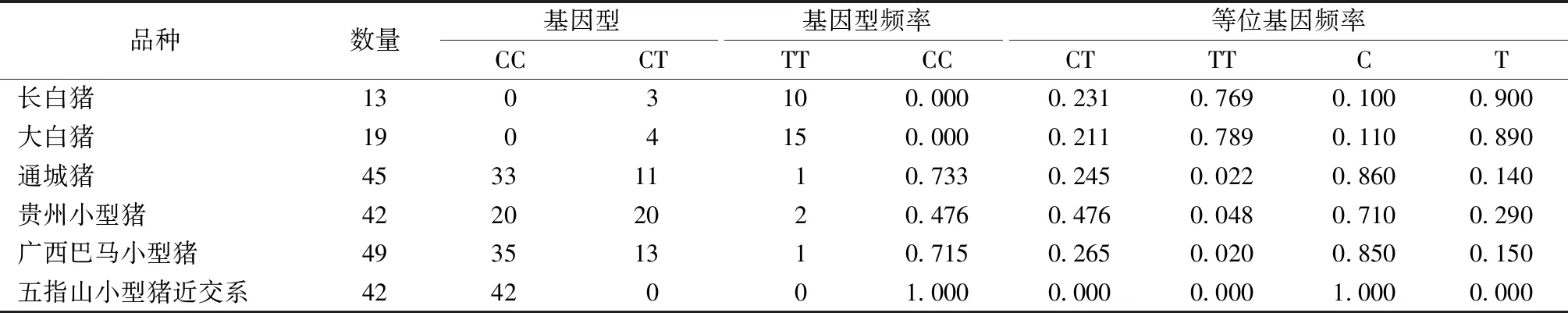
表2 不同品种猪的Pnas-4基因StyI多态检测结果Table 2 Polymorphism detection results of pnas-4 gene StyI in pigs of different breeds
结果表明,五指山小型猪近交系只存在CC基因型和C等位基因,而其它品种的猪存在T等位基因。该辅助鉴定五指山小型猪近交系的方法及其专用引物,已授权美国发明专利(US9029090B2)[15];此外,利用该近交系与贵州香猪、广西巴马小型猪比对研究,发现在SW24等10个基因座位上有22个特异等位基因,可做为三品种间的区别鉴定方法,亦可作为其鉴定方法[9];SW936 位点以作为“五指山小型猪的一种分子标记及其应用”,已授权国家发明专利(ZL200510008994.2)等遗传特异性,均可以作为鉴定方法,把该近交系同其他品种猪区别开来[19]。
4 异体皮肤移植技术是近交系最佳鉴定方法
研究表明,同工酶蛋白质特异性鉴定研究,作为物种检测遗传特性的一种方法,是基于20世纪60年代蛋白电泳技术的出现而应用。但是,蛋白和同工酶都是基因的表达产物,非遗传物质本身。蛋白电泳所检测的主要是血浆和血细胞中可溶性蛋白和同工酶中氨基酸的变化,其测定结果易受检测对象环境和发育状况的影响,以及蛋白电泳检测诸多条件的限制影响。因此,这些因素决定了蛋白电泳检测技术数据具有一定的局限性,但由于蛋白电泳技术操作简便、快速及检测费用相对低廉,目前仍是非近交系物种之间生化遗传鉴定的方法之一。
特异性微卫星分子遗传标记研究,是以个体间遗传物质内核苷酸序列变异为基础的遗传标记,是 DNA 基因水平遗传多态性的直接的反映。与其他几种遗传标记鉴定方法——同工酶蛋白质、形态标记、同工酶标记、细胞标记[3]相比DNA遗传标记包括特异等位基因、SNP分析等鉴定技术[4-9],DNA基因分子标记等具有较高科学性,由于大多数分子标记为共显性,不受生物发育阶段、不同组织的影响;基因组变异极其丰富,基因分子标记的数量多,但少量基因不影响目标性状的表达,与性状的主效基因连锁性不强,使其有时应需选择多个检测目的基因才能达到目的。其检测手段具有快速、准确性能高,是目前非近交系物种鉴定的方法之一,但因基因分子标记鉴定程序需引物合成、测序需使用特殊仪器设备,相对而言技术复杂、且费用高,尤其是猪高密度SNP芯片技术所需测定费用更高,多数用于特殊情况下如法学等非近交系物种之间的鉴定。
异体皮肤移植应是近交系动物鉴定的最经典、有效方法,是基于该近交系品种(或品系)是来源于非近交系种群,近交系虽是具有等位基因高度纯合的特殊的遗传群体,但其遗传结构基因几乎100%来源于某培育它的非近交系一品种(或品系)。因此,他们具有共同的遗传基础,如特殊基因等,具有来源某一非近交系品种群体的特征和某些共同等位基因的群体。因此,利用上述同工酶蛋白质、DNA遗传标记、特异等位基因等技术,可以鉴定该近交系与其他品种(或品系),但就很难利用此方法找出、提供其与来源某一品种群体不同的、量化指标、令人信服的证据。由于科学发展到目前的局限性,还未建立起公认的近交系高通量SNP技术鉴定标准,所以利用高通量SNP技术手段,也难以提供量化指标、令人信服的证据。
大量的研究结果已证明,近交系动物基因高度纯合、免疫抗原高度一致,其异体器官移植不会发生免疫排斥反应;而皮肤免疫排斥为典型的细胞免疫排斥反应,只有自体和同系皮肤移植才不会产生免疫排斥[20],又是排斥反应最为直观的器官。因此,利用异体皮肤移植鉴定近交系正是基于这两大特点,可有效地把近交系同培育的来源供体品种(或品系)区别开来、更能同其他品种区别开来。
我国开展的猪异体皮肤移植未发生免疫排斥反应,不仅验证近交系培育成功,也为大型哺乳动物近交系鉴定,提供科学的检测技术和方法,包括:实验动物测试月龄、皮肤移植面大小、观测方法与时间、外周血项因子测定等,一整套系统技术方法与数据[10]。截至目前,利用异体皮肤移植技术,全方位、系统的鉴定近交系猪,国内、外均未见报道。
5 提出近交系猪5条鉴定标准(草案)
基于上述研究与分析,中国农科院北京畜牧兽医研究所科研人员,2013年在农业部组织的“五指山小型猪近交系培育成功”专家鉴定会上,提出了“提出近交系猪6条鉴定标准”(草案)。在国家科技部实验动物专家委员会多位专家参于下,依据国际有关啮齿类近交系鼠类的规定和近交系鼠的遗传监测方法,基于该近交系猪种质和分子遗传特异性,修改为5条鉴定标准(草案)刊登在《实验动物科学》[21]。
上述标准(草案)的提出,将为我国创新资源近交系猪培育和开发利用奠定科学基础,同时为我国拥有自主知识产权的近交系小型猪新品系提供技术保障,无疑将促进我国人类生命科学、医学产业链的发展,并使我国大型哺乳动物近交系研究处于国际领先地位。

