西兰花副产物中萝卜硫素提取、纯化及鉴定
张锦华,郭 楠,2,杨 妍,李庆鹏,*,郭 芹,*,段玉权,哈益明
西兰花为十字花科芸薹属蔬菜,因其含有丰富的营养物质且配比合理被称为“蔬菜皇冠”[1]。多项流行病学研究表明,食用十字花科蔬菜与降低癌症风险有关。进一步研究证实十字花科蔬菜中的异硫氰酸盐是其抗癌作用的主要成分,而萝卜硫素更是其中的佼佼者[2-3]。萝卜硫素化学名称为1-异硫氰酸-4-甲磺酰基丁烷,在植物中以其前体物质萝卜硫苷的形式存在,在特定条件下经黑芥子酶水解得到[4]。目前人们已经通过化学合成[5]、半合成[6]和酶法提取获得萝卜硫素,但利用化学合成与半合成法合成萝卜硫素需使用大量有毒试剂,且反应过程难以控制,因而并未得到广泛应用;而酶法与溶剂提取法相结合从植物中提取天然萝卜硫素,具有操作简单、成本低廉、产物天然等优点,近年来被广泛应用[7]。
对于萝卜硫素的提取,研究者多以西兰花种子为原料[8-10],还有少数从西兰花芽苗中获取[11],但较少人利用西兰花采收后副产物(丢弃的根茎叶)为原料提取,究其原因是萝卜硫素在种子中含量最高,在种子发芽至成熟的过程中分化至各植物组织,含量大小依次为花蕾>子叶>茎[12]。而实际上,西兰花采收后产生大量副产物,其中大多数被直接丢弃,综合利用率极低,且副产物腐烂后严重影响环境卫生,因此利用西兰花副产物提取萝卜硫素具有重要的理论和实践意义。
从植物中提取萝卜硫素有酶解和提取2 个过程。萝卜硫苷在黑芥子酶作用下的水解产物复杂,除萝卜硫素外还有其他异硫氰酸盐、硫氰酸盐、腈类、恶唑烷酮类和氰化物等,且产物的组成和含量与水解条件、蛋白质辅助因子、Fe2+等有关[13]。因此,本实验拟以西兰花副产物为原料提取萝卜硫素,通过单因素试验和响应面试验优化酶解浸提工艺,并在最佳工艺的基础上利用半制备高效液相色谱(high performance liquid chromatography,HPLC)纯化和富集萝卜硫素,最后通过超高效液相色谱-质谱(ultra performance liquid chromatography-mass spectrometry,UPLC-MS)联用技术对其进行鉴定。本研究旨在提供一种原料来源广、方便、快速、高效的萝卜硫素提取方法。
1 材料与方法
1.1 材料与试剂
丢弃的西兰花副产物(主要为茎、叶),新鲜无病害,来自于北京市丰台区新发地农产品批发地;芥菜籽香港蔡兴利国际有限公司。
萝卜硫素(纯度≥95%,色谱纯) 上海源叶生物科技有限公司;磷酸氢二钠、磷酸、丙酮(均为分析纯)国药集团化学试剂有限公司;乙腈、甲酸(均为色谱纯) 赛默飞世尔有限公司。
1.2 仪器与设备
AE-240型电子分析天平 梅特勒-托利多仪器(上海)有限公司;KQ5200DB型数控超声波清洗器昆山市超声仪器有限公司;SHB-III循环水式多用真空泵 郑州长城科工贸有限公司;UV-1800紫外-可见分光光度计 日本岛津公司;真空冷冻干燥机 北京博医康实验仪器有限公司;RE-2000旋转蒸发器 上海亚荣生化仪器厂;1200 HPLC仪、Varian Prostar 218半制备HPLC仪、1290-QE-Focus UPLC-MS仪 美国安捷伦公司。
1.3 方法
1.3.1 萝卜硫素提取
综合参考文献[8-11]的提取方法并加以改进,萝卜硫素提取过程如下:
样品→加磷酸缓冲液→加外源酶溶液→超声酶解→冷冻干燥→丙酮提取→抽滤→萝卜硫素粗提取液→旋蒸浓缩→50%乙腈溶液复溶→过0.45 μm滤膜→HPLC分析
样品前处理:西兰花副产物洗净,于鼓风干燥箱中70 ℃烘干至恒质量,粉碎后过60 目筛,装袋置干燥器保存备用。
外源黑芥子酶制备:参考胡翠珍等[14]的方法,取新收获芥菜籽,粉碎,过60 目筛,称取5 g至三角瓶中,加入250 mL蒸馏水,超声波振荡20 min,过滤除杂得粗酶液。使用前现配或储存于-20 ℃。
萝卜硫素提取:准确称取西兰花粉2 g于100 mL三角瓶中,加10 mL pH 5.0磷酸缓冲液,15 mL外源酶溶液,于100 Hz超声波中酶解60 min,结束后置于-20 ℃冰箱预冻,后真空冷冻干燥18 h。干燥样品用30 mL丙酮溶解,超声提取90 min,抽滤,得萝卜硫素粗提取液,40 ℃旋转蒸发至干,用3 mL 50%乙腈溶液复溶,过0.45 μm有机滤膜,澄清液进HPLC分析检测。
1.3.2 萝卜硫素定量测定
1.3.2.1 HPLC检测
参考Liang Hao等[15]的方法并加以改进。采用Innoval C18色谱柱(4.6 mm×250 mm,5 μm),紫外检测器,检测波长201 nm,柱温35 ℃,进样量20 µL,流速1.0 mL/min。流动相为乙腈和水,梯度洗脱:初始流动相为10%乙腈溶液,10 min内线性变化到60%乙腈溶液,然后在5 min内线性变化到100%乙腈,维持2 min。
1.3.2.2 萝卜硫素标准曲线制作
准确称取5 mg萝卜硫素标准品于5 mL 50%乙腈溶液中,配成质量浓度为1 mg/mL标准溶液,摇匀后逐级稀释成质量浓度分别为1、5、10、15、20 μg/mL和50 μg/mL的标准溶液,按1.3.1节方法分别进行检测,得到萝卜硫素保留时间与对应的峰面积。以萝卜硫素质量浓度为横坐标、对应的峰面积为纵坐标,绘制萝卜硫素质量浓度-峰面积标准曲线,得到回归方程。
1.3.2.3 萝卜硫素定量计算
在1.3.1节条件下,分别测定萝卜硫素标准品与萝卜硫素粗提取液,根据回归方程计算粗提取液中萝卜硫素质量浓度,萝卜硫素提取量按式(1)计算:

式中:C为萝卜硫素粗提取液质量浓度/(μg/mL);V为复溶溶液体积/mL;m为西兰花副产物粉的质量/g。
1.3.3 单因素试验
按照1.3.1节方法,控制其他条件不变,进行单因素试验。分别设置萝卜硫素提取条件为西兰花副产物干燥温度(40、50、60、70 ℃和80 ℃)、酶液添加量(5、10、15、20 mL和25 mL)、酶解pH(3.0、4.0、5.0、6.0和7.0)、酶解温度(25、35、45、55 ℃和65 ℃)、酶解时间(15、30、45、60、75 min和90 min)、超声时间(30、60、90、120 min和150 min)。每组实验重复3 次。
1.3.4 响应面优化酶解浸提工艺
根据单因素试验结果,选取其中对萝卜硫素提取量影响较大的3 个因素pH值、酶解温度、酶解时间进行3因素3水平的Box-Behnken试验,以萝卜硫素提取量为响应值。因素与水平设计见表1。
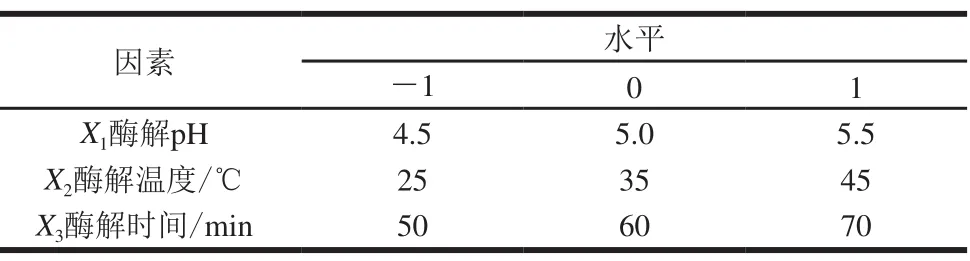
表 1 响应面试验因素与水平Table 1 Factor and level by Box-Behnken
1.3.5 半制备HPLC纯化萝卜硫素
在最佳提取工艺的条件下,对萝卜硫素提取实验进行100 倍放大,收集所有萝卜硫素粗提取液,过滤后用半制备HPLC分离纯化,收集相应的萝卜硫素组分。色谱柱为Innoval C18(21.2 mm×250 mm,10 μm),检测器为紫外检测器,检测波长201 nm,柱温35 ℃,进样量1 mL,流速10.0 mL/min,流动相为乙腈和水,梯度洗脱:初始流动相为5%乙腈,40 min内线性变化至65%乙腈,维持5 min,后以5%乙腈维持10 min,对照萝卜硫素标准品的出峰时间对应收集萝卜硫素洗脱液。以此为单元,富集萝卜硫素,洗脱液旋蒸至干后得到萝卜硫素纯品。取少量纯化物按1.3.2节方法进行检测,以1.3.2节方法定量,按式(2)计算回收率,以面积归一化法计算纯化后萝卜硫素纯度。

1.3.6 UPLC-MS鉴定萝卜硫素
取少量萝卜硫素纯化物用乙腈(含0.1%甲酸)溶解,用UPLC-MS方法对其进行结构鉴定。
UPLC条件:色谱柱:ZORBAX RRHD Eclipse Plus C18(2.1 mm×100 mm,1.8 μm);柱温:30 ℃;进样量:5 μL;流动相:A:0.1%甲酸溶液,B:乙腈;流速:0.20 mL/min;洗脱方式:梯度洗脱,0~30 min内由5% B线性变化至90% B,维持5 min,然后在10 min内B由65%线性变化至5%。
MS条件:参考Ares等[16]方法,并加以改进。Orbitrap Q Exactive Focus高分辨质谱,电子电离源正离子模式,扫描模式Full MS-dd-MS2,分辨率7 000,扫描范围m/z 50~500;雾化气N2,1.5 mL/min;辅助气N2,8 mL/min;喷雾电压3.4 kV;毛细管温度320 ℃;辅助气加热温度350 ℃;二级质谱碰撞电压15/30/45 V;分辨率17 500。
1.4 数据处理
应用Excel 2010与SPSS 19.0对单因素试验进行数据分析(用LSD多重比较进行差异显著性分析,P<0.05,差异显著),采用Design-Expert V8.0.6软件进行响应面设计与数据处理,用Galaxie Chromatography Data System操作半制备HPLC。UPLC-MS中UPLC由Control Panel软件控制,MS由Tune、Tracefinder 4.1软件控制,数据由Thermo Xcalibur Qual软件处理,所有图形均用Origin 9.0软件绘制,结构式由Chemdraw 16软件绘制。
2 结果与分析
2.1 萝卜硫素HPLC结果
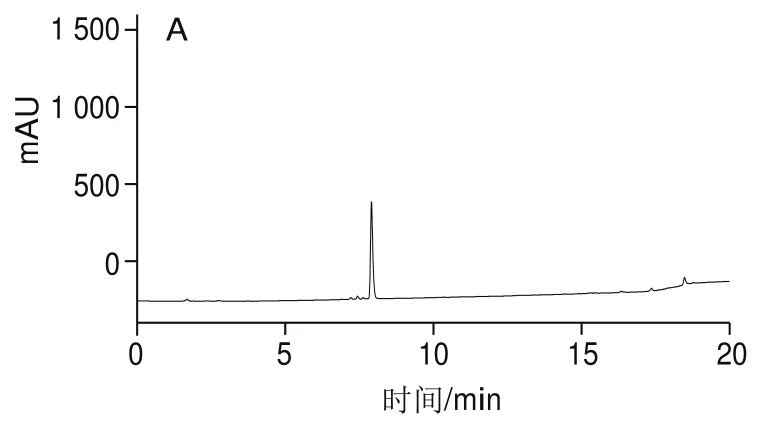
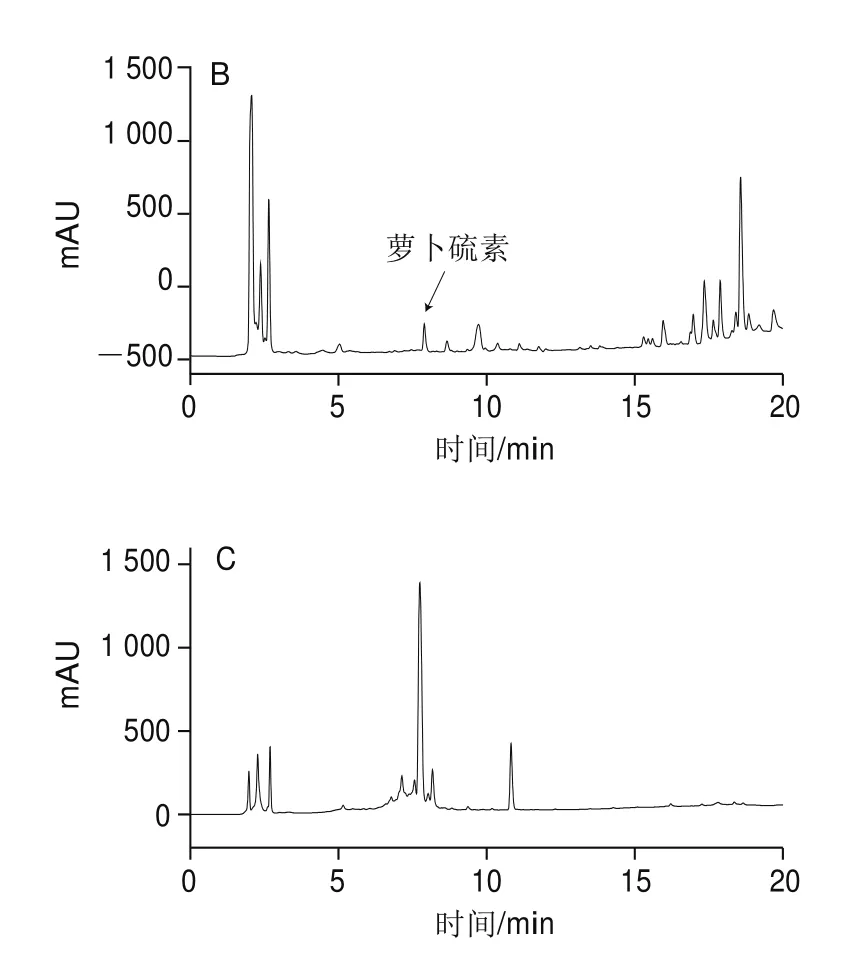
图 1 萝卜硫素标准品(A)与粗提取物(B)、纯化物(C)HPLC图Fig. 1 HPLC chromatograms of sulforaphane standard (A), crude extract (B) and purified sulforaphane (C)
如图1所示,对比萝卜硫素标准品与粗提取物两者的出峰情况,发现在保留时间为7.909 min时均有峰出现,峰形一致且无杂峰干扰,因此判定保留时间7.90 min为萝卜硫素峰,并以此时的峰面积为萝卜硫素定量。
在相同HPLC条件下,得到萝卜硫素质量浓度-峰面积标准曲线,经线性回归,得到回归方程为Y=44 980.333x-45.169,R2=0.996 6,说明回归方程拟合性好,可作为萝卜硫素定量测定的标准曲线方程。
2.2 单因素试验结果
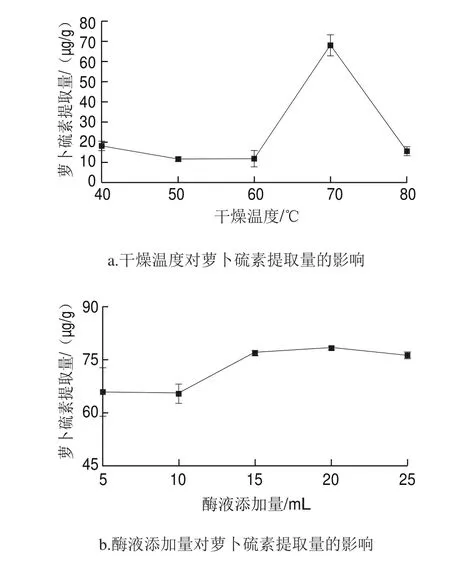
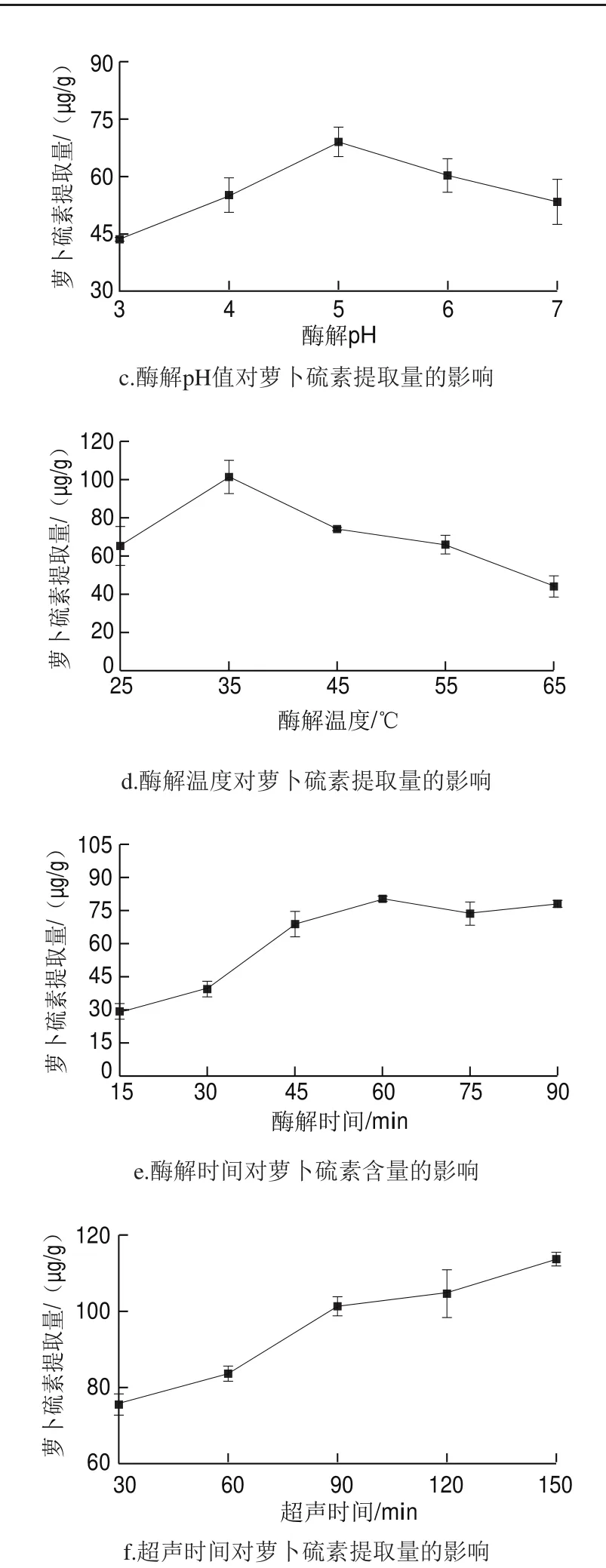
图 2 萝卜硫素提取单因素试验结果Fig. 2 Results of one-factor-at-a-time experiments
由图2a可知,西兰花副产物在70 ℃干燥时,萝卜硫素提取量显著高于其他温度下萝卜硫素提取量,约为6~7 倍。推测是70 ℃干燥时萝卜硫苷并未热分解且全部保留,而西兰花自身的ESP蛋白(一种特异硫蛋白,主要诱导硫代葡萄糖苷水解生成萝卜硫素腈[17])和黑芥子酶在70 ℃下完全失活,再次添加外源酶时才生成萝卜硫素;当温度低于70 ℃时,西兰花中的ESP蛋白和黑芥子酶均未失活,但ESP蛋白促使萝卜硫苷生成萝卜硫素腈,从而使萝卜硫素含量降低。这一推测与Maheshwari[18]和Pereira[19]等的研究结果一致,前者发现萝卜硫苷在110 ℃以下较稳定,当温度高于110 ℃时会发生降解;后者发现萝卜硫苷在外源黑芥子酶的作用下,萝卜硫素是其唯一水解产物[21]。但80 ℃时萝卜硫素含量下降,可能与西兰花内部其他因素变化有关,具体原因有待继续探究。因此,后续实验均以70 ℃干燥的西兰花副产物粉为原料。
由图2b可知,随着酶液添加量的增加,萝卜硫素提取量呈缓慢上升趋势。当酶液添加量为20 mL时,萝卜硫素提取量最高,为(78.36±0.48)μg/g,但由于外源酶价格昂贵,选择15 mL为最适外源酶添加量,提取量为(76.91±0.77)μg/g,与前者无显著差异。另外,以磷酸缓冲液为对照水解西兰花粉,得到萝卜硫素提取量为(4.41±1.09)μg/g,说明实验中大部分黑芥子酶在70 ℃干燥时被灭活[20],萝卜硫素的生成依赖于外源黑芥子酶。
由图2c可知,pH 5.0为外源酶的最适pH值,低于或高于其值酶促反应速率下降,与黄肖钦等[21]结果一致。因此,后续实验均以pH 5.0磷酸缓冲液为进一步优化试验的零水平。
由图2d可知,随着酶解温度的升高,萝卜硫素提取量先增加后减少,于35 ℃时达到最高,说明35 ℃为芥菜籽黑芥子酶的最适反应温度,这与Mahn等[22]研究结果一致,此时的萝卜硫素提取量为(101.32±8.66)μg/g。随着温度继续升高,黑芥子酶活性逐渐下降并伴随萝卜硫素降解[23],使萝卜硫素提取量不断降低,当温度达65 ℃时,萝卜硫素提取量低于50%的最高提取量。因此,选择酶解温度35 ℃为进一步优化试验的零水平。
由图2e可知,随着酶解时间的延长,萝卜硫素提取量逐渐增加,并在酶解60 min时达到最大,因此,选择酶解时间60 min为进一步优化试验的零水平。萝卜硫素提取量在60~90 min内降低不明显,推测萝卜硫素因超声的旋涡作用而分解的量较少,或水解生成的萝卜硫素量与降解的量相等。
由图2f可知,随着超声时间的延长,萝卜硫素提取量逐渐增加。但考虑到溶剂提取只是简单的溶解过程,超声时间太长会大大降低提取效率,增加时间成本,且超声时间超过90 min后,萝卜硫素的提取量并无明显增加。因此,选择超声时间90 min为最优提取时间。
2.3 响应面试验结果
2.3.1 Box-Behnken试验
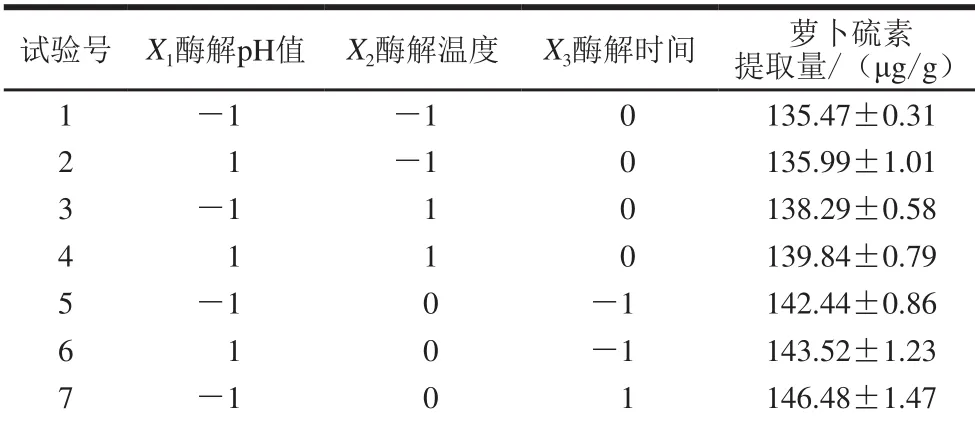
表 2 响应面试验设计及结果Table 2 Experimental design and results for response surface analysis

8 1 0 1 147.87±2.01 9 0-1 -1 141.21±0.73 10 0 1 -1 142.88±1.98 11 0 -1 1 146.92±1.08 12 0 1 1 147.34±0.22 13 0 0 0 156.63±0.36 14 0 0 0 156.87±1.38 15 0 0 0 155.59±1.22 16 0 0 0 154.44±0.53 17 0 0 0 153.74±2.22
Box-Behnken试验设计与结果如表2所示。对结果进行回归拟合分析,得到各因素与萝卜硫素提取量(Y)的二次多项式模型:Y=155.45+0.57X1+1.10X2+2.32X3+0.26X1X2+0.078X1X3-0.31X2X3-8.78X12-7.27X22-1.59X32。
2.3.2 二次回归模型方差分析
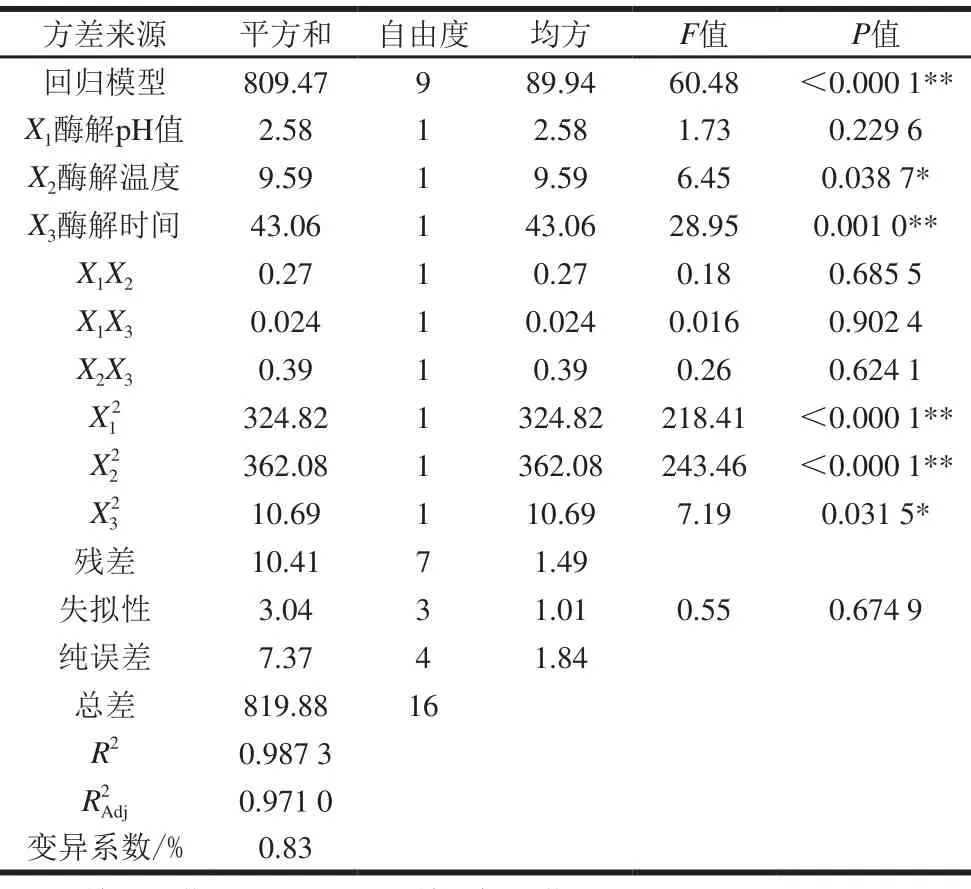
表 3 萝卜硫素提取量回归模型方差分析Table 3 Analysis of variance of regression model describing sulforaphane yield
二次回归分析模型方差分析如表3所示,回归模型P值小于0.000 1,说明回归模型具有高度的显著性,失拟项P值为0.674 9,失拟项不显著,决定系数R2为0.987 3和校正决定系数R2Adj为0.971 0说明回归模型预测值与实测值之间拟合性好,可解释97.10%响应值的变化,可用此模型分析酶解条件对萝卜硫素提取量的影响。
方差分析中一次项X1和各交互项X1X2、X1X3、X2X3对响应值的影响不显著,X2和二次项X32影响显著,X3和X12、X22的影响极显著,说明各因素对萝卜硫素提取量影响不是简单的线性关系。各因素对萝卜硫素提取量的影响次序依次为X3(酶解时间)>X2(酶解温度)>X1(酶解pH值)。
2.3.3 各因素交互作用对萝卜硫素提取量的影响

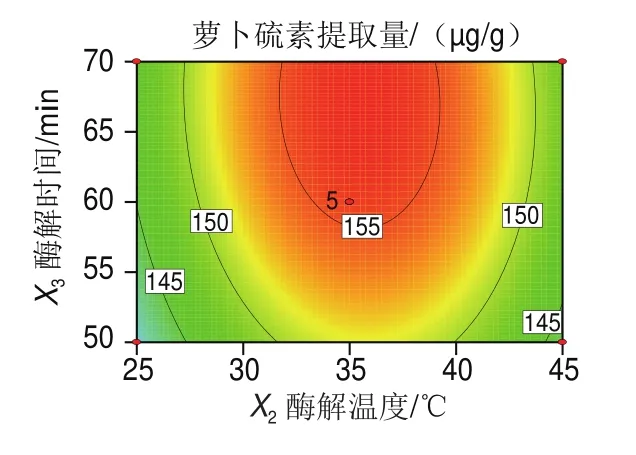
图 3 各因素交互作用响应面及等高线图Fig. 3 Response surface and contour plots showing the interactive effects of various factors on sulforaphane yield
如图3所示,在确定某一因素的条件下,改变另一因素条件对萝卜硫素提取量的影响,其变化与单因素结果基本一致;从等高线图可以看出,各交互作用的等高线图形接近圆形,说明各因素的交互作用对萝卜硫素的提取量影响不显著。
2.3.4 验证实验结果
通过回归方程得到萝卜硫素提取的最佳条件为:酶解pH 5.02、酶解温度35.47 ℃、酶解时间67.25 min,理论上可得萝卜硫素提取量156.33 μg/g。考虑到实际操作,将最优条件调整为酶解pH 5.0、酶解温度35 ℃、酶解时间67 min。经验证实验得萝卜硫素提取量为(151.39±2.36)μg/g,与预测值无显著差异,证实拟合的响应面模型具有良好的预测性,可以用来预测萝卜硫素提取量。
天麻粉亮儿,我起床轻手轻脚收拾了一下,准备出门了。大梁也爬起来,说要送我。我又到槐生跟前,摸着他的小脸儿,轻声叫着:“槐生,槐生——娘走了呵……你要听父的话,等我回哈……”说着说着就掉泪了。槐生“嗯嗯”应着,眼都睁不开,——他会以为是个梦吧?
2.4 半制备HPLC结果

图 4 萝卜硫素粗提取物(A)与萝卜硫素标准品(B)的半制备HPLC图谱Fig. 4 Preparative HPLC chromatograms of crude sulforaphane (A)and sulforaphane standard (B)
应用半制备HPLC对萝卜硫素进行分离纯化,对比萝卜硫素标准品,可知保留时间23~24 min为萝卜硫素出峰时间(图4),收集此时的洗脱液,得到萝卜硫素与流动相的混合物,蒸干溶剂后得萝卜硫素纯品。将萝卜硫素提取实验等比放大100 倍,经半制备HPLC富集、纯化后,理论收集萝卜硫素(30.28±0.47)mg,实际收集28.62 mg,回收率为94.52%,纯度为80.74%(图1)。纯度不高的原因可能是复溶时有杂质污染,或收集组分的时间较长使一些杂质也一并收集,可通过精确缩短收集时间来提高产物纯度。
2.5 UPLC-MS分析
采用UPLC-MS对纯化物进行结构鉴定,得到其二级质谱图与碎片离子信息(图5)。参考相关研究[16,24-26],对比萝卜硫素分子式C6H11NOS2和相对分子质量177.028,可知m/z 178.036为分子离子峰,表示为[M+H]+,其余m/z 119.053、114.038、71.991、55.055为碎片离子峰。由各碎片离子的质量推测萝卜硫素化学键断裂特点,绘制萝卜硫素碎片离子示意图(图6),结果与萝卜硫素二级质谱图相吻合,由此可进一步确定该纯化物为萝卜硫素。

图 5 萝卜硫素二级质谱图Fig. 5 Tandem mass spectrum of sulforaphane purified by preparative HPLC
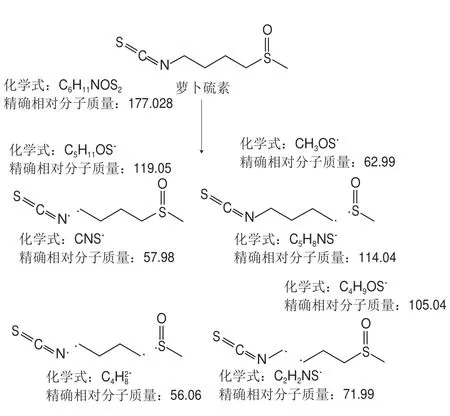
图 6 萝卜硫素碎片离子示意图Fig. 6 Sketch map showing ion fragmentation of sulforaphane
3 讨 论
植物中萝卜硫苷酶解生成萝卜硫素的过程受多方面条件的影响,因此从植物中提取天然萝卜硫素重点在于研究其酶解条件[8-10],还有少部分人直接提取萝卜硫苷[27-28]。本研究将西兰花副产物在70 ℃热风干燥后,同时灭活ESP蛋白与黑芥子酶,阻止了萝卜硫苷自身酶解造成的损失,保留了大部分萝卜硫苷,再次添加外源黑芥子酶时才水解生成萝卜硫素。此方法为后续研究天然萝卜硫素提供新思路,且西兰花副产物70 ℃干燥后易保存,可随提随用,有利于减少资源浪费和环境污染。
有研究表明萝卜硫苷酶解生成萝卜硫素的反应不是瞬时发生的,而要经过一个漫长的过程,因此大多数酶解反应的时间较长,室温下长达8~12 h[8-9]。本研究采用超声波辅助酶解代替室温下静置酶解,借助超声波的涡旋和空化作用,使萝卜硫苷与黑芥子酶的接触面积和频率增加,从而缩短酶解时间,提高提取效率,超声时间60 min即可达到室温下静置酶解10 h的萝卜硫素提取量(数据未显示)。
萝卜硫素提取后,研究者多采用柱层析、色谱分离或固相萃取等方法将其纯化,常用的有硅胶柱层析[29]、凝胶柱层析[11]、大孔吸附树脂[30]、反相高效制备液相色谱[26]和高速逆流色谱[31]等。但无论是柱层析还是色谱分离,在洗脱杂质的同时也带走了一部分目标物质,回收率低,且一般需经过多方法,反复多次操作才能获得纯度较高的产品。本研究利用半制备HPLC纯化和富集萝卜硫素,灵敏度高,分离效果好,虽纯度略低但回收率高,且纯度可通过优化色谱条件和精确萝卜硫素的收集时间来提高,相较回收率低更容易改进。另外,半制备HPLC用于制备其他天然产物时可一次实现多产物分离和收集,具有其他传统纯化方法所没有的优势,且操作方便、高效快速,用于工业生产还可选用工业型制备色谱,在生物、医药和食品等领域具有广阔的应用前景。
4 结 论
本研究以西兰花副产物为原料,利用外源酶和超声波辅助酶解提取萝卜硫素,并通过单因素和响应面试验优化酶解浸提工艺,得到萝卜硫素提取的最佳条件为酶解pH 5.0、酶解温度35 ℃、酶解时间67 min。经验证实验得萝卜硫素提取量为151.39 μg/g,与预测值无显著差异。在最佳条件的基础上,进行放大实验并应用半制备HPLC对其进行纯化与富集,得到28.62 mg/200 g(干质量)萝卜硫素,回收率为94.52%,纯度为80.74%。对纯化物进行UPLC-MS鉴定,其二级质谱图和碎片离子信息与萝卜硫素相吻合,进一步确定该提取物为萝卜硫素。本研究从西兰花副产物中提取萝卜硫素,有利于增加西兰花附加值,提高西兰花利用率,减少资源浪费,创造经济效益;同时,研究提供一种原料来源广、操作简便、设备简单的萝卜硫素提取方法,为西兰花副产物的综合利用提供理论和实验依据。

