含4 种食源性病毒检测靶标多联装甲RNA的制备、纯化与定值
姚 琳,张 奇,李风铃,张 媛,逄凤娇,江艳华,*,王联珠,翟毓秀
(1.中国水产科学研究院黄海水产研究所,农业部水产品质量安全检测与评价重点实验室,山东 青岛 266071;2.獐子岛集团股份有限公司,辽宁 大连 116001)
诺如病毒(norovirus,NoV)、甲肝病毒(hepatitis A virus,HAV)、轮状病毒(rotavirus,RV)、星状病毒(astrovirus,AstV)等食源性病毒引发的公共卫生与食品安全问题已成为影响全球人类健康的主要问题[1-2]。2006—2007年,日本、英国爆发NoV疫情,造成共约500万 人感染;1988年我国上海爆发HAV疫情,造成约30万 人感染;RV是婴幼儿腹泻的主要病原,世界范围内每年估计约有5%的儿童死于RV感染[3];目前AstV在一些国家的调查中发现已相当普遍,阳性检出率在2%~8%之间[4-5]。食源性病毒可通过受污染的水、贝类、果蔬等引起疾病的爆发和流行[6-7]。实时荧光定量逆转录-聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)是检测食品中食源性病毒的最主要方法。由于食品基质复杂、干扰因素多且病毒含量较低,通常需要在检测过程中添加阳性质控样品,以确保检测结果的准确性和可靠性。对于上述RNA病毒,近年来有研究者采用体外转录的裸露RNA片段作为实时荧光定量RT-PCR质控样品[8-10],但存在不能监控病毒粒子裂解、RNA提取等关键环节且易降解等缺点。
针对上述问题,Dubois等[11]建立了装甲RNA技术,即通过分子生物学手段将目标RNA片段包裹在MS2噬菌体病毒样颗粒(virus like particles,VLPs)内部,使之能抵抗环境和样本中核酸酶的降解,同时其整体结构又很好地模拟了病毒衣壳蛋白-核酸天然存在的特征,具有稳定、无生物安全隐患、可有效评价病毒裂解与提取效率等检测全过程的优点,该技术已成功应用于肠道病毒[12]、人体免疫缺陷病毒[13]等病毒的阳性质控样品的制备。然而,目前鲜见可同时适于多种病毒检测阳性质控样品的研究报道。
本研究在前期构建基于Qβ噬菌体的装甲RNA制备平台的基础上[14],针对食源性病毒的主要检测标准,研究并纯化了同时包含NoV、HAV、RV、AstV 4 种食源性病毒检测靶标的多联装甲RNA,并对其进行初步定值,为研发用于食源性病毒核酸检测的多联阳性质控样品提供新思路。
1 材料与方法
1.1 材料与试剂
大肠杆菌BL21(DE3)和Top10感受态细胞 天根生化科技(北京)有限公司;pET-28a(+)载体为本实验室保存;pGEM-T-Easy载体、T7 RiboMAXTMExpress Large Scale RNA Production System 美国Promega公司;同源重组克隆试剂盒ClonExpress®II One Step Cloning Kit 南京诺唯赞生物科技有限公司;限制性内切酶、Premix Ex TaqTM、One Step PrimeScriptTMRT-PCR Kit 宝生物工程(大连)有限公司;丙烯酰胺葡聚糖凝胶(SephacryI S-200 HR) 北京天恩泽生物技术有限公司;Trizol试剂 Invitrigen公司;异丙基硫代半乳糖苷(isopropylβ-D-thiogalactoside,IPTG)、卡纳霉素、氯化铯(均为分析纯) 北京索莱宝科技有限公司。
1.2 仪器与设备
LightCycler 2.0实时荧光PCR仪 瑞士Roche公司;NanoPhotometer Pearl微量核酸蛋白测定仪 德国Implen公司;JEM-1200透射电镜 日本电子公司;Infinity 3006凝胶成像系统 法国Vilber Lourmat公司;Lambda750紫外-可见近红外分光光度计 美国PerkinElmer公司;BS-100A自动部分收集器 上海青浦沪西仪器厂。
1.3 方法
1.3.1 引物与探针
引物与探针由北京六合华大基因科技有限公司(以下简称华大基因)合成,相关信息见表1。
1.3.2 目的片段QβMulV和MulV的合成
根据ISO/T 15216-2 2012、GB/T 22287—2008《贝类中甲型肝炎病毒检测方法 普通RT-PCR方法和实时荧光RT-PCR方法》、SN/T 2520—2010《贝类中A群轮状病毒检测方法 普通PCR和实时荧光PCR方法》、SN/T 2519—2010《贝类中星状病毒检测方法 普通PCR和实时荧光PCR方法》等国际标准、国家标准、行业标准分别规定的NoV(GI型和GII型)、HAV、RV、AstV检测靶标,由华大基因合成同时含有上述4 种病毒检测靶标RNA对应cDNA的串联序列,命名为MulV。
参考GenBank数据库中的Qβ噬菌体基因组序列(AB971354),由华大基因合成包含Qβ噬菌体成熟酶编码基因、衣壳蛋白编码基因、包装位点序列、MulV的核酸片段,命名为QβMulV。
1.3.3 重组质粒构建与鉴定
将核酸片段MulV亚克隆至pGEM-T-Easy载体中,构建体外转录用重组质粒,酶切鉴定后送至华大基因测序。
参考同源重组克隆试剂盒的说明书,将核酸片段QβMulV亚克隆到pET-28a(+)载体中,构建原核表达用重组质粒,酶切鉴定后送至华大基因测序。
1.3.4 病毒样颗粒的诱导表达
将原核表达用重组质粒转入E. coli BL21(DE3)感受态细胞,涂布于含卡那霉素的LB固体培养基上,37 ℃过夜培养后挑取单菌落,接种到5 mL LB液体培养基中37 ℃、180 r/min振荡培养过夜,取2 mL菌液接种于200 mL LB液体培养基中,37 ℃、180 r/min振荡培养至OD600nm约为0.6,加入终浓度为0.8 mmol/L IPTG诱导表达12 h,离心收集菌液,进行十二烷基硫酸钠-聚丙稀酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析。
1.3.5 病毒样颗粒的纯化
将1.3.4节收集的菌液采用超声波破碎,4 ℃、11 000 r/min离心20 min收集上清后分别加入终浓度为8 U/mL的DNase I和12 µg/mL的RNase A消化,用0.45 µm滤膜过滤后进行氯化铯密度梯度离心,4 ℃、80 000 r/min离心5 h,小心吸取含VLPs的目标层液体,通过SephacryI S-200 HR层析柱进一步纯化,用自动样品收集器每10 min收集一管样品。将各收集管样品测定在260 nm和280 nm波长处的吸光度,并进行SDS-PAGE分析。获得同时含有4 种食源性病毒检测靶标的多联装甲RNA,命名为AR-MulV。
1.3.6 电镜观察
将AR-MulV用2%磷钨酸负染,在JEM-1200型透射电子显微镜下观察VLPs形态。
1.3.7 AR-MulV中残留质粒的检测
以纯化后的AR-MulV为模板,用实时荧光定量PCR法检测其中是否含有残留重组质粒;同时设置pETQβMulV为阳性对照,无酶ddH2O为空白对照;每个样品设置3 个平行。检测用引物与探针参见表1,反应体系见表2,循环参数:95 ℃预变性10 s;95 ℃变性5 s,60 ℃退火延伸20 s,40 个循环。
1.3.8 AR-MulV的初步定值1.3.8.1 cRNA制备
用限制性内切酶线性化体外转录用重组质粒,用T7 RiboMAXTMExpress Large Scale RNA Production System试剂盒进行体外转录;体系如下:RioMAXTMExpress T7 2 µL,Buffer 10 µL,Linear DNA Template 8 µL,Enzyme Mix T7 Express 2 µL;37 ℃温育30 min后,加入1 µL的RQ1 RNase-Free DNase,37 ℃温育15 min,除去DNA模板。用Trizol法提取cRNA。
1.3.8.2 标准曲线构建
使用微量核酸蛋白测定仪测定cRNA的浓度。计算拷贝数按照:拷贝数/(copies/µL)=(6.02×1023拷贝/mol×RNA含量/(ng/µL)×10-9)/(片段长度/bp×340),将cRNA进行10 倍梯度稀释,用对应的引物与探针分别对4 种食源性病毒检测靶标进行实时荧光定量RT-PCR分析,每个样品设置3 个平行,体系见表3。循环参数为42 ℃反转录5 min,95 ℃变性10 s;95 ℃变性5 s,60 ℃退火延伸20 s,40 个循环。根据所测得的Ct值与cRNA各梯度稀释拷贝数的对数绘制标准曲线。
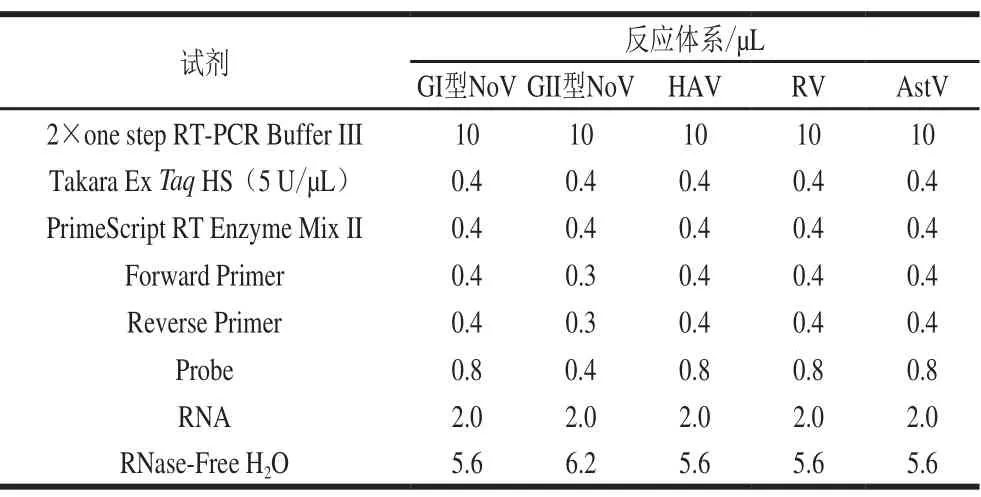
表 3 4 种食源性病毒的实时荧光定量RT-PCR体系Table 3 Real-time RT-PCR system for detection of four foodborne viruses
1.3.8.3 初步定值与不确定度分析
将纯化后的AR-MulV用无酶磷酸缓冲盐溶液(phosphate buffer saline,PBS)(pH 7.2)适度稀释,分装到1.5 mL无酶离心管中,参考JJF 1006—1994《一级标准物质技术规范》的要求,随机选取15 管AR-MulV,采用1.3.8.2节中的实时荧光定量RT-PCR方法分别测定各食源性病毒的Ct值,根据标准曲线,得到15 管AR-MulV中4 种食源性病毒5 个检测靶标拷贝数,参考JJF 1006—1994中格布拉斯准则剔除可疑数据后,计算平均值,得到AR-MulV中各食源性病毒检测靶标初步定值结果。不确定度分析参考JJF 1059—1999《测量不确定度表示指南》,采用A类不确定度评定方法,按照以下公式进行计算:

式中:tα(m-1)为显著性水平α、自由度为m-1的t值;为单次测量的平均值;为测量的总平均值;m为测量次数。
2 结果与分析
2.1 重组质粒的构建

图 1 pGEM-MulV的酶切鉴定电泳图Fig. 1 Enzyme digestion of pGEM-MulV
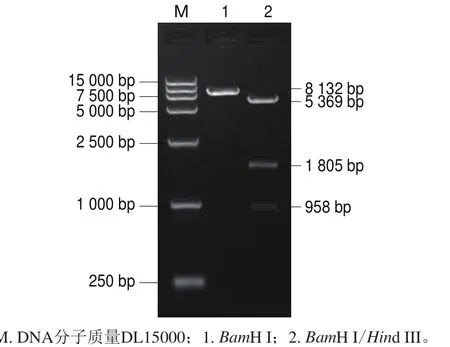
图 2 pET-QβMulV的酶切鉴定电泳图Fig. 2 Enzyme digestion of pET-QβMulV
分别用限制性内切酶Spe I单酶切和Spel I/Sph I双酶切鉴定体外转录用重组质粒,大小与预期一致,电泳结果如图1所示,测序结果正确,证实重组质粒构建成功,命名为pGEM-MulV。分别用限制性内切酶BamH I单酶切和BamH I/Hind III双酶切鉴定原核表达用重组质粒,大小与预期一致,电泳结果如图2所示,测序结果正确,证实重组质粒构建成功,命名为pET-QβMulV。
2.2 pET-QβMulV在大肠杆菌中的诱导表达
pET-QβMulV转化入大肠杆菌BL21(DE3)后,经IPTG诱导表达,用SDS-PAGE检测,在约14.1 kDa处出现一条明显的重组蛋白表达条带(图3),大小与预期一致,表明Qβ噬菌体衣壳蛋白成功表达。
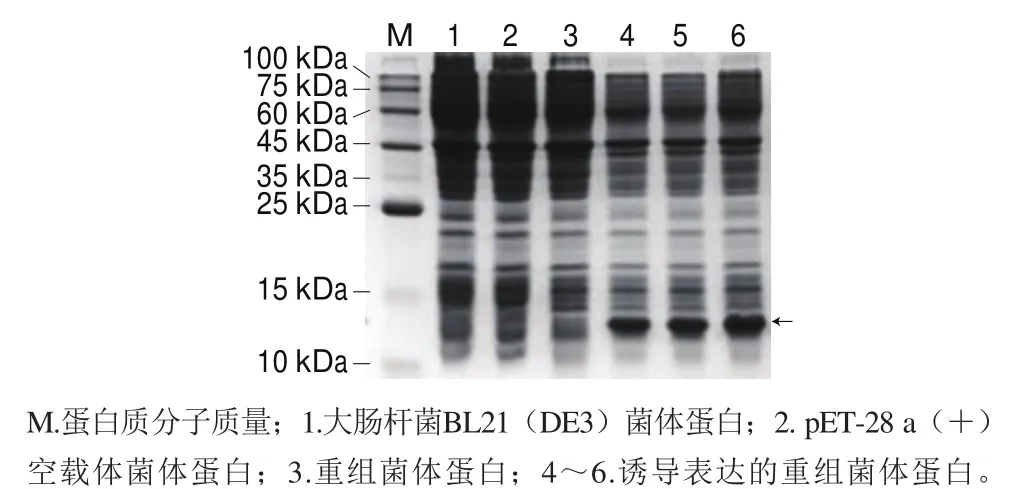
图 3 表达产物的SDS-PAGE分析Fig. 3 SDS-PAGE analysis of expression product
2.3 样品的纯化

图 4 丙烯葡聚糖凝胶层析纯化不同收集管样品吸光度分析结果Fig. 4 Absorbance of different fraction after purification by Sephacryl S-200 HR gel exclusion chromatography

图 5 吸收峰附近样品SDS-PAGE结果Fig. 5 SDS-PAGE analysis of samples around absorbent peak
如图4所示,第21管在260 nm和280 nm波长处均有最大吸光度,说明该管中核酸(即靶标RNA)与蛋白(即VLPs)含量均最高,即该管中AR-MulV含量最高。第19~24管样品的SDS-PAGE分析结果见图5,可见第21、22管样品在14.1 kDa处均有条带且浓度高无杂带,说明纯化效果好。本研究选取第21管样品用无酶PBS(pH 7.2)适度稀释后进行后续实验。
2.4 电镜观察结果
在电镜下观察纯化后的AR-MulV,可见大量结构完整、大小均一的病毒样颗粒,直径约25 nm,与预期大小一致,结果如图6所示。
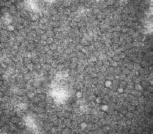
图 6 AR-MulV电镜照片Fig. 6 Electron microscopy image of AR-MulV
2.5 AR-MulV中残留质粒的检测结果

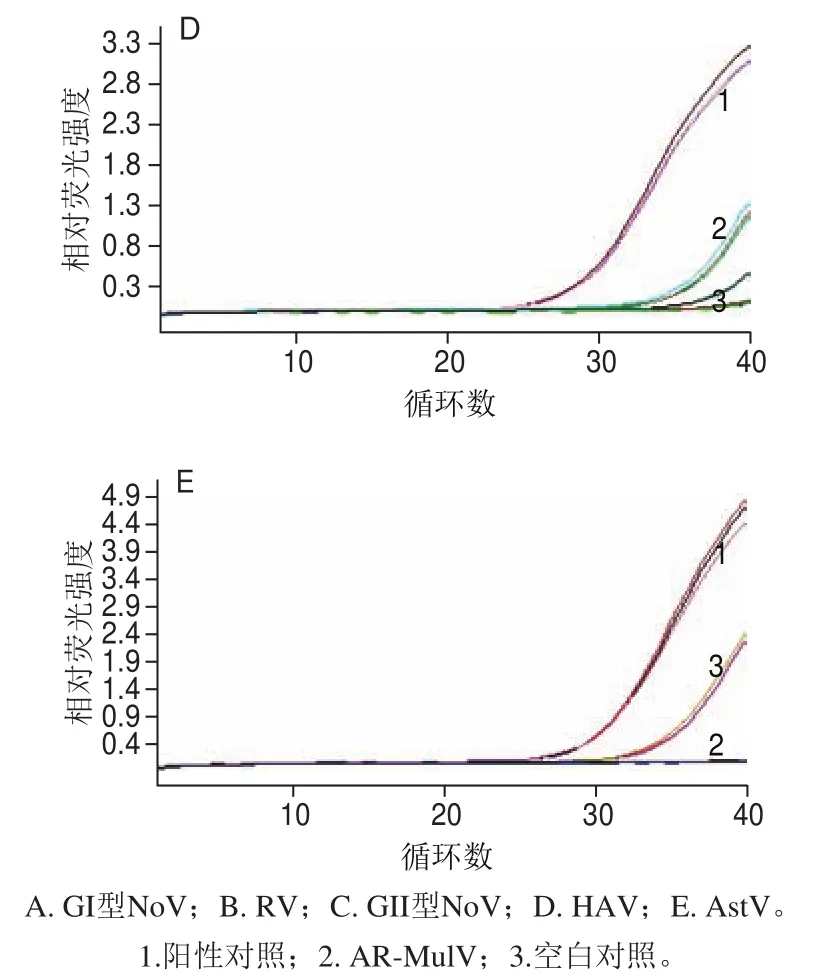
图 7 AR-MulV残留质粒实时荧光定量PCR检测结果Fig. 7 Real-time PCR for residual plasmid DNA detection in the AR-MulV
如图7所示,以AR-MulV为模板,分别用4 种食源性病毒的5 个检测靶标对应的引物和探针进行检测的实验组和空白对照组,在阴性判定Ct值内均未出现特异性扩增;以pET-QβMulV为阳性对照的实验组每对引物与探针均出现明显的特异性扩增,且Ct值均在阳性判定值内,说明纯化的AR-MulV中无重组质粒残留,纯度良好。
2.6 AR-MulV初步定值
2.6.1 cRNA标准曲线的构建
以10 倍稀释梯度的cRNA为模板,利用4 种食源性病毒的引物与探针,分别进行实时荧光定量RT-PCR检测。以cRNA各稀释梯度的对数为横坐标,以Ct值为纵坐标建立实时荧光定量RT-PCR的标准曲线,其线性方程见表4。

表 4 4 种食源性病毒的cRNA标准曲线Table 4 Calibration curves for cRNA of four foodborne virus
2.6.2 AR-MulV的初步定值与不确定度分析
用对应的实时荧光定量RT-PCR方法检测15 管AR-MulV,计算获得AR-MulV中该食源性病毒靶标核酸拷贝数,同时计算A类不确定度。定值结果见表5,AR-MulV中GI型NoV、GII型NoV、HAV、RV和AstV检测靶标RNA的含量分别为(1.24±0.2)×107、(2.54±0.6)×107、(2.24±0.3)×107、(2.96±0.5)×107copies/µL和(3.19±0.4)×107copies/µL。

表 5 AR-MulV中4 种食源性病毒靶标RNA初步定值结果Table 5 Quantification of AR-MulV for 4 foodborne viruses
3 讨 论
目前食源性病毒检测标准中的阳性质控样品主要有致弱的活病毒或cDNA/质粒DNA两大类,前者需要进行病毒培养,存在一定生物安全隐患,并且需使用与目标病毒不同的引物、探针,操作繁琐;后者无法监控病毒裂解、核酸提取、反转录等多个关键环节。此外,也有将体外转录cRNA作为阳性质控样品[8-10,15],虽然可以评价反转录的过程,但存在易降解的短板。利用装甲RNA技术制备的阳性质控样品在最大程度上模拟病毒粒子,可在检测过程中添加到实际样本或空白样本中,对目标病毒的裂解、RNA提取、检测等关键环节进行全程评价,无生物安全隐患,稳定性高。对于某些高变异性的RNA病毒,在确定检测靶序列的前提下,可在28 d内构建、制备、纯化出新的装甲RNA[16],在自身有合成基因、测序条件的实验室,不考虑定值,只制备定性阳性质控样品,周期可缩短至20 d;有研究表明,装甲RNA的稳定性很好,在-20 ℃条件下至少可保存120~200 d[14,25]、-80 ℃条件下至少可保存300 d[14],这种较短的制备周期与优良的稳定性也是装甲RNA的重要优势[16]。装甲RNA技术完全可弥补致弱的活病毒、cDNA/质粒DNA和cRNA作为阳性质控样品的不足[17-18],因此该技术已成为RNA病毒核酸检测阳性质控样品研发的重要发展方向[18-21],尤其对于烈性传染性病毒、新发病毒和无法进行体外培养病毒而言有着无可替代的优势,现已成功制备人体免疫缺陷病毒[13]、猴免疫缺陷病毒[22]、冠状病毒[23]、口蹄疫病毒[24]、寨卡病毒[16]、肠道病毒[12]等重要病原的装甲RNA。
本研究在纯化了AR-MulV后,为明确其所含各食源性病毒检测靶标RNA的拷贝数,使之今后能更好地用于定量评价检测方法、仪器设备灵敏度等领域,探索性地对其进行初步定值研究。目前对于装甲RNA的定值主要有3 种方式:1)使用线性化质粒DNA为模板构建标准曲线[22];2)使用体外转录cRNA为模板构建标准曲线[25];3)以制备的装甲RNA提取的RNA为模板构建标准曲线[26-27]。有研究结果表明,体外转录的cRNA为标准品更接近样本RNA的真实拷贝数[28],所以本研究以体外转录的cRNA为模板构建标准曲线对制备的AR-MulV进行初步定值。结果表明,即使经过稀释,AR-MulV所含的4 种食源性病毒的检测靶标RNA均可达到107copies/µL。在技术成熟的实验室,理论上讲,100 mL的诱导菌液可制备10 L以上的107copies/µL高拷贝数的样品,产量大。后期对其进行联合定值,明确其稳定性、均匀性等重要特性后,将有望申报有证标准参考样品。
NoV、HAV、RV、AstV这4 种食源性病毒已成为质检、疾控、出入境等机构的重要检测项目,本研究基于目前通行的国际标准、国家标准、行业标准中涉及的食源性病毒检测靶标,制备多联装甲RNA,与分别制备的方法相比,节省时间与研究精力。此外,为满足食品安全与公共卫生安全等领域的需要,多重实时荧光定量RT-PCR成为快速筛查食源性病毒的重要手段,目前国内外学者已成功建立了NoV、HAV、RV和AstV[1],GI型和GII型NoV[29],NoV、RV、HAV和柯萨奇病毒[30],GI型、GII型NoV和HAV[31]等多重实时荧光定量RT-PCR检测方法,能够快速、特异、灵敏地同时检测多种食源性病毒。在应用上述多重检测方法时,如果对涉及到的每种食源性病毒均设置单一的阳性质控样品,则需同时对多种相应的质控样品分别添加、提取、扩增等,操作繁琐,难以满足应对突发性食品安全与公共卫生事件对检测时效性的要求。针对上述需求,可基于本研究开发的多联装甲RNA研发平台,根据多重实时荧光定量RT-PCR方法对应的扩增靶标序列,快速制备多联装甲RNA,满足多种病毒的快速高通量检测对阳性质控样品的需求。多重实时荧光定量RT-PCR检测方法与多联装甲RNA联合使用,可缩短样品检测时间,提高检测结果的可靠性。
综上所述,本研究基于Qβ噬菌体装甲RNA技术,成功研制出同时包含NoV、HAV、RV和AstV 4 种食源性病毒检测靶标的多联装甲RNA,无残留DNA,RNA拷贝数高,后期经稳定性、均匀性评价后,可作为多种病毒分子检测的阳性质控样品供质检、科研人员选择使用,为食源性病毒标准化检测提供安全的标准参考样品提供参考依据,也为多重实时荧光定量RT-PCR配套使用的多联阳性质控样品的制备提供了新思路。

