七氟醚对阿尔茨海默症小鼠模型学习记忆的影响研究
黄柯冰,赵 飞,陶维初,李凤仙
阿尔茨海默病(AD)的早期症状为短期记忆丧失,随着病情的恶化,语言、方向感、情绪、行动等能力丧失,生活无法自理,行动障碍[1],最终导致死亡。患者确诊后的平均预期寿命为3~9年[2],严重危害人体健康。AD的病理学特点为大脑皮层和特定的皮层区域中神经元和突触功能丧失,组织萎缩,如颞叶、顶叶、额叶皮层和扣带回等脑区的退化[3]。七氟醚是一种吸入性的全身麻醉剂,具有带甜味、不易燃、挥发性和起效快等特点[4]。电生理学研究显示,七氟醚可作为γ-氨基丁酸受体的正向变构调节剂调节神经元功能[5],也可作为天门冬氨酸(NMDA)受体拮抗剂增强甘氨酸受体电流,并抑制乙酰胆碱和5-羟色胺受体电流[6]。虽然七氟醚具有神经调节作用,但其对AD小鼠学习记忆的影响及机制尚未阐明。因此,本课题主要研究七氟醚对AD小鼠学习记忆的影响,并试图探讨其作用机制。
1 材料与方法
1.1 动物及分组 30只雄性C57BL/6小鼠[西安交通大学医学院实验动物中心,SCXK(陕)2017-003],体重(25±2)g。分笼饲养,每笼5只。动物房维持温度(22±2)℃,湿度(54±2)%,12 h 光照与黑暗交替,自由饮食饮水。将小鼠随机分为3组:对照组、模型组和七氟醚组,各10只。
1.2 AD小鼠模型的建立 参照石成男等[7]的方法建立AD小鼠模型:对模型组和七氟醚组腹腔注射 120 mg/(kg·d)D-半乳糖和 90 mg/(kg·d) 亚硝酸盐,连续6 w;对照组给予同剂量的生理盐水。
1.3 麻醉方法 七氟醚组在建模6 w后,采用自制麻醉箱(40 cm×15 cm×15 cm)进行七氟醚吸入麻醉。麻醉箱有2个侧孔,一侧接麻醉机,另一侧接气体监测仪。调节挥发罐使箱内七氟醚的浓度维持在3%,氧气流量为 2 L/min,维持温度为(37±1)℃,持续4 h。然后取出小鼠,在恢复正常反射后,放入原先的鼠笼中。对照组和模型组在相同条件下,在麻醉箱中吸入流量为2 L/min的氧气。
1.4 Morris水迷宫实验 各组分别于麻醉结束后1、2、3、4、5 和 6 d,进行水迷宫实验,分为前 6 d 的定位航行实验和第7 d的空间探索实验。水迷宫为一个直径180 cm、深60 cm的圆形黑金属槽,槽内注水,水深 40 cm,温度(24±2)℃。 将摄像机安装在槽上的天花板上,并与装有分析管理系统的电脑相连。水迷宫被划分为4个象限,在一个固定象限放置平台,平台没于水下2 cm。定位航行实验共训练4次,分别于4个入水点将小鼠面壁放入水中,记录小鼠寻找并爬上平台的时间,作为逃避潜伏期。如果小鼠在120 s还未达到平台,则由实验者将小鼠引至平台,时间记为120 s,取4次训练的均值。第6 d的定位航行实验结束后移除平台,于第7 d进行空间探索实验。将小鼠于移除平台象限的斜对角象限的中点背向池壁放入水中,记录小鼠在120 s内于平台象限中的滞留时间及穿越平台位置的次数。平台象限滞留时间比(%)=平台象限滞留时间(s)/120(s)×100%。
1.5 实时定量PCR 水迷宫实验结束后,小鼠断头处死,迅速分离脑组织,于冰块上取海马、前额叶皮层、杏仁核和小脑,储存于-80℃备用。用TriZol试剂(美国Invitrogen公司)提取各脑区中的RNA,取1 μg RNA用TaqManTM反转录试剂盒合成cDNA(美国 Invitrogen公司),采用 SYBR GreenⅠ(美国Invitrogen公司)进行实时定量PCR扩增,GAPDH为内参。引物由Primer Designing Tool在线软件设计(表1)。采用实时定量PCR检测GluR1、PSD95、GRP78、elF-2和PERK mRNA的表达水平。
2 结果
2.1 各组逃避潜伏期比较 模型组的逃避潜伏期从训练第1 d开始长于对照组;训练第4 d前,七氟醚组的逃避潜伏期与模型组比较均无显著差异(P>0.05),而从训练第4 d开始长于模型组(P<0.05,图1)。提示七氟醚可加剧AD小鼠的学习记忆损伤。
2.2 各组空间探索能力比较 与对照组相比,模型组平台象限滞留时间和平台象限滞留时间百分比降低,穿越平台的次数均增加(P<0.05);与模型组对比,七氟醚组的平台象限滞留时间和平台象限滞留时间比降低,穿越平台的次数均增加(P<0.05)。提示七氟醚可加重AD小鼠的空间探索能力障碍。见表2。

表1 引物序列
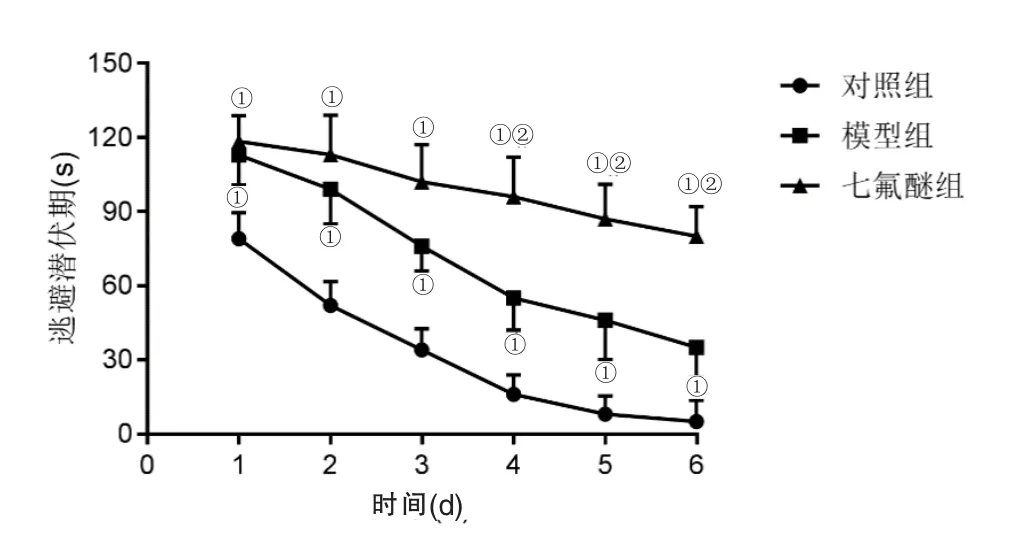
图1 比较各组逃避潜伏期(n=10)
2.3 各组各脑区GluR1和PSD95 mRNA的表达水平比较 除各组杏仁核PSD95的表达无显著差异外,模型组GluR1和PSD95在各脑区中表达均低于对照组,而七氟醚组均低于模型组(P<0.05),提示七氟醚可促进AD小鼠大脑神经元突触功能障碍。见图2。
2.4 各组各脑区GRP78、elF-2和PERK mRNA表达水平比较 模型组各脑区中GRP78、eIF-2和PERK的表达均高于对照组,而七氟醚组均高于模型组 (P<0.05),但七氟醚组杏仁核中eIF-2的表达、前额叶皮层和小脑中PERK的表达与模型组比较无显著差异(P>0.05),提示七氟醚可促进AD小鼠各脑区中内质网应激。见图3。
3 讨论
七氟醚是一种广泛用于儿科麻醉的吸入麻醉药,具有安全、起效快、恢复时间短等优势。但七氟醚可诱导婴儿神经元凋亡,并抑制新神经元的产生[8]。研究表明,早期接触七氟醚可能会呈剂量依赖式损害成年期的空间记忆,且4%的七氟醚引起的空间记忆损伤将可维持4 w[9]。七氟醚可诱导正常小鼠和孕鼠的神经元凋亡,促进淀粉样蛋白的聚集,进而参与AD的病理过程[10]。但也有相反的研究表明,接受七氟醚麻醉的年轻鼠和老年鼠的学习记忆功能均没有损伤[11]。
逃避潜伏期反映受试动物的学习能力,潜伏期越短,其学习能力越强。空间探索能力反映的是受试动物的空间记忆的保持能力,受试动物在原平台象限滞留时间越长,其记忆能力越强。本研究将AD小鼠暴露于3%的七氟醚中4 h后,采用水迷宫实验检测小鼠的学习记忆能力及空间探索能力,发现七氟醚可进一步延长AD小鼠的逃避潜伏期,降低小鼠在平台上的滞留时间。表明七氟醚可延长小鼠爬上平台花费的时间,减少小鼠在平台象限的滞留时间,即便在训练几天后这种情况依然没有改变,表示七氟醚加剧AD小鼠的学习记忆能力损伤。
突触蛋白的表达与突触可塑性、突触结构的改变以及突触传递有关。GluR1不仅是谷氨酸受体,还是阳离子通道,是许多突触后膜上突触可塑性和突触传递的不可缺少的分子[12]。突触后膜GluR1上调的潜在生理学机制与兴奋性突触后电位(EPSP)的增加有关,可导致EPSP持久增加,诱导长时程增强(LTP),增加学习记忆功能[12]。本研究表明,七氟醚可降低AD小鼠各脑区中GluR1的表达,可能是其损伤AD小鼠学习记忆功能的作用机制之一。PSD95是一个突触后标记物,其下调可打乱突触结构[13]。本研究发现,七氟醚降低AD小鼠海马、前额叶皮层及小脑中PSD95的表达,提示七氟醚可能会破坏突触结构及突触传递,损伤学习记忆功能。

表2 各组空间探索能力比较(n=10)
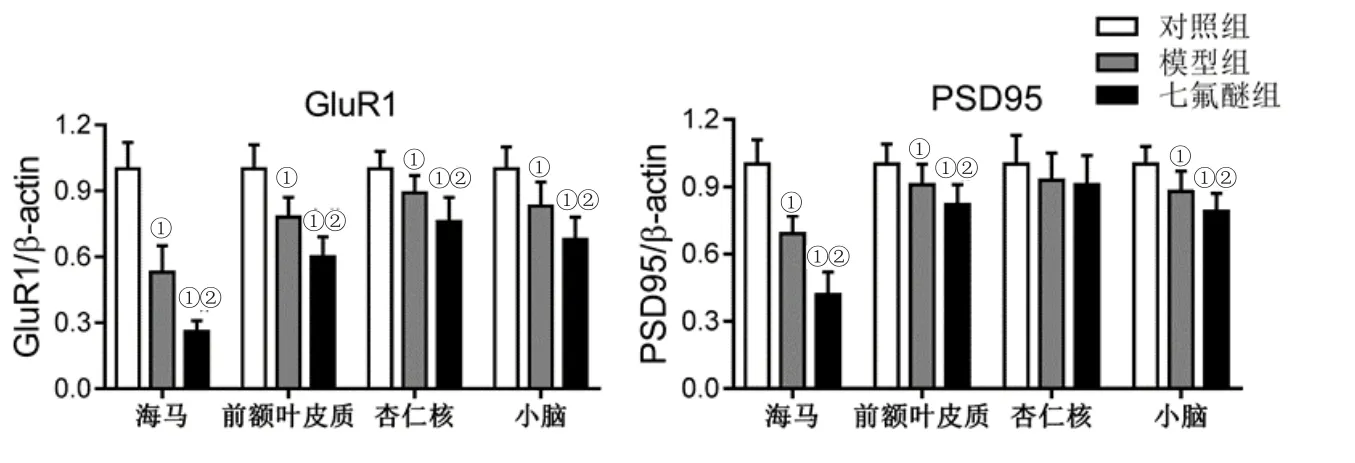
图2 各组各脑区GluR1和PSD95 mRNA的表达水平比较

图3 各组各脑区GRP78、elF-2和PERK mRNA表达水平比较
GRP78为内质网应激的关键生物标记分子,当错误折叠的蛋白质积累时,GRP78释放,使跨膜信号蛋白聚集,并引发内质网应激[15]。PERK为一个跨膜转运信号分子,eIF-2为PERK通路上的关键分子[16]。内质网应激可降低大鼠BDNF和突触素的表达[17],提示内质网应激对突触功能的负向调控。研究表明,七氟醚可通过调控肌醇-1,4,5-三磷酸肌醇受体和鱼尼丁受体将Ca2+从内质网释放至胞质,可影响神经元钙稳态[14]。然而,七氟醚是否可诱导AD小鼠神经元内质网应激还未可知。本研究显示,七氟醚可增加AD小鼠各脑区中GRP78、eIF-2和PERK的表达,表明内质网应激可能在七氟醚损伤AD小鼠学习记忆中起关键作用。由此可以推断,七氟醚可诱导小鼠各脑区中的内质网应激,导致突触功能障碍,进一步损伤AD小鼠的学习记忆功能。
总之,七氟醚可降低AD小鼠的学习记忆功能,其机制可能与影响小鼠各脑区突触功能,使内质网应激增加有关。
——疾病防治的新靶标

