基于斑马鱼胚胎模型的抗肿瘤药物毒性评价方法
程祖春,赵海山,冯启荣,孙婷伟,谭文
(1.广东工业大学轻工化工学院,广东 广州 510006; 2.广东工业大学生物医药研究院,广东 广州 510006)
抗肿瘤药物(anti-tumor drug)在杀伤肿瘤细胞的同时也对机体正常细胞造成损害,因此导致显著的毒副作用。毒副作用主要表现为:心脏、肝脏、肾脏毒性,骨髓抑制及胃肠道黏膜受损等,其中心脏毒性是最主要的因素,是限制其广泛使用的主要原因[1]。药物从设计合成到临床使用的整个研究阶段,毒副作用是药物研发失败的主要因素。即便是上市后仍有许多药物因为明显的心血管毒性被撤出市场或严格限制使用。
目前已有多类抗肿瘤药物被证明具有显著的心脏毒性。比如,以阿霉素(Doxorubicin,Dox)为代表的蒽环类抗肿瘤药物,在临床应用上发现其会引起严重的心脏毒性,这种心脏毒性与药物累计用量相关,常导致化疗疗程被迫中断,严重时会导致严重心力衰竭并死亡[2-5]。此外,多种多靶点酪氨酸激酶抑制剂(TKIs)类药物也存在严重的心脏毒性,如苏尼替尼(Sunitinib,Sun)与索拉非尼(Sorafenib,Sor),它们通过抑制PDGFR及VEGFR等酪氨酸激酶受体,抑制肿瘤血管新生而起到抗肿瘤作用。但同时也导致严重的心血管毒性,包括高血压、心衰、心律失常、急性冠状动脉综合征和心肌梗死等[6-11]。
因此,对抗肿瘤药物的心血管毒性进行快速、准确的高通量筛选与安全性评价,是减少临床心血管毒副作用的重要手段,同时为临床用药提供理论基础。目前,药物安全性评价模型主要有体内和体外2大类型。一类是以细胞为代表的体外模型,虽可进行高通量筛选,但不能模拟动物的整体生理过程;第二是以小鼠为代表体内模型,可从整体评价药物的毒性作用,但受到周期、费用、法律等诸多因素限制。因此,寻找一种快速、高效、直观可进行活体监测的药物毒性评价模型成为迫切需求。
斑马鱼(zebrafish)作为整体动物模型,它具有产卵多、体外受精发育、胚胎透明等优点[12],便于活体观测心血管系统的表型改变。已经成为继小鼠之后药物毒性评价的重要模式生物,尤其在心血管研究领域,有非常成熟和广泛的应用[13]。Liu等[14]使用Dox诱导的斑马鱼胚胎心脏毒性模型,从3 000个化合物中筛选出2个(VIS和DPU)具有明显改善Dox心脏毒性的化合物。Sarathd等[15]使用MPTP在斑马鱼胚上诱导帕金森疾病模型,用于筛选具有潜在治疗帕金森疾病的化合物。Cao等[16]在斑马鱼胚胎上评估福美锌(ziram)对胚胎发育的影响,通过评价存活率、心率、胚胎形态、行为、分子等方面进行评价。Jin等[17]使用Tg[flk:EGFP]品系斑马鱼建立肿瘤异种移植模型来评价抗肿瘤药贝伐单抗、恩度和阿帕替尼的功效、安全性和肿瘤抑制作用。
因此,本研究选用Tg[myl7:EGFP]和Tg[flk:EGFP]转基因系斑马鱼作为研究对象,建立了抗肿瘤药物心脏毒性的评价体系,评价了Dox、Sun、Sor 3种抗肿瘤药物对斑马鱼胚胎的急性毒性、心脏毒性、心血管发育等影响,一方面为未来的进一步新药开发提供资料及线索,也为其他类型抗肿瘤药物毒性评价提供了可靠的模型。
1 仪器与材料
Stemi 508型体视显微镜(德国Carl Zeiss公司);Axio Imager.2型荧光正置显微镜(德国Carl Zeiss公司);Axio Observer A1型荧光倒置显微镜(德国Carl Zeiss公司);DHP-9012型恒温培养箱(上海一恒科学仪器有限公司)。
Doxorubicin HCl原料药(Selleck chem,批号:S120813,质量分数99.82%);Sorafenib(Selleck chem,批号:S739707,质量分数99.89%);Sunitinib malate原料药(Selleck chem,批号:S104207,质量分数99.63%)。
Holt buffer 配制如下:量取1 900 mL ddH2O,置于2 L烧杯中,使用搅拌器搅拌,依次加入:7.000 g NaCl,0.400 g NaHCO3,0.100 g KCl和0.235 g CaCl2,ddH2O定容至2 000 mL,并使用一次性真空过滤器(孔径0.22 μmol/L)过滤,常温储存备用。
实验所用鱼品种为Tg[myl7:EGFP]或Tg[flk:EGFP]成年鱼龄为6个月~12个月,鱼系均购于国家斑马鱼资源中心。
2 方法
2.1 溶液的制备
Dox用ddH2O溶解,制备成1 mmol/L的储备液,分装于1.5 mL EP管中,避光置于-20 ℃冰箱。
Sor、Sun用DMSO溶解,分别制备成0.5、1.0、1.5、2.0、2.5、3.0 mmol/L储备液,并分装于1.5 mL EP管中,避光置于-20 ℃冰箱。
2.2 斑马鱼胚胎的获取
在实验前1天下午喂食1 h后,选取健康的成年鱼系,雌雄各半,置配种缸中,每缸1对,并用隔板将雌雄隔开。次日上午9:00,打开隔板,自由交配后1 h后收集胚胎,挑选发育正常受精卵于培养皿中,加入适量Holt buffer培养液,每皿不超过100枚胚胎,置于28 ℃恒温培养箱中培养。
2.3 斑马鱼胚胎的急性毒性
取24hpf(受精后小时)的AB系野生型斑马鱼胚胎,分成若干组,置于96孔板中,每孔1枚,每组20孔。用Holt buffer培养液按体积比稀释成不同浓度的Dox溶液,使终浓度分别为0、20、40、50、60、70、80 μmol/L。
同时,Holt buffer培养液按体积比稀释成不同浓度的Sor、Sun溶液,使终浓度分别为0、5、10、15、20、25、30 μmol/L。并设置1%DMSO溶剂对照组,每孔加入100 μL,24 h后再加入100 μL药液。将96孔板置于28 ℃恒温配养箱中培养,每天于倒置显微镜下观察并记录胚胎的存活状况,以胚胎心脏停止跳动或者卵凝结为死亡判定标准。最后,统计药物处理24、48、72 h的胚胎存活率,并作存活率曲线,计算LC50值。实验重复4次。
2.4 斑马鱼胚胎心脏功能的评价
为评价抗肿瘤药物对胚胎的整体毒性,选择胚胎药物暴露处理48 h(即72hpf)。取24hpf(受精后)的Tg[myl7:EGFP]转基因鱼系胚胎60枚,分成18组,每组15枚,置于24孔板中。用Holt buffer培养液分别将Dox、Sor、Sun稀释至5、10、15 μmol/L。药物处理48 h后,即72hpf时,用Holt buffer胚胎培养液洗清洗3次,以去除药液。在凹面载玻片上滴加1滴3%的甲基纤维素固定溶液,以固定胚胎。然后将胚胎置于固定液上,于体式显微镜下并调整好胚胎的位置,将两眼保持重合,身体保持平直。在10×正置荧光显微镜下,选用EGFP通道找到心脏位置,计数15 s心跳次数,最后×4计算每分钟心率。
同时,使用录像功能对胚胎心脏位置进行录像,保存视频。视频使用Adobe Premiere视频软件逐帧播放,找到同一周期内心脏舒张和收缩时的那一帧,导出图片。然后用Photoshop测量工具对舒张和收缩末期心室内径进行测量,计算收缩分数(fractional shortening,FS);并测量静脉窦到动脉球之间的距离,以计算静脉窦-动脉球(SV-BA)的间距。实验每次选取10只进行数据统计,实验重复3次。
2.5 斑马鱼胚胎血管发育的评价
为评价抗肿瘤药物对胚胎血管发育的影响,选择胚胎药物暴露处理48 h(即72hpf)。取24hpf(受精后小时)的Tg[flk:EGFP]转基因鱼系胚胎60枚,分成4组,每组15枚,置于24孔板中。用Holt buffer培养液分别将Dox、Sor、Sun稀释至5 μmol/L。药物处理48 h后,即72hpf时,用Holt buffer胚胎培养液洗清洗3次,以去处药液。在凹面载玻片上滴加一滴3%的甲基纤维素固定溶液,以固定胚胎。然后将胚胎置于固定液上,于体式显微镜下并调整好胚胎的位置,将两眼保持重合,身体保持平直。最后,将玻片置于5×正置荧光显微镜下,选用EGFP通道对胚胎进行拍照,每组选取5~8只。
2.6 统计学方法
3 结果
3.1 胚胎急性毒性
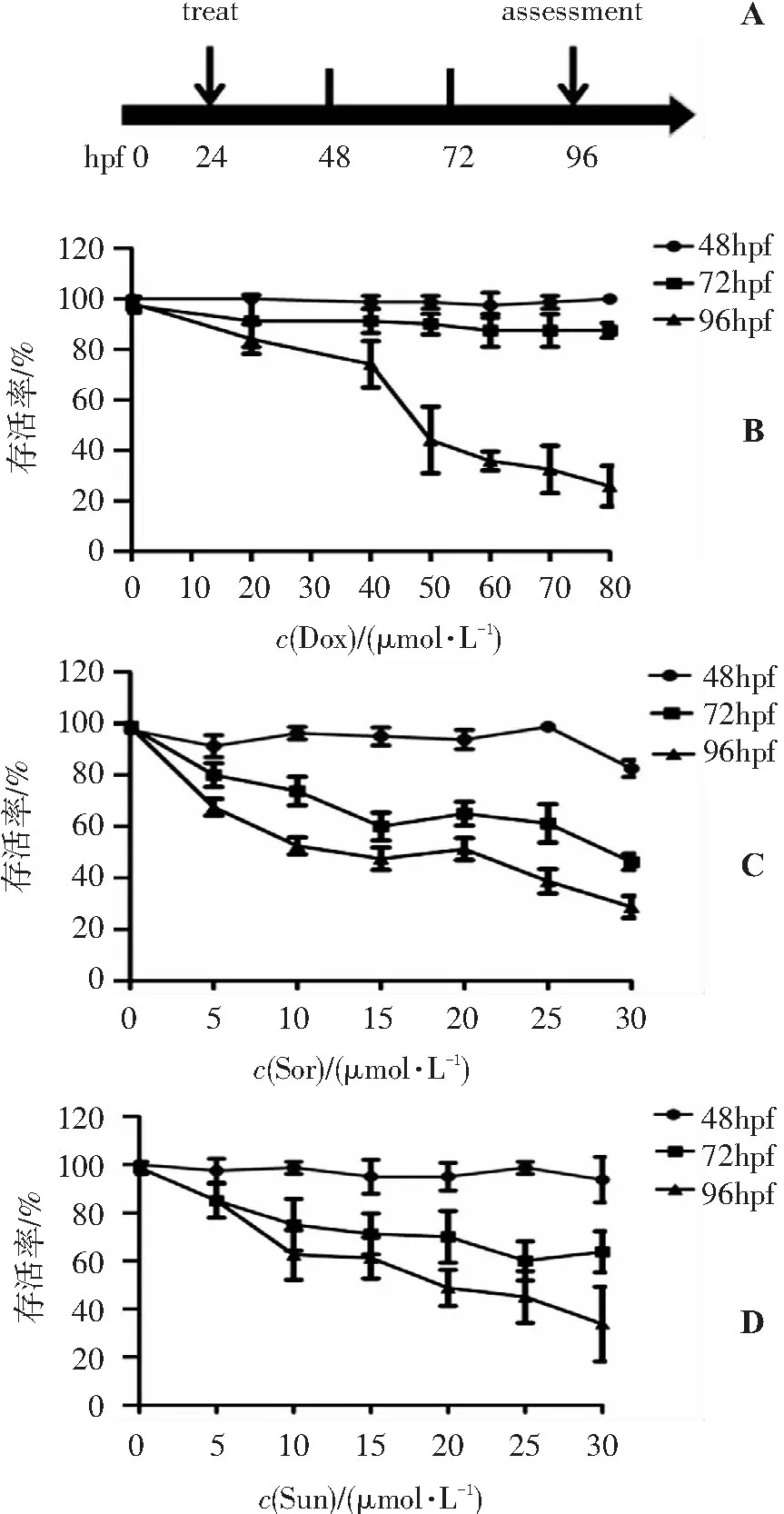
结果表明,DMSO溶剂组对胚胎存活率无明显影响。胚胎经不同浓度的Dox、Sor、Sun处理24 h后(即48hpf),其存活数量与对照组比较无明显改变;处理48 h后(即72hpf)后,Dox组存活率与对照组比较无明显改变,而Sor与Sun处理组存活率开始明显下降;处理72 h后(即96hpf),各组胚胎均有明显的死亡,胚胎存活率随着Dox、Sor、Sun浓度的增加而显著降低,呈现出明显的浓度依赖性(图1B-D)。3种抗肿瘤药物Dox、Sor、Sun对96hpf胚胎的LC50值分别为51.56、12.98、19.10 μmol/L(表1)。由此,比较出3种抗肿瘤药对斑马鱼胚胎毒性的顺序为:Sor>Sun>Dox。
3.2 斑马鱼胚胎的整体毒性
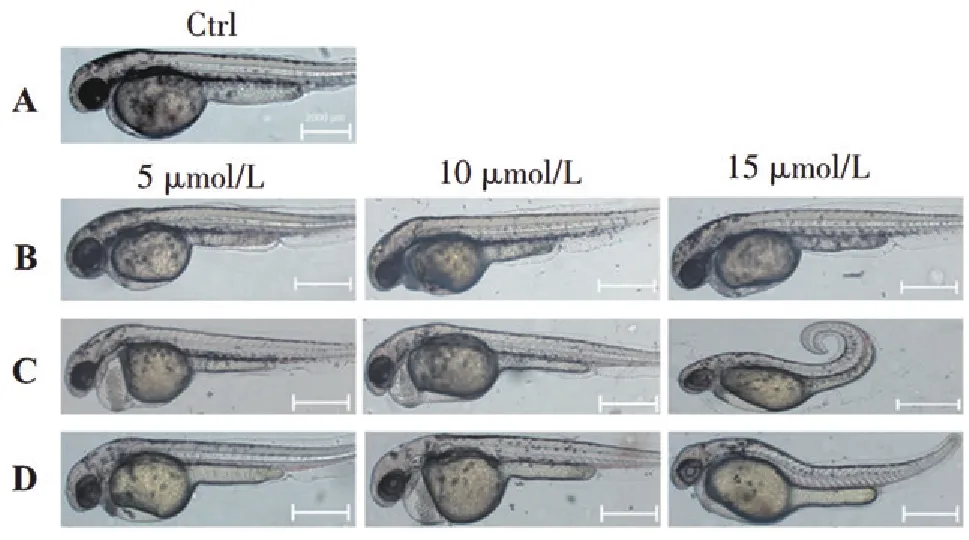
对照组胚胎发育正常,脱膜孵化为幼鱼,心脏呈S形,侧面观察心室和心房部分重叠,心血管系统无形态学改变(图2A)。5 μmol/L Dox处理组胚胎发育基本正常,体节间血流循环正常,卵黄略有缩小,无可见心血管系统形态学改变;10 μmol/L Dox处理组胚胎出现轻微心包膜水肿,血流缓慢、心脏轻微畸形;15 μmol/L Dox处理组胚胎血流缓慢或者无背部血流,卵黄囊出血、并有明显凹陷,房室瓣受损、血液返流,心脏功能受阻(图2B)。
A.胚胎处理方法; B.Dox组; C.Sor组; D.Sun组。
图13种抗肿瘤药物对48hpf、72hpf、96hpf胚胎存活率的影响
Figure1Effect of three anti-tumor drugs on the survival rate of 48hpf,72hpf and 96hpf embryos
表196hpf斑马鱼胚胎急性毒性LC50值
Table1Acute toxicity LC50value of 96hpf zebrafish embryo

组别LC50/(μmol·L-1)95%置信区间/(μmol·L-1)Dox51.5642.49~62.58Sor12.989.72~17.35Sun19.1015.88~23.05
5 μmol/L Sor处理组胚胎出现明显的心包水肿,卵黄囊变小,心脏畸形且线性化、心室变小、体节间血流缓慢或无血液循环等多种形态改变;随着浓度的增加,胚胎整体毒性越显著,10 μmol/L Sor处理组胚胎呈现显著心包水肿,卵黄囊明显凹陷,心脏严重畸形且线性化、心房与心室变小、血流缓慢或无血液循环等多种形态改变;15 μmol/L Sor时,胚胎心包囊肿,卵黄囊凹陷变小,体长缩短、体节发育异常、脊柱弯曲,短尾卷曲,心脏畸形,体节间血管无血液循环,胚胎生长发育受到严重影响(图2C)。
5 μmol/L Sun处理组出现轻微心包水肿,体节间血流缓慢,卵黄囊出血并有明显凹陷;随着浓度的增加,胚胎整体毒性越显著,10 μmol/L Sun时出现明显的心包水肿,心脏畸形且线性化、心室变小、体节间无血液循环等;当浓度为15 μmol/L Sun时,胚胎整体出现多种形态学的改变,卵黄囊水肿、出血,心脏线性化,房室瓣缺损、无血流循环,体长缩短、体节发育异常、脊柱弯曲等(图2D)。
A. Control组; B. Dox组; C. Sor组; D. Sun组。
图2不同浓度的Dox、Sor、Sun对72hpf胚胎整体发育的影响
Figure2Effect of different concentrations of Dox,Sor and Sun on the overall development of 72hpf embryos
3.3 斑马鱼胚胎的心脏毒性
为评价抗肿瘤药物对斑马鱼胚胎心功能的影响,本部分实验心脏特异性表达绿色荧光蛋白的Tg[myl7:EGFP]转基因斑马鱼系,对胚胎整体毒性及心脏毒性进行直观可靠的评价。
斑马鱼胚胎分别经不同浓度的Dox、Sor、Sun处理48 h,到达实验终点时,用Holt buffer洗去药液,并于正置荧光显微镜下计数胚胎心跳次数。显微镜选取EGFP通道,对胚胎进行拍照和心脏位置录像。并用Photoshop测量心室舒张和收缩末期短轴内径,以计算FS。
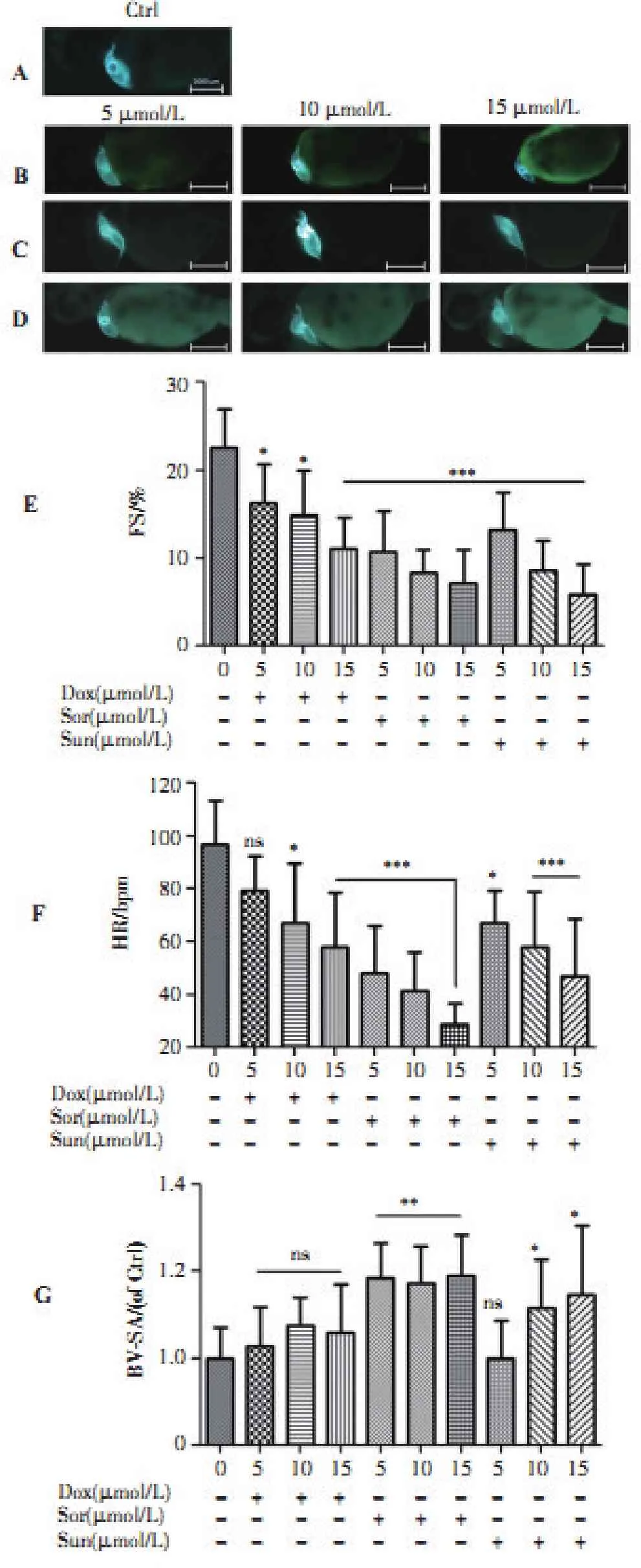
胚胎在暴露于3种不同浓度抗肿瘤药物48 h后,心脏结构线性化,心室缩短分数(FS)、心率和体长显著降低(图3B-G)。对照组心脏结构物明显改变(图3A)。对照组72hpf胚胎心房、心室跳动规则,心室收缩分数为(22.53±3.14)%、心率平均为(96.6±13.8)次/分。随着Dox、Sor、Sun浓度的升高,胚胎收缩功能和心率显著降低,呈现明显剂量效应关系。
Dox各浓度处理组FS分别为:(16.31±3.26)%、(14.89±3.49)%、(11.03±2.72)%;Sor各浓度处理组FS分别为:(10.72±3.48)%、(8.33±2.19)%、(7.15±3.38)%;Sun各浓度处理组FS分别为:(13.17±3.02)%、(8.54±2.36)%、(5.86±2.74)%(图3E、F)。与对照组相比,差异具有高度统计学意义。
Dox各浓度处理组心率分别为:(79.2±10.8)、(67.2±18.96)、(58.2±16.56)次/分;Sor各浓度处理组心率心率分别为:(48±15.6)、(41.4±12.72)、(28.8±6.24)次/分;Sun各浓度处理组心率分别为:(67.2±9.6)、(58.2±17.17)、(46.8±15.6)次/分(图3E、F)。与对照组相比,差异具有高度统计学意义。
Dox个浓度处理组对SV-BA间距无显著影响;Sor各处理组SV-BA显著增加(P<0.001);而Sun 5 μmol/L处理组队SV-BA无影响,当浓度为10 μmol/L 和15 μmol/L 时,SV-BA间距变长(P<0.05)。
综上,3种抗肿瘤药物对胚胎毒性的强弱顺序为:Sor>Sun>Dox。
3.4 斑马鱼胚胎的血管发育的影响
为评价抗肿瘤药物对斑马鱼胚胎血管发育的影响,采用血管特异性表达绿色荧光蛋白的Tg[flk:EGFP]转基因斑马鱼系。斑马鱼胚胎分别经5 μmol/L Dox、Sor、Sun处理48 h,到达实验终点时,用Holt buffer洗去药液,于正置荧光显微镜下对胚胎拍照。
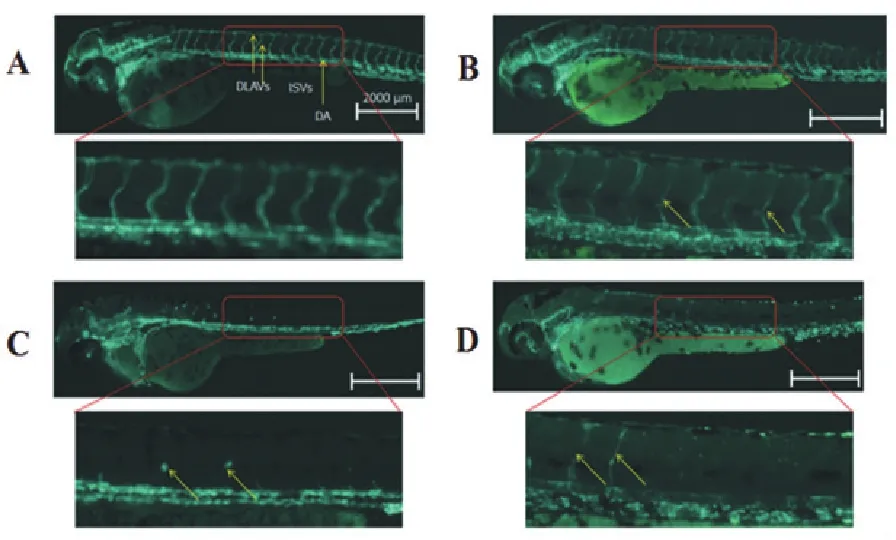
结果如图4所示。对照组胚胎血管发育正常,可观察到发育正常的血管结构。体节间血管(intersgmental blood vessels,ISVs)从背部主动脉侧(dorsal aorta,DA)或后主静脉(postrrior cardinal vein,PCVs)延伸到纵向背侧吻合血管(dorsal longitudinal anastomotic vessels,DLAVS)(图4A)。5 μmol/L Dox处理组对血管发育有轻微的损伤,表现为体节间血管变细,内皮细胞受损(图4B箭头)。Sor处理组对血管发育有明显的抑制,表现为ISV和DLAV完全被抑制,背部主动脉血管受损便薄,体节间未可见血管生成。同时,胚胎头部血管明显减少(图4C)。Sun处理同样表现出明显的抑制作用,体节间只有少数血管生成,未见DLAV生成。同时,胚胎头部血管明显减少(图4D)。
A. Control组; B. Dox组; C. Sor组; D. Sun组; E. FS; F.心率; G.SV-BA间距。与Control组比较:*P<0.05,**P<0.01,***P<0.001。
图3不同浓度的Dox、Sor、Sun对72hpf胚胎心脏功能的影响
Figure3Effect of different concentrations of Dox,Sor and Sun on the contractile function of 72hpf embryos
A. Control 组; B. 5 μmol/L Dox组; C. 5 μmol/L Sor组; D. 5 μmol/L Sun组。
图4Dox、Sor、Sun对胚胎血管发育的影响
Figure4Effect of Dox,Sor and Sun on embryonic vascular development
4 讨论
心血管毒性是抗肿瘤药物最常见的不良反应,也是限制抗肿瘤药物广泛使用的主要因素。然而,长期以来缺乏快速、高效、直观的整体动物毒性评价模型。因此,寻找一种兼具体内和体外模型优点,又可快速进行高通量筛选药物心血管毒性的模型成为毒理学研究的热点之一。
斑马鱼作为整体动物模型,具有体外受精发育、产卵量高、周期短、操作简便的优点,可实现对药物毒性的高通量筛选评价[18]。而其胚胎期全身透明,因此在显微镜下可直接观察心血管系统的形态变化,以评价药物对各个组织器官的毒性。同时,斑马鱼有非常多荧光标记的转基因鱼系,可对组织器官进行荧光标记,有利于显微镜成像,更加直观便捷地对胚胎的组织器官发育进行评价[19-20]。
本研究选择了蒽环类抗肿瘤药物中的代表Dox,以及TKIs类的Sun及Sor进行研究。其中,Dox的抗肿瘤机制表现:第一,Dox干扰转录过程,通过插入到DNA碱基链中,抑制RNA的生成,而阻断DNA的复制,属于细胞周期非特异性药物[21];第二,Dox同时也抑制DNA拓扑异构酶Ⅱ(TOP2),触发肿瘤细胞凋亡,在快速增值和高表达TOP2的细胞中最有效[22]。但是,Dox也同样造成心肌细胞DNA损伤,增加氧化压力,诱导炎症,导致心肌细胞凋亡,严重可造成心衰及死亡,最终限制了其在临床上的广泛使用[23-24]。
以Sun及Sor为代表的TKIs类抗肿瘤药物,通过抑制血管内皮生长因子受体(VEGFR)和血小板衍生生长因子受体(PDGFR)参与肿瘤细胞的增殖和血管生成,从而起到对肿瘤细胞的杀伤作用[25-28]。Sun可引起左心室射血分数降低和充血性心力衰竭(congestive heart failure,CFH),两种情况的发生率分别为11%和8%。Sor可引起缺血性心脏病,其中包括心肌梗死(发生率约3%)[29]。Sun和Sor均可导致心房血栓和高血压的发生风险增高[30]。
本研究结果表明:在急性毒性方面,3种抗肿瘤药物均明显降低了胚胎的存活率。Dox、Sor、Sun对96hpf胚胎的LC50值分别为51.56、12.98、19.10 μmol/L。在心血管毒性方面:抗肿瘤药物处理的胚胎出现严重的心包水肿、心脏畸形且线性化、心室变小、卵黄囊明显凹陷,体长缩短、体节发育异常、脊柱弯曲、短尾卷曲、体节间血流缓慢或无血液循环等多种形态改变。随着浓度的身高,胚胎心率、心脏FS显著降低,心脏功能严重受损,同时SV-BA间距变长。
在血管发育方面:对照组胚胎血管发育正常,可观察到发育正常的血管结构。Dox处理组未对血管发育产生明显影响,这与Dox抗肿瘤作用机制吻合;而Sor和Sun均明显抑制血管生成,与其通过抑制VEGF/VEGFR通路参与肿瘤细胞的增殖和血管生成的机制吻合。
综上所述,可见Sor及Sun的LC50显著低于Dox。而在相同剂量浓度下,Sor及Sun对心脏功能及结构的影响均大于Dox,而Sor的毒性较Sun更为明显。这些结果表明了Sor及Sun的心脏毒性较Dox更强。由于目前临床上对Sor及Sun的毒副作用的关注主要集中在消化系统的不良反应上,本研究结果提示,在临床上可能需要更进一步重视这类药物潜在的心血管疾病风险。

