延边泡菜益生性乳酸菌的筛选 及其部分生物学特性分析
舒慧萍,张冬星,张海月,单晓枫*,钱爱东*
(1.吉林农业大学 动物科学技术学院,动物生产及产品质量安全教育部重点实验室, 长春 130118;2.敦化市畜牧业管理局,吉林 敦化 133700)
目前,常用食品益生菌中以乳酸菌最为常见,乳酸菌在自身代谢生长过程中分泌的有机酸和细菌素能够抑制食品中病原菌的生长繁殖[1],防止食品腐败,延长保质期[2],因而可将乳酸菌应用于新型天然食品防腐剂的研发,以代替化学防腐剂。同时,乳酸菌在发酵过程中能够降低pH值,进而改善蔬菜制品的风味,可作为风味和口感增强剂[3,4],从而减少香精、香料的使用,使产品更趋于天然、绿色[5]。
而发酵泡菜作为一种由乳酸发酵的蔬菜制品,具有悠久的历史,并已被世界公认为一种健康的发酵食品。参与发酵的乳酸菌在发酵过程中起主导作用,对人体具有改善肠道不适,增强结肠功能与稳定性,降低血液胆固醇以及抗癌等保健作用[6],且能够提高蔬菜制品的营养价值,基于乳酸菌的上述生物学特性,使其在食品行业中被广泛应用。因而本实验旨在从发酵泡菜中分离获得具有抑菌特性及抗逆性的乳酸菌优势菌株,为日后实际应用该乳酸菌提供了理论基础,以期运用到食品中提高食品品质。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherichiacoli)CVCC233、CVCC236、CVCCK88;沙门氏菌(Salmonella)CVCC3383、CVCC3780、CVCC3775、CVCC503、CVCC79102;金黄色葡萄球菌(Staphylococcusaureus)CVCC-519:以上均由本实验室保存。
乳酸菌琼脂培养基(MRS琼脂)、Luria-Bertani琼脂培养基(LB琼脂):均购自青岛高科园海博生物技术有限公司;革兰氏染色试剂盒、生理生化管:购自北京索莱宝科技有限公司;细菌DNA提取试剂盒及PCR扩增试剂盒等:均购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 样品收集与保存
样品为购自延边朝鲜族的自家发酵泡菜,低温运至实验室,于-80 ℃下甘油保存。
1.2.2 乳酸菌的分离纯化
称取1 g发酵泡菜与10 mL的PBS充分混合均匀,对混合液进行连续十倍倍比稀释,将不同梯度稀释液涂布至MRS固体培养基表面,37 ℃下厌氧静置培养72 h[7],观察不同细菌形态,挑取边缘整齐,颜色为乳白色的圆形实心单菌落于MRS肉汤中,37 ℃厌氧静置培养48 h,在MRS固体平板上对其进行划线纯化。
1.2.3 生理生化实验
首先将纯化的菌株进行革兰氏染色及过氧化氢酶实验,选取革兰氏染色阳性、过氧化氢酶阴性菌进行硝酸盐还原实验、明胶液化实验、吲哚(靛基质)实验、硫化氢实验和糖发酵实验,实验结果对照《伯杰细菌鉴定手册》(第八版)[8]、《乳酸细菌的分类鉴定与实验方法》及《常见细菌系统鉴定手册》进行菌种的综合判定。
1.2.4 乳酸菌分子鉴定
提取分离株DNA,采用16S rDNA通用引物进行聚合酶链式反应(polymerase chain reaction,PCR),PCR反应体系参照文献[9],并通过1%琼脂糖凝胶电泳检测16S rDNA 扩增片段。由吉林长春库美有限公司对PCR 产物进行测序。将所得16S rDNA序列结果与GenBank数据库中已知的相关序列进行相似性分析,并通过Blast 程序多重比对,采用Mega 6.0 软件构建系统进化树[10]。
1.2.5 抑菌实验1.2.5.1 牛津杯法
本实验采用牛津杯法。在董雨馨等人的操作方法上进行改进,具体操作方法如下:将已活化的指示菌株大肠杆菌(Escherichiacoli)CVCC233、CVCC236、CVCCK88;沙门氏菌(Salmonella)CVCC3383、CVCC3780、CVCC3775、CVCC503、CVCC79102和金黄色葡萄球菌(Staphylococcusaureus)CVCC-519的浓度调整至106cfu/mL,涂布于LB平板,采用牛津杯法进行打孔,向牛津杯中加入分离株培养上清,于37 ℃下培养12 h,以加入等量MRS液体作为对照,量取并记录抑菌圈直径[11]。
抑菌活性判定标准为:12.00 mm≥抑菌圈直径>8.00 mm表示弱抑菌性,16 mm≥抑菌圈直径>12 mm表示中度抑菌性,20 mm>抑菌圈直径>16 mm表示较强抑菌性,抑菌圈直径 ≥20 mm表示强抑菌性[12]。
1.2.5.2 共培养法
通过共培养法,进一步研究乳酸菌的胞外上清液对病原菌的抑制作用。将已活化的浓度为106cfu/mL的指示菌按1%接种至LB液体培养基中,同时按5%接入分离株滤过上清液,于37 ℃震荡培养12 h,以接入等量PBS缓冲溶液作为对照,采用平板计数法记录指示菌的活菌数量,并计算指示菌的存活率。存活率按下式计算:
存活率=log(实验组菌液浓度)/log(对照组菌液浓度)×100%。
1.2.6 抗逆性实验
本实验研究了分离株对酸、胆盐的耐受性,在Mattika等人的操作方法上进行改进,具体操作方法如下:将活化好的分离株菌液浓度调整至106cfu/mL,按10%接入pH 2.0的 MRS肉汤中,以接入等量pH 6.8的PBS作为对照,37 ℃下厌氧静置培养2 h;另按10%接入含0.3%胆盐的MRS-bile肉汤培养基中,以接入等量PBS作为对照,37 ℃下厌氧静置培养4 h,采用平板计数法分别记录活菌数量,并计算存活率[13],存活率按下式计算:
存活率=log(实验组菌液浓度)/log(对照组菌液浓度)×100%。
2 结果与分析
2.1 菌落及菌体形态观察
实验获得3株生长迅速的疑似乳酸菌菌株,分别命名为L1、L2和L3,其菌落形态见图1,可见形态为边缘整齐、中央有突起或扁平的乳白色圆形菌落,大小不一。
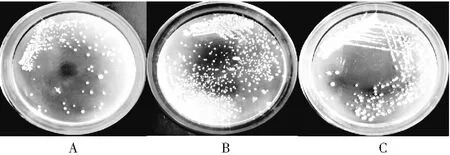
图1 分离株菌落形态观察Fig.1 Observation on colony morphology of isolated strains
注: A为菌株L1;B为菌株L2;C为菌株L3。
分离株革兰氏染色结果见图2。分离株为G+菌,呈短杆状,单个或呈短链状排列。
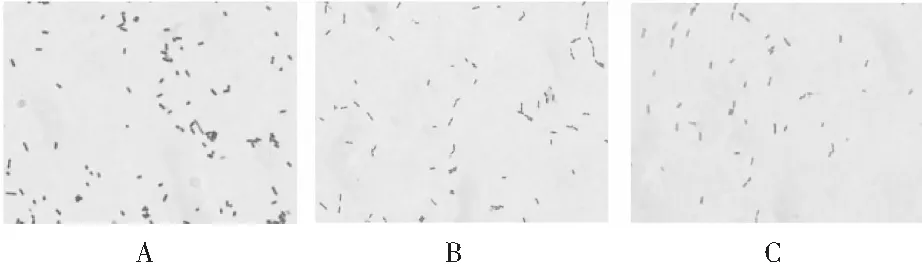
图2 分离株革兰染色结果Fig.2 Gram staining results of isolated strains
注:A为菌株L1;B为菌株L2;C为菌株L3。
2.2 理化实验结果
生理生化鉴定结果显示:过氧化氢实验中3株分离株均无气泡产生,表明呈过氧化氢阴性;滴加硝酸盐还原试剂甲、乙液后,不变色;加入微量锌粉后,L1、L2、L3均呈红色,表明硝酸还原阴性;明胶液化实验结果:4 ℃呈固态,即明胶液化阴性;滴加靛基质试剂后反应呈黄色,表明吲哚阴性;与硫化氢反应后呈无色,表明硫化氢阴性;综上,L1、L2、L3均不能发生过氧化氢实验、硝酸还原实验、明胶液化实验,均不能产生吲哚及硫化氢,由此可初步判定3株菌为乳酸杆菌属。进一步进行糖发酵实验,结果见表1。

表1 分离株生理生化测定结果Table 1 Physiological and biochemical determination results of isolated strains
注:“+”表示菌株反应呈阳性;“-”表示菌株反应呈阴性。
2.3 乳酸菌分子鉴定

图3 分离株16S rDNA序列扩增检测Fig.3 Detection of 16S rDNA sequence of isolated strains by amplification
注:M为DL-2000 Markers;1~3为分离株L1、L2、L3 的PCR扩增产物。
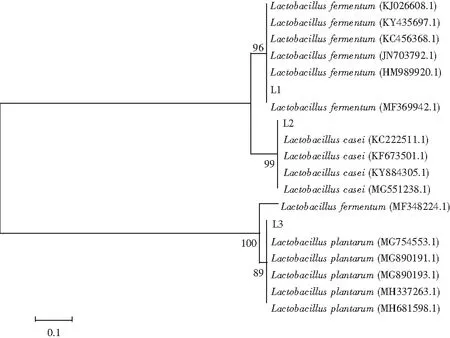
图4 分离株系统发育进化树Fig.4 The phylogenetic trees of isolated strains
分离株16S rDNA 基因PCR扩增结果见图3。可见在1500 bp左右出现条带。对分离株L1、L2、L3的16S rDNA基因进行序列测定及采用Mega 6.0软件构建系统发育树,均分别与Lactobacillusfermentum,Lactobacilluscasei,Lactobacillusplantarum位于同一发育分支,且与上述模式菌株同源性为96%、99%、89%(见图4)。经理化及分子生物学鉴定结果综合判定,分离株L1、L2、L3分别为发酵乳杆菌、干酪乳杆菌、植物乳杆菌。
2.4 抑菌实验
2.4.1 牛津杯法抑菌实验
分离株培养上清液对指示菌的抑制作用见表2。经测定,L1、L2、L3培养上清液均能对指示菌表现出不同程度的抑制作用,其中L2、L3对9株指示菌表现出了强抑制性,抑菌圈直径最大分别达到25,23 mm;而L1与L2、L3相比,对指示菌的抑制作用相对较弱,最大抑菌圈达16 mm。

表2 分离株对指示菌的抑制效果Table 2 The inhibition effect of isolated strains on indicator bacteria
注:L1′、L2′、L3′为乳酸菌过滤培养上清液。抑菌圈直径包含牛津杯外径(7.80 mm);“+”为抑菌圈直径8.00~12.00 mm;“++”为抑菌圈直径12.00~16.00 mm;“+++”为抑菌圈直径16.00~20.00 mm;“++++”为抑菌圈直径20.00~24.00 mm。
2.4.2 共培养实验
分离株培养上清液分别与指示菌菌液进行共培养,实验结果见图5。

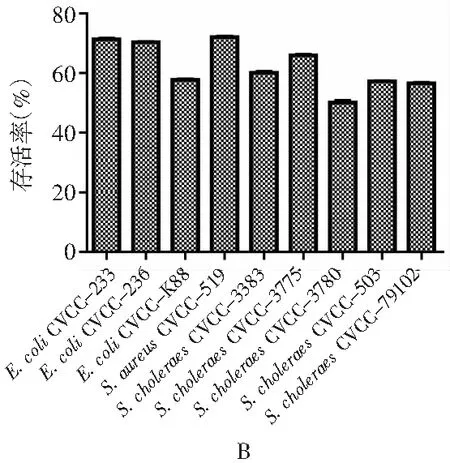
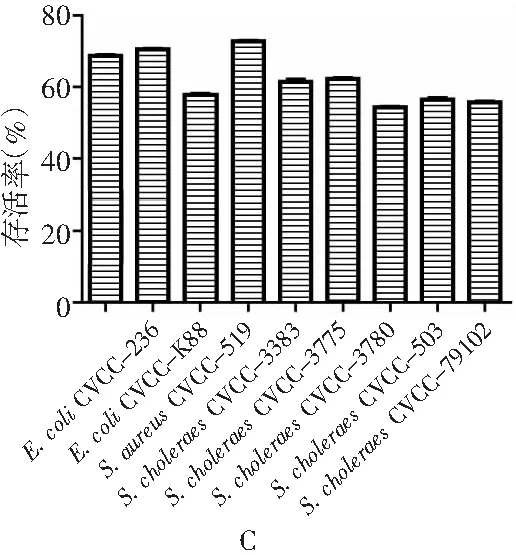
图5 分离株与指示菌共培养实验结果Fig.5 The results of co-culture test for isolated strains and indicator bacteria
注:A为 L1上清液与指示菌共培养;B为L2上清液与指示菌共培养;C为L3上清液与指示菌共培养。
大肠杆菌、沙门氏菌及金黄色葡萄球菌与L2、L3培养上清液共培养后,其存活率可分别降至66.31%、56.2%、72.07%与65.69%、56.18%、72.75%,可见L2、L3培养上清液对指示菌有较强的抑制作用,而指示菌菌液与L1培养上清液共培养后存活率分别为85.98%、97.41%、88.73%,可见L1培养上清液对指示菌的抑制作用相对L2、L3较弱,与打孔法抑菌实验结果一致。
2.5 抗逆性实验
分离株L1、L2、L3抗逆性实验结果见图6。
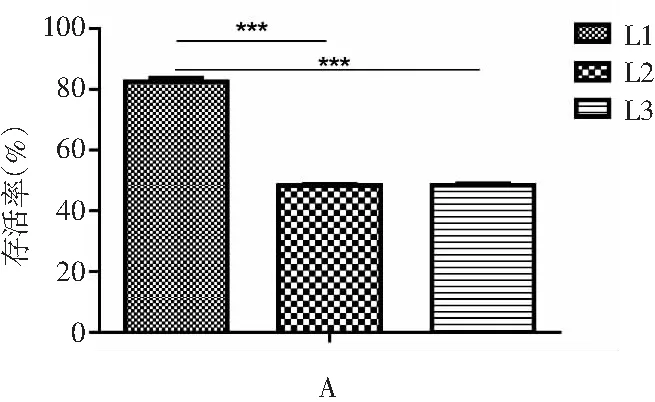

图6 分离株抗逆性实验结果Fig.6 The results of stress tolerance test of isolated strains
注:A为分离株对pH 2的耐受性;B为分离株对0.3%胆盐的耐受性。
分离株L1、L2、L3在pH 2的环境中培养2 h后,存活率分别为82.58%、48.34%、48.49%,可见L1相较L2、L3差异极显著,耐酸性能力更高;在含0.3%胆盐的培养基中培养4 h后,存活率分别为66.56%、54.8%、70.62%,可见L1、L2、L3均具有较强的耐胆盐能力,其中L3的耐胆盐能力最强,且与L1、L2相比差异极显著。
3 结论
乳酸菌作为发酵剂被广泛应用于泡菜、酸奶、发酵肉制品及功能性食品等食品工业中,因而本实验从可食用泡菜中分离乳酸菌菌株,具有一定的食品安全性。杜晓华等从四川发酵泡菜中获得1株植物乳杆菌;周光燕等从发酵泡菜汁样品中分离得到8株植物乳杆菌、4株干酪乳杆菌和2株双发酵乳杆菌;而本实验筛选所得的分离株为植物乳杆菌、发酵乳杆菌和干酪乳杆菌,可见参与泡菜发酵的乳酸菌以植物乳杆菌为主[14,15]。
陈静等从泡菜中分离得到4株乳酸杆菌,采用打孔法研究了分离株发酵液对金黄色葡萄球菌等指示菌的抑菌能力,研究发现:分离株J-4发酵液对金黄色葡萄球菌的抑制效果显著,抑菌圈直径可达17 mm,而本实验中抑制实验结果表明:干酪乳杆菌L2与植物乳杆菌L3的培养上清液对指示菌的抑菌圈直径均可达到20 mm,而发酵乳杆菌L1的培养上清液对指示菌的抑菌圈直径可达16 mm,可见本实验分离所得的乳酸菌抑菌效果更强;同时,共培养实验结果表明指示菌经与分离株上清液共培养后存活率均有所降低,且L1对指示菌存活的抑制作用小于L2与L3,该实验结果与牛津杯法抑菌结果一致,充分验证了乳酸菌的胞外产物中含有抑菌物质,能够有效抑制致病菌的生长,为日后研发新型天然食品防腐剂奠定了理论基础[16]。
通常人体进食后胃部 pH 在3.0~5.0之间,小肠中胆盐含量在0.03%~0.3%范围内波动[17],因此益生性乳酸菌应对酸和胆盐具有一定的耐受性,这是更好地发挥益生作用的关键。Kim 等对6株从泡菜中分离出的乳酸菌进行了耐酸实验,研究发现其在pH 2.5的环境中存活率均在62%以上,而本实验检测的分离株抗逆性实验结果表明,发酵乳杆菌L1、干酪乳杆菌L2与植物乳杆菌L3分别在pH 2的环境中作用2 h后,存活率分别可达82.58%、48.34%和48.49%,可见不同菌株对pH 2酸性环境的耐受性有所差异[18];同时吴云等在胆盐耐受性实验中研究发现,胆盐浓度为0.2%和0.3%时乳酸菌活菌数都达到了107cfu/mL 以上,存活率为88.48%,这说明筛选出的植物乳杆菌W对胆盐有较强的耐受能力,而本实验检测了分离株在含0.3%胆盐培养基中分别培养4 h后的活菌数,经计算存活率分别达70.62%、66.56%和54.8%[19]。因此,筛选出的3株分离株均有一定的抗逆性,具有潜在的生产应用价值,为后续评估其他益生潜力奠定了基础。

