基于叶绿素荧光探讨链霉素对念珠藻生长及光合毒性效应
张红波 董聪聪 杨燕君 付君珂 刘 黎 贺新宇 施军琼 吴忠兴
(西南大学三峡库区生态环境教育部重点实验室, 重庆市三峡库区植物生态与资源重点实验室, 重庆 400715)
抗生素是一种天然和半合成的化合物, 可以抑制或消除微生物(例如细菌、真菌或原生动物)的生长[1]。随着农业、畜牧业和水产养殖业的发展, 抗生素在现代农业、畜牧业和水产养殖业等中都发挥着重要作用[2]。然而, 由于抗生素的大量使用, 过期抗生素药品处理不当及含抗生素污水处理不完全等原因, 导致大量抗生素药物不断地排放到水环境中, 其对环境安全、生态系统及人类健康的威胁越来越严重[3,4]。有报道, 目前水中检测到的抗生素有50余种, 不同的抗生素在水中的残留量从ng/L到μg/L不等[5,6]。Wei等[6]调查研究发现江苏省大型禽畜养殖场废水中磺胺甲嘧啶、氧四环素、四环素和磺胺甲恶唑检测到的最大浓度分别为211、72.9、10.3和 63.6 μg/L。因此, 抗生素已被认为是一类新兴的环境污染物[7]。
链霉素是从灰色链霉菌(Streptomyces griseus)分离的氨基糖苷类物质, 通过干扰氨酰-tRNA与核糖体的结合, 导致遗传密码错读, 抑制mRNA翻译起始和异常校对的一类抗生素[8]。因此, 其被广泛用于人类和兽医学的预防和治疗, 并作为植物检疫剂[9]。在美国, 链霉素被广泛应用于控制水果、蔬菜、种子、普通作物以及观赏作物的细菌和真菌疾病, 并作为观赏池塘和水族馆微藻生长的杀菌、抑菌的抗生素[10]。沈洪艳等[11]发现链霉素暴露对锦鲤鱼体会造成暂时性损伤, 但最终会恢复到正常水平。王丽新[12]研究表明SOD、GSH、GSH-PX和MDA可作为评估链霉素废水对于斑马鱼污染胁迫的敏感生物标志物。
浮游植物是水生环境中营养链中的第一个环节, 其生长、组成的变化将影响水生生态系统[13]。张磊等[14]研究表明, 链霉素明显抑制了蛋白核小球藻的光合放氧, 对藻细胞产氢后期的生长也有一定抑制作用。Qian等[13]研究表明铜绿微囊藻对链霉素比小球藻更敏感。然而, 这些研究主要探讨链霉素对藻类的生长及抗氧化酶活性的影响, 却很少从光合角度去关注其毒性效应的机制。Strasser和Strasser[15]在基于生物膜能量流动基础上建立了针对快速叶绿素荧光诱导曲线的数据分析和处理方法-JIP-测定(JIP-test), 为深入研究光合作用原初反应提供了有力而便捷的工具。
念珠藻(Nostoc)属于蓝藻门、念珠藻目、念珠藻科、念珠藻属。其分布范围很广, 陆地和水中均有分布, 是一种水体常见的、广谱性的代表种类。由于其获取容易, 且分布范围广泛, 所以念珠藻是一种研究毒素生态效应的理想材料。因此, 为了探讨链霉素对藻类毒性效应机制, 本研究以利用Handy-PEA分析了不同链霉素浓度培养下念珠藻的生长及光合系统叶绿素荧光特性, 旨在从光合角度去揭示链霉素对藻类的毒性效应, 并为探讨抗生素对水生生态系统影响提供实验依据。
1 材料与方法
1.1 藻种培养
念珠藻(Nostocsp. FACHB-95)由中国科学院水生生物研究所淡水藻种库提供。在藻种置光照培养箱中, 以MA培养基静置培养[16], 培养温度(25±0.1)℃, 光照为36 μmol/(m2·s)、光暗比为12h∶12h。
1.2 实验设计
将培养至指数生长期藻种离心后, 分别接入含有250 mL的锥形瓶中, 接种OD为0.115左右。以灭菌后的MA培养基配置链霉素(纯度大于99%, 生工生物工程(上海)股份有限公司)母液, 然后参考环境当中抗生素含量及前期预实验, 将培养基配制成0.05、0.1、0.2、0.5和1.0 mg/L的5个浓度。每个浓度组设置3个重复, 以不含链霉素的MA培养基作为空白对照。培养条件与藻种培养相同, 每天定时摇动3次, 使藻细胞充分与培养液接触。
1.3 叶绿素a及EC50测定
叶绿素a的测定采用90%丙酮于黑暗中抽提24h, 离心后的上清液通过分光光度度计测定630、647、664和750的吸收值[17]。比生长速率的计算参照xiang等的方法[18], 96h半致死浓度(96h-EC50)采用概率单位法(Probit method)进行计算[19]。
1.4 叶绿素荧光动力学曲线及叶绿素荧光参数
取2 mL藻液, 置黑暗处适应25min后, 用便携式植物效率分析仪(Handy-PEA, 英国汉莎公司)测定不同浓度链霉素处理后的念珠藻多相叶绿素荧光变化。测定时光化光为3000 μmol quanta/(m2.s), 收集10μs至2s的荧光信息。并通过JIP-测定获得相关荧光参数(表1)。
1.5 数据分析
实验数据用Excel进行处理, 使用SPSS 22对所有数据均进行单因素方差分析(One-way ANOVA)。当P<0.05, 差异显著性,P<0.01, 差异极显著性。所有图形均用Origin 8.6进行。
2 结果
2.1 叶绿素含量、比生长速率及EC50值
在0.05、0.1、0.2、0.5和1.0 mg/L浓度的链霉素处理下培养至96h, 叶绿素含量与对照组相比分别下降了23.79%、42.80%、71.15%、80.99%和80.23%, 且与对照组均有极显著差异(P<0.01, 图1A)。比生长速率随链霉素浓度升高而下降, 当链霉素浓度高于为0.05 mg/L时, 比生长速率被显著抑制(P<0.05), 当链霉素浓度大于0.1 mg/L时, 念珠藻生长完全被抑制, 比生长速率为负值(图1B)。通过SPSS计算得到念珠藻暴露于链霉素中96h的EC50值(96h-EC50)为(0.13±0.037) mg/L。
2.2 叶绿素荧光动力学曲线
在不同浓度的链霉素处理后, 各浓度下念珠藻的荧光动力学曲线如图2。低浓度(≤0.1 mg/L)的相对荧光动力学曲线与对照组无显著差异。而当浓度高于0.1 mg/L的相对荧光曲线发生了显著的变化, J点消失, 并出现了明显的K点, K点的相对荧光值随链霉素浓度的升高的增大。
2.3 叶绿素荧光动力学参数(JIP-test)
可变荧光(Fv)、光系统Ⅱ(SPⅡ)的潜在活性(Fv/F0)、光系统Ⅱ(SPⅡ)最大光化学效率(φP0)、用于电子传递的量子产额(φE0)、以吸收光能为基础的性能指数(PIabs)和单位面积上有活性的反应中心的数目(RC/CS0)均随链霉素浓度的升高而显著下降, 且与对照组均呈现出极显著的差异(P<0.01,图3A、3B)。然而, 单位叶绿素最大荧光产量(Fm/Chl.a)、单位反应中心吸收的光能(ABS/RC)和反应中心的热耗散(DI0/RC)均随链霉素浓度的升高而增加, 当链霉素浓度大于0.1 mg/L时, 与对照组有极显著的差异(P>0.01, 图3B)。

图1 不同链霉素浓度处理下念珠藻的叶绿素含量(A)和比生长速率(B)Fig. 1 The effects of different concentrations of streptomycin on chlorophyll a content (A) and the growth rate (B) of Nostoc.
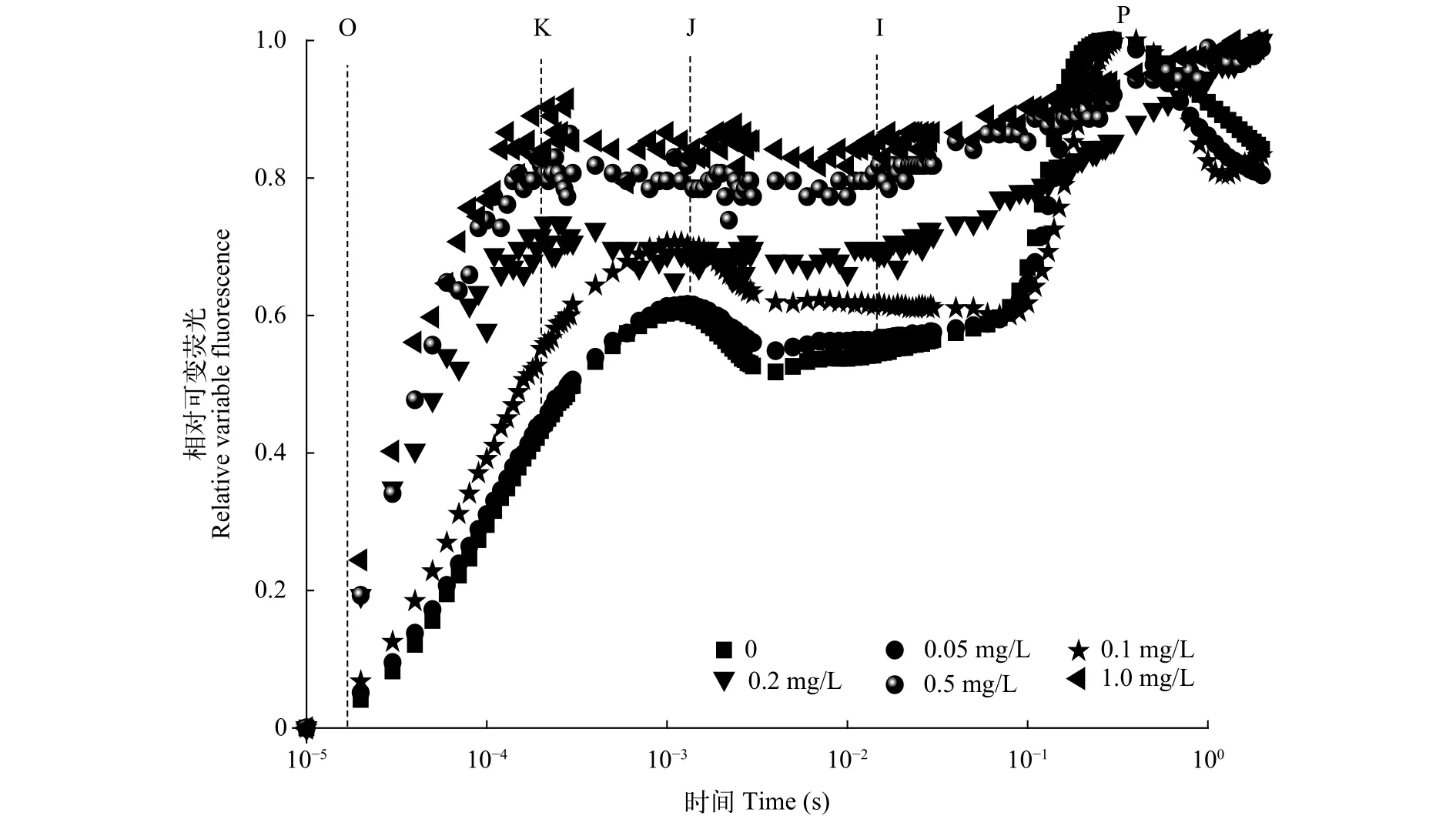
图2 念珠藻快速叶绿素荧光动力学曲线Fig. 2 The fast fluorescence transient curve of Nostoc
3 讨论
3.1 链霉素对念珠藻生长及叶绿素a的影响
抗生素作为常用的药物之一, 由于大量的使用,导致其不断地进入水体环境中, 造成了极大的环境生态风险[21]。先前研究表明, 铜绿微囊藻和小球藻暴露在链霉素中96h后的EC50分别为0.28和20.08 mg/L[13]。本研究表明在链霉素处理96h时, 念珠藻EC50值为(0.13±0.037) mg/L, 与蓝藻铜绿微囊藻(Microcystis aeruginosa)差异不大, 比绿藻小球藻(Chlorella pyrenoidosa)更加敏感。Freyssinet[22]发现链霉素主要与叶绿体核糖体结合, 而与细胞质核糖体结合很少, 进而影响蛋白质进入叶绿体的合成。本文研究发现, 在各链霉素浓度培养96h, 叶绿素a含量与对照组相比明显下降(图1A), 然而单位细胞叶绿素含量并未表现出显著的差异。Reid等[23]发现小球藻暴露于链霉素中, 引起的生长减少是由于小球藻二氧化碳固定受到抑制, 导致生长降低。本研究也发现在链霉素处理后, 念珠藻生长受到显著的抑制, 表明链霉素未通过抑制念珠藻叶绿素a的合成导致其生长受到抑制。
3.2 链霉素对念珠藻荧光动力学曲线的影响
Björkman[24]研究表明叶绿素含量的减少反映了光反应中心复合体天线色素减少, 暗示在链霉素处理后, 念珠藻的光系统可能发生损伤。本研究发现低浓度(≤0.1 mg/L)处理, 念珠藻相对荧光动力学曲线与对照组几乎无显著差异, 而浓度高于0.1 mg/L时相对荧光曲线出现了明显的K点(图2)。研究表明, 当PSⅡ的供体侧受到胁迫时, 在极短的时间内(在J点之前), 叶绿素荧光产量就会上升, 出现K点(光照后大约300 μs处的特征位点)[20,25]。K点的出现是由于水裂解系统受到抑制和QA之前的受体侧部分被抑制所造成, 导致了放氧复合体(OEC)受到损害, 因此放氧复合体往往被作为OEC被伤害的一个特殊标记[26,27]。念珠藻在高浓度链霉素处理后出现了明显的K点, 表明在链霉素处理后念珠藻PSⅡ受体侧受到伤害, 导致了OEC损伤发生。

图3 在不同链霉素处理下念珠藻的荧光参数与对照组的百分比Fig. 3 The effects of streptomycin to the fluorescence parameters of Nostoc
3.3 链霉素对念珠藻光合系统Ⅱ(PSⅡ)荧光动力学参数的影响
PSⅡ反应中心结构的改变, 导致不参与电子传递的封闭反应中心的数量增加, 进而导致了Fv的降低[28]。因此,Fv的降低通常被认为是光合系统Ⅱ(PSⅡ)供体侧的电子传递被抑制的一种表征[29]。本研究发现Fv随着链霉素的增加和降低(图3A), 进一步表明了念珠藻的供体侧电子传递被抑制, 这也可能与复合天线中叶绿素浓度的降低或放氧发生复合物活性的降低有关[30]。在正常条件下, 有活性的PSⅡ反应中心将捕获的光能转化为激发能, 并将其中的一部分转化为化学能, 推动碳同化反应, 其余部分耗散掉。然而, 在某些胁迫下, 光系统Ⅱ(PSⅡ)反应中心发生可能部分失活, 能吸收光能但不能推动电子传递[27]。本研究发现, 单位面积上有活性反应中心(RC/CS0)在链霉素处理后显著低于对照组(图3B), 说明链霉素导致了念珠藻光系统Ⅱ(PSⅡ)反应中心失活或降解。PIabs在一定程度上反映了胁迫对光合结构的破坏[20]。研究已表明高等植物在受到某些胁迫时, 光合机构被破坏,PIabs会显著下降[20,31,32]。在本研究中, 随着培养基中链霉素浓度的增加, 吸收性能指标(PIabs)显著降低(P<0.05), 且高浓度(≥0.2 mg/L)的PIabs为0(图3B), 表明念珠藻的光合机构受到极大破坏, 光合效率大幅度下降。φP0表示电子传递的能量占有活性反应中心捕获的能量的比例, 也反映了PSⅡ最大光化学效率。φE0表示捕获的光能把电子传递到电子传递链中超过的电子受体的概率, 在链霉素处理下, 念珠藻φP0和φE0均显著低于对照组(图3B),表明链霉素降低了念珠藻光系统Ⅱ(PSⅡ)用于电子传递的能量, 且较多的光能用于还原QA, 导致了念珠藻初级光反应和氧化还原反应被抑制, 进而阻断了电子从流向光系统Ⅰ(PSⅠ)。
综上所述, 高浓度链霉素处理, 念珠藻光合结构遭到破坏, 单位面积上有活性的反应中心数量减少, 光系统Ⅱ电子传递受阻, 抑制了光合作用, 导致念珠藻生长受阻。随着水体抗生素的污染加剧, 探讨抗生素的生态毒理效应尤为重要。然而, 关于抗生素对藻类影响的研究相对较少, 因此, 抗生素对藻类的毒性效应研究仍需要开展大量的工作。

