糖尿病的发生与免疫指标的相关性研究
曾通旭,杨波,徐倩,蔡小玲,哈小琴
(1.甘肃农业大学动物医学院,甘肃 兰州 730070;2.甘肃省干细胞与基因药物重点实验室,甘肃 兰州 730050)
前期糖尿病(pre-diabetes,Pre-DM),又称中度高血糖症,主要包括空腹血糖受损(impaired fasting glucose,IFG)和葡萄糖耐量受损(impaired glucose tolerance,IGT),是血糖水平高于正常值又低于糖尿病阈值的一种高风险状态.Ⅱ型糖尿病(T2DM)又称成人发病型糖尿病,是一种非胰岛素依赖型糖尿病,其主要原因是胰岛素抵抗与分泌不足.据不完全统计,全球约有4.7亿人处于Pre-DM,2.1亿人患有T2DM.近20多年来,全球的糖尿病患者急剧增加,据国际糖尿病联合会的调查研究显示,预计到2030年全球T2DM患者将达到4.72亿,其中在东南亚及太平洋地区上升较快.我国是T2DM的高发地区,发病率位居全球首位[1].胰岛素抵抗过程中,首先激活的是先天性免疫反应,该反应能产生炎症因子.当巨噬细胞、抗原提呈细胞、内皮细胞受到体内外各种有害因素干扰时,使NF-κB信号通路激活,加剧释放相关的炎症因子如TNF-α、IL-6、hs-CRP以及炎症介质,进而引起胰岛素抵抗与胰岛素分泌不足.Hotamisligi[2]研究发现,炎症与胰岛素抵抗存在相关性,并推测该因素是引起胰岛素抵抗相关疾病的主要原因之一.鼠类因自身的特点,以及经济、易于基因修饰等优点常被选为T2DM动物模型.T2DM模型主要分为3大类:自发性T2DM模型、诱导性T2DM模型和转基因/基因敲除T2DM模型.通过饮食能制备存在胰岛素抵抗的动物模型,但其周期长,血糖升高用时长且不明显.若只用化学药物来诱导,能够制备出具有胰岛素分泌障碍型的模型小鼠,但其胰岛素抵抗症状与T2DM不符.链脲佐菌素(STZ)为一种特效的抗菌药,主要作用于试验小鼠的胰岛β细胞,由于小剂量STZ可以破坏部分胰岛β细胞,但不会完全破坏,是目前应用最广的造模方法.本文采用高脂饮食制备Pre-DM模型.采用饮食和化学药物诱导联合最终造出周期短,且具有胰岛素抵抗和胰岛素分泌不足的T2DM动物模型.本文的创新点是通过Per-DM与T2DM的动物模型的制备,研究免疫与Per-DM与T2DM的相关性,尝试从免疫方面阻止前期糖尿病发展为糖尿病,以期为临床方向的干预提供理论依据.
1 材料与方法
1.1 试验动物
本试验采用5周龄C57BL/6J雄性小鼠,于2016年11月购于北京维通利华实验动物技术有限公司(SCXK(京)2016~0011).实验动物饲养于解放军兰州军区总医院动物实验中心清洁级动物房,温度(22±2)℃,湿度(50±10)%.分组之前适应性饲喂一周,分组时血糖与体质量无差异性.造模期间,试验动物自由进食饮水.试验期间所有操作符合兰州军区总医院伦理委员会的要求.
1.2 试验设备及试剂
STZ(货号S0130)购自美国Sigma公司.美国BIOTEK酶标仪.美国BD公司FACSCantoⅡ流式细胞仪、BD流式细胞分析用溶血素(349202)、BD小鼠T淋巴细胞亚类分析抗体合剂含同型对照抗体(7228925).瑞士梅特勒-托利多电子分析天平.高糖高脂饲料由北京博泰宏达生物技术有限公司提供(HD001).ACCU-CHEK血糖仪及配套血糖试纸均购于Roche公司.日立生化仪由兰州军区总医院医学检验中心提供.胰岛素Elisa试剂盒购于上海酶联生物科技有限公司.显微镜用Olympus.柠檬酸盐缓冲溶液配制方法:柠檬酸2.1 g定容至100 mL(0.1 mol/L)配制A液;柠檬酸钠2.94 g定溶至100 mL(0.1 mol/L)配制B液.A∶B=11.4∶8.6,配制柠檬酸钠缓冲溶液,pH≈4.5.20%葡萄糖配制:准确称取20 g葡萄糖,先少量水溶解,然后定容至100 mL.
1.3 Pre-DM与T2DM模型的制备
根据前期预试验结果,将80只小鼠随机分为4组,每组20只,入组之前体质量、血糖无显著差异(P>0.05).用高糖高脂(HC)饲料进行饲喂,选取0 d(A组)、40 d(B组)、80 d(C组)为Pre-DM组;高糖高脂饲喂联合小剂量多次注射STZ为糖尿病组(D组),D组每次以40 mg/kg的剂量进行腹腔注射STZ.造模前需12 h禁食不禁水,注射完毕需禁食2 h之后再进行高脂饲喂.多次注射之后,每周测定1次空腹血糖(fasting blood glucose,FBG),用眼科剪剪约0.5 cm尾进行尾静脉采血,第1滴用无菌棉擦去,第2滴测定FBG,血与试纸接触时间不少于5 s.若空腹血糖值>12.3 mmol/L,则判定T2DM模型制备成功.
1.4 腹腔注射糖耐量试验(IPGTT)
STZ腹腔注射3周之后做IPGTT试验.12 h禁食不禁水,采用20%的葡萄糖以2 g/kg的剂量进行腹腔注射.分别在0、0.25、0.5、1、1.5、2 h尾静脉采血测血糖值.药动学AUC是衡量药物在人体内被利用程度的一个重要药动学参数.以时间为横坐标,以体内的葡萄糖浓度为纵坐标,求得药-时曲线图中函数曲线下面积(AUC).用AUC来反映糖耐量与胰岛素抵抗程度.AUC越大表示摄入的葡萄糖越多,表示其糖耐量在下降.其计算公式是:AUC=0.25×(0 min值)+0.5×(30 min值)+0.75×(60 min值)+0.5×(90 min值)+0.25×(120 min值)[3].
1.5 组织病理学形态检查
胰岛与肝脏采样时一半取分子样,备用.一半以4%组织固定液固定10 d,期间更换2次组织固定液.由本院病理科做石蜡包埋,病理切片厚度约10 μm,染色用苏木素-伊红.胰岛及肝脏病理切片的检测结果用光学显微镜来观察,进一步分析在前期糖尿病及糖尿病发生过程中是否伴随器官的损伤.
1.6 生理生化指标的测定
应用流式细胞术检测T淋巴细胞亚群分型,Elisa法测定胰岛素、IL-6、TNF-α的水平及生化指标的上机测定.根据分组,在不同的时间点取材,采血之前,尾静脉测FBG,用摘眼球的方法处死采血,抗凝血采用免疫比浊法来测定超敏C反应蛋白.有研究表明,免疫功能可用T淋巴细胞亚群的比例进行评价[4].用流式仪检测T淋巴细胞亚群CD3+、CD3+CD8+、 CD3+CD4+的分型,通过白细胞计数确定流式管中加入抗体20 μL、样本50 μL,阴性对照与避光孵育15 min,加溶血素反应10 min使细胞完全裂解,之后加PBS 1 000 r/min,5 min,连续2次,上机检测.根据说明书,设置流式细胞仪PE-CyTM偶联CD3+,PE偶联CD4+,FITC偶联CD8+,然后对淋巴细胞作FITC、PE和PE-CyTM的荧光强度检测.促凝血离心,3 000 r/min,15 min.用来做生化指标的检测及用双抗体夹心酶联免疫吸附法(Elisa)法检测小鼠胰岛素、IL-6、TNF-α的表达水平.尿素(UREA)、肌酐(CRE)、尿酸(UA)、甘油三脂(TG)、总胆固醇(CHO)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、游离脂肪酸(FFA)等生化指标检测用全自动生化仪(兰州军区总医院医学检验中心)测定.
1.7 数据统计与分析

2 结果与分析
2.1 制备模型过程中小鼠空腹血糖的变化
各试验组小鼠在造模的过程中空腹血糖一直稳定上升.在Pre-DM 3组,B、C组空腹血糖较A组高,有上升趋势,且组间差异显著(P<0.05).D组注射3周后空腹血糖明显高于其他3组,差异极显著(P<0.01).整个造模过程80只小鼠,死亡19只,HC+STZ组6只血糖没有达到阈值,造模成功率64.3%.注射STZ 3周后,模型制备成功.整个造模过程血糖变化见图1.
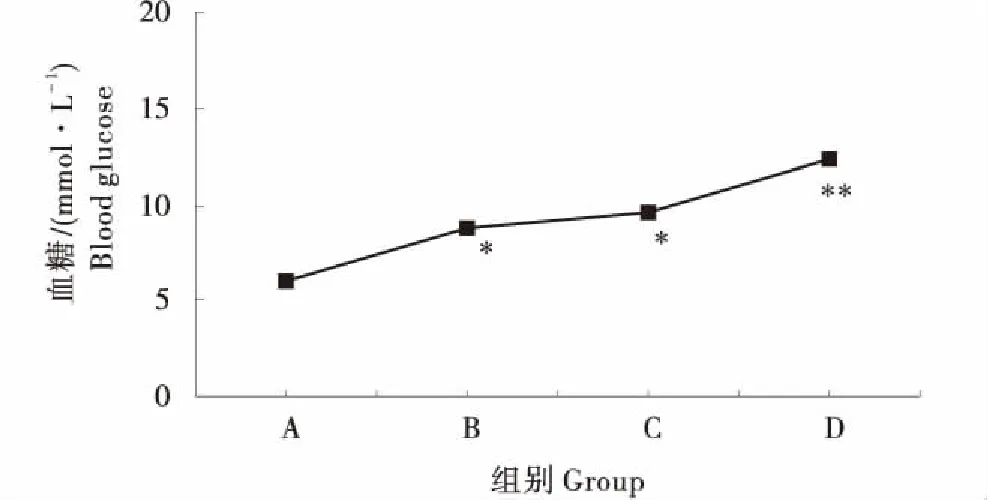
图1 造模过程各组的空腹血糖变化情况Figure 1 The fasting blood glucose(FBG) changes of each group in the modeling process
2.2 制备模型过程中小鼠体质量的变化
由图2可知,与A组相比,B、C组体质量明显上升且差异显著(P<0.05).D组与C组相比体质量差异不显著.且Pre-DM组小鼠活动度降低,取样过程发现脂肪较正常组多.T2DM组小鼠状态较差,活动度显著降低,皮毛蓬松,严重缺乏光泽.
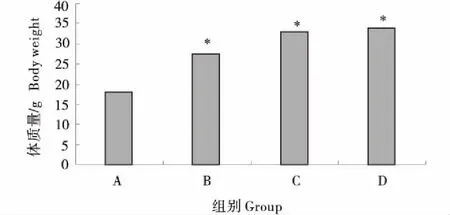
图2 造模过程各组体质量的变化Figure 2 Changes in the body weight during the modeling process
2.3 小鼠糖耐量变化(IPGTT)及胰岛素抵抗
各试验组的IPGTT结果见图3-A.D组在腹腔注射20%的葡萄糖之后,在各个时间点的血糖值与其余3组差异显著(P<0.05).B组和C组与A组相比,15 min的血糖值差异显著(P<0.05).根据药代动力学公式计算,结果见图3-B.
2.4 各模型组肝脏与胰岛的病理切片结果
Pre-DM及T2DM患者一般都是胰岛素抵抗伴随着三大代谢紊乱,即蛋白质代谢、脂肪代谢、糖代谢.主要的是机体糖代谢紊乱.肝脏是蛋白质、脂肪和糖的代谢中心,当肝功能异常时,会引起三大代谢紊乱.本试验中胰腺与肝脏的病理检测结果见图4~5.
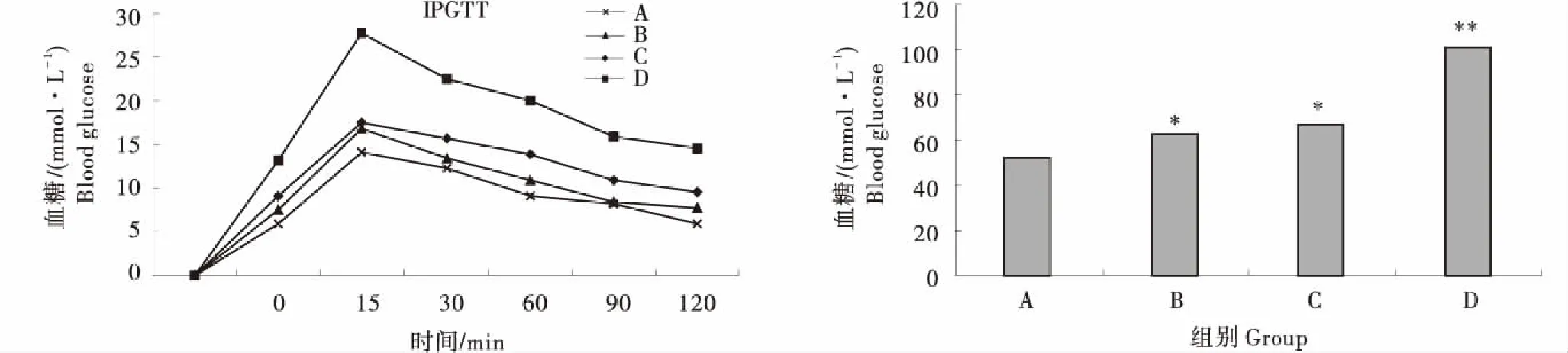
与A组比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01).Compared with group A,the * means significant difference(P<0.05),and the ** means extremely significant difference(P<0.01).图3 小鼠IPGTT及AUC试验结果Figure 3 The IPGTT test and AUC results
2.5 生化指标及胰岛素、CRP、IL-6、TNF-α的Elisa结果
C组CRE与TG与A组无显著差异(P>0.05),D组的UREA、CRE及IL-6与C组之间亦无显著差异(P>0.05).UREA各组间无显著差异(P>0.05).其余组间均有显著差异(P<0.05),结果见表1~2.
2.6 CD3+、CD3+CD8+、 CD3+CD4+等T淋巴细胞亚群比例的变化
发现CD3+CD8+、CD3+CD4+其余组间均差异显著(P<0.05),CD3+A组与D组显著差异(P<0.05),组间差异不显著.结果见表3及图6.

A:与周围腺泡界限清晰.少量腺泡细胞伸入胰岛内;B:胰岛轻度萎缩,轻度纤维化.外分泌部的腺泡细胞之间有较多的脂肪细胞沉积,部分区域的腺泡萎缩;C:胰岛重度萎缩,胰岛内可见脂肪沉积.外分泌部的腺泡细胞之间有少量脂肪细胞沉积;D:胰岛大面积重度萎缩,可见大量透明脂肪和空泡化细胞.胰岛内毛细血管内皮细胞增生.外分泌腺侵入胰岛内,血管周围疏松水肿,部分区域腺泡萎缩.图4 小鼠胰岛HE染色结果Figure 4 HE staining of the pancreatic islets of each groups
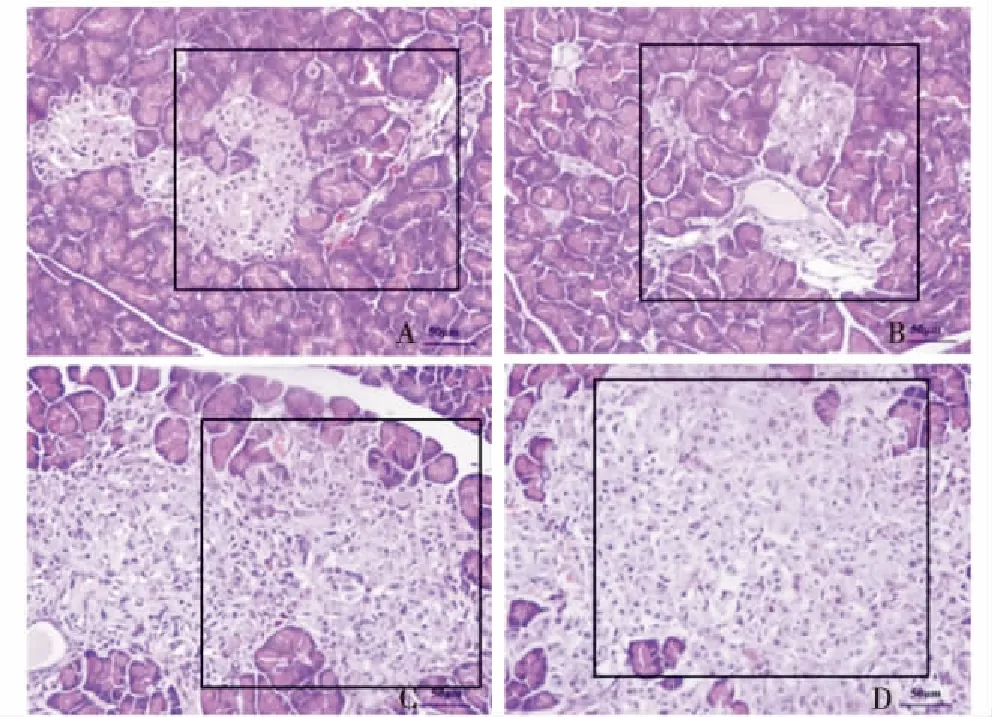
A:肝细胞索较明显,少部分肝细胞凋亡,部分区域肝细胞脂肪变性;B:肝细胞索基本消失,细胞界限不清晰.肝细胞脂肪变性、伴有少量炎性细胞浸润;C:细胞质内出现脂肪滴,肝细胞弥漫型大泡性脂肪变性,细胞核偏于一侧;D:可出现小灶状、多灶状炎性细胞浸润和肝细胞坏死灶.肝细胞弥漫型小泡性脂肪变性,有小灶性炎性细胞浸润.图5 小鼠肝脏HE染色结果Figure 5 HE staining of the liver tissues of each groups

表1 各试验组炎症与免疫相关因子的比较
与A组比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01).
Compared with group A,* means significant difference(P<0.05),and the ** means extremely significant difference(P<0.01).

表2 各试验组生化指标的比较
与A组比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01).
Compared with group A,* means significant difference(P<0.05),and the **means extremely significant difference(P<0.01).

表3 各试验组T淋巴细胞亚群比例
与A组比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01).
Compared with group A,* means significant difference(P<0.05),and the **means extremely significant difference(P<0.01).
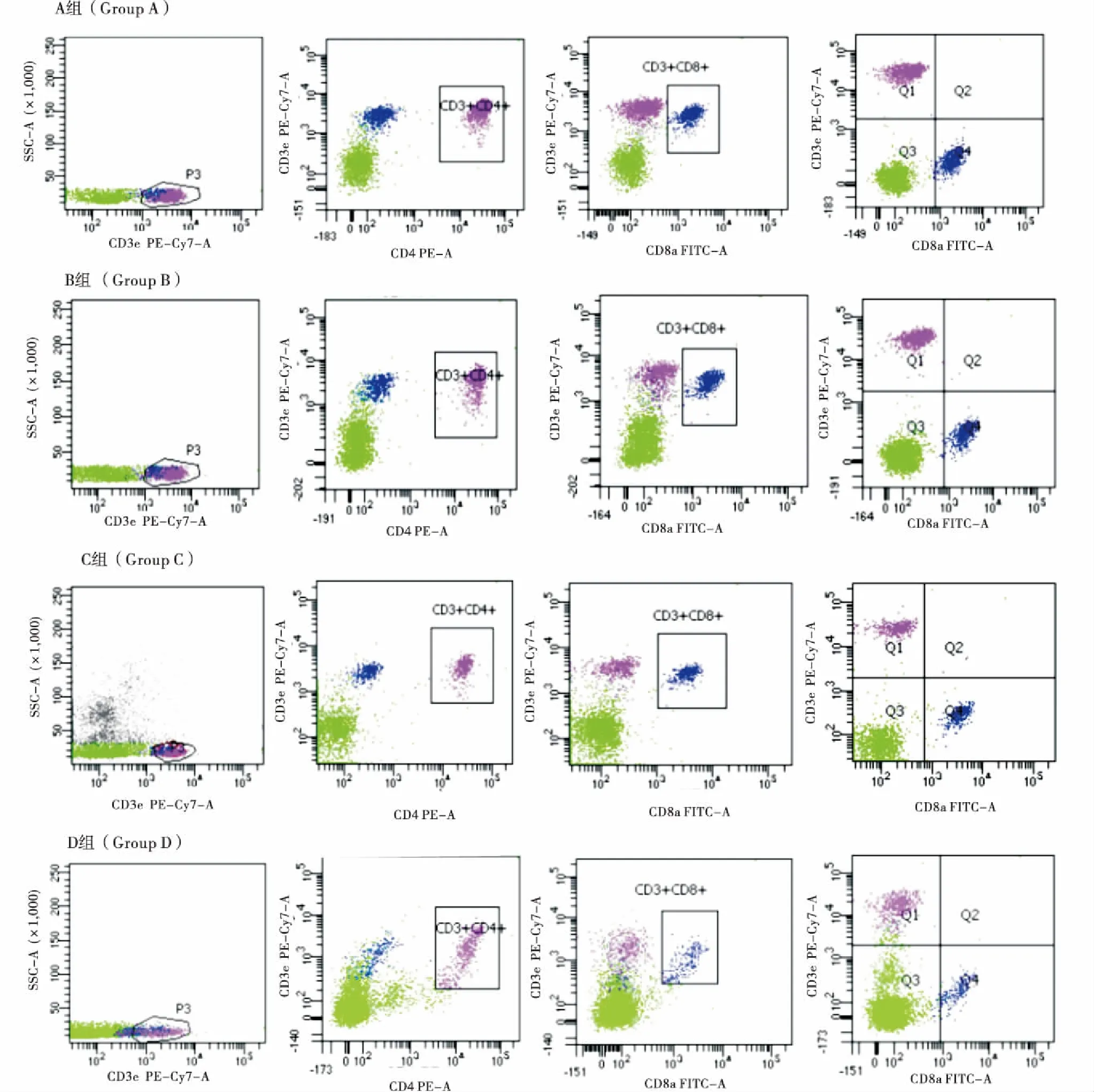
图6 CD3+、CD3+CD8+、 CD3+CD4+等T淋巴细胞亚群流式细胞图Figure 6 Flow cytometry of CD3+,CD3+CD8+,CD3+CD4+T lymphocyte subsets
3 讨论与结论
本研究探讨了小鼠Pre-DM和T2DM模型的制备.T2DM的主要患病原因是胰岛素抵抗与胰岛β细胞功能障碍引起的胰岛素分泌不足,主要的临床症状是高血糖及各种并发症,尤其是对一些终末器官会造成严重损伤,如引起眼、肾、心脏、血管、神经等慢性病变.Pre-DM的血糖水平是处于糖尿病患者与正常之间,25%的Pre-DM患者在5 a之内最终会发展为T2DM[5].IDF 2017年全球糖尿病地图(第8版)发现我国T2DM发病率较高且呈逐年上升趋势,有效地防止该疾病的发生是国内外专家比较棘手的问题.本文通过研究Pre-DM与免疫的相关性,旨在为临床中从免疫方向干预T2DM提供可靠依据.
炎症因子在T2DM、冠心病、类风湿疾病、高血压等许多疾病发生的过程中有举足轻重的作用.20世纪90年代,就已经发现促炎因子IL-6、TNF-α在多种组织中影响葡萄糖水平的稳定性.近年来,炎症在T2DM与Pre-DM的发生过程中备受关注,越来越多的炎症及免疫的标志物,如Hs-CRP、TNF-α、IL-6等都与该病的发生具有相关性.Hs-CRP是机体受到微生物入侵或组织损伤等炎症性刺激时肝细胞合成的一种全身性炎症反应急性期的非特异性标志物,其主要与IL-6和TNF-α的调节相关.由脂肪细胞分泌的细胞因子IL-6和TNF-α是刺激肝脏合成Hs-CRP的主要细胞因子.国际医学界认定,Hs-CRP可以作为预测T2DM发病的危险指标.本文研究发现,Hs-CRP与胰岛素抵抗综合征有较强相关性.有文献报道,随着体内脂肪含量的增加,CRP也有升高的趋势.本文通过实验发现,高脂饲喂的小鼠在Pre-DM发展为Ⅱ型糖尿病的3个时间点,Hs-CRP呈逐渐上升趋势,且组间差异较显著.这表明慢性炎症也是引起引起胰岛素抵抗的因素之一.
IL-6是由活化的T细胞与成纤维细胞产生的淋巴因子,其主要作用是调节细胞免疫活性与激活NK等细胞免疫细胞.IL-6是已知的多功能炎性细胞因子,它能诱导B淋巴与T细胞增殖、分化,产生抗体,参与机体的免疫反应,是炎症发生的始发因子.有研究发现,IL-6可诱发胰岛素抵抗,其主要作用是能减少GLUT-4的表达,从而降低脂肪细胞由胰岛素介导的葡萄糖、脂肪的转运,促进T2DM的发生.IL-6还可降低IRS-1的酪氨酸磷酸化及下游PI3K的活性,导致胰岛素抵抗[7].Devaraj等[7]研究发现,较高浓度的血糖通过上调PKC、MAPK及NF-κB途径导致IL-6的产生增多,且Pre-DM与T2DM患者单核细胞中内脂素、TNF-α、IL-6 mRNA的表达水平显著增高,提示IL-6的升高与Pre-DM及T2DM的IR有关[7].本研究中,4个试验组的IL-6与Pre-DM、T2DM有关,更证实了 IL-6与胰岛素抵抗具有相关性.
TNF具有调节人体免疫与代谢的功能,其不仅是一种有效的肿瘤杀伤因子,而且在调节免疫功能时发挥重要作用,包括TNF-α和TNF-β.TNF-α是一种由巨噬细胞及单核细胞产生的促炎性细胞因子,特点是灵敏度较高,是触发炎症反应的核心.主要功能是参与机体的生长调节、炎症、免疫应答等,是多种信号通路的关键环节.本文研究发现TNF-α在Pre-DM及T2DM状态下产生增多.Tanaka等[8]研究发现,TNF-α能降低过氧化物酶体增殖物激活受体-γ(PPAR-γ)mRNA的表达,减少PPAR-γ产生.PPAR-γ是一类核转录因子,主要表达在脂肪细胞,可控制该细胞内不同的代谢水平,其作用是抗炎与促进凋亡;同时,PPAR-γ激活对leptin的转录作用的抑制,使leptin水平降低,从而增加了体内游离脂肪酸的生成,体内胰岛素水平上升.Peraldi等[9]认为,神经鞘磷脂酶的激活与酰基鞘氨醇的产生是TNF-α影响胰岛素受体活性的重要途径.当P55TNFR与TNF-α结合之后,使神经鞘磷脂水解为酰基鞘氨醇与胆碱,从而引起胰岛素抵抗.TNF-α可能会引起胰岛巨噬细胞活化释放IL-1, 从而使NOS在胰岛β细胞内的表达增多,进一步弱化胰岛素的功能.本试验研究发现D组的TNF-α水平与其他三组差异较显著,并与胰岛素抵抗指数呈显著正相关.由此可见在Pre-DM及T2DM发生的过程中,炎症因子TNF-α起到关键性的作用.
T淋巴细胞亚群是具有免疫调节的细胞群.CD3+代表全T细胞、CD4+与CD8+分别代表辅助性T细胞(Treg)与毒性T细胞且是机体免疫调节的关键,彼此之间通过协同与拮抗作用维持免疫平衡.Treg表面标志较多,特异性最高的是FOXP3+Treg,属于转录因子家族中,当其基因突变时会引起严重的免疫疾病.近年来有研究发现T2DM患者FOXP3+Treg表达较低[10].CD8+受到外来抗原刺激后,发挥有效的细胞介导的免疫杀伤作用,直接破坏靶细胞,CD4+细胞受到外界抗原致敏后,产生淋巴因子,诱导T细胞、B细胞与巨噬细胞的增殖.研究发现在Pre-DM及T2DM时期,CD3+、CD4+、 CD8+等T淋巴细胞较正常组低且各组间差异显著,提示长期处于高血糖状态下,抑制了免疫细胞产生,且CD4+细胞膜上的IL-2R落入血液循环,抑制活化T细胞扩增,从而抑制免疫功能.本研究发现CD3+CD8+、CD3+CD4+组间均差异显著,A组的CD3+与D组显著差异,但组间差异不显著.因此,T2DM发生的过程中T淋巴细胞亚群比例失衡,提示细胞免疫功能存在缺陷.
本试验研究发现,慢性炎症也是引起胰岛素抵抗综合征的一个重要因素.虽然越来越多的流行病学与临床研究证实炎症参与了胰岛素抵抗,但是由于研究的局限性所致,目前关于炎症与免疫因子在Pre-DM与T2DM中具体的调控机制有待进一步研究.本文研究的各项免疫指标的水平与Pre-DM和T2DM之间有较强的相关性,可为今后的相关研究提供更多的理论依据.

