保护素对原代肺成纤维细胞炎症及纤维化增殖的影响
郑声星,潘静怡,谷丽君,杨静想,陈新瓯,李明,金胜威
(温州医科大学附属第二医院育英儿童医院 麻醉与围术期医学科,浙江 温州 325027)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是临床上常见的病死率极高的急危重症[1-2]。成纤维细胞作为最广泛间质组成细胞,在ARDS早期可过度增殖并产生胶原蛋白,启动纤维化程序,最终导致肺纤维化[3]。研究表明成纤维细胞可作为炎症效应细胞分泌细胞因子如前列腺素E2(Prostaglandin E2,PGE2)、肿瘤坏死因子-α及各种炎症介质如白细胞介素-8、6、10并且高表达环氧合酶-2(cyclooxygenase-2,COX-2)等[4]。保护素DX(PDX)为内源性抗炎促炎症消退介质,在炎症反应中发挥抗炎作用[5]。我们曾报道PDX能抑制博来霉素诱导的肺纤维化[6],然而PDX对于原代成纤维细胞早期纤维化增殖及炎症反应的影响仍然未知。故本研究培养原代小鼠肺成纤维细胞,观察PDX对肺成纤维细胞COX-2合成、PGE2表达以及其纤维化增殖转化、胶原蛋白合成的影响。
1 材料和方法
1.1 材料 PDX购于美国Cayman公司,内毒素(LPS,E.coilserotype 055:B5)、辣根酶标记山羊抗兔IgG及山羊抗鼠IgG购于美国Sigma公司,重组TGF-β1购于美国Peprotech公司,胎牛血清及DMEM培养基购于美国Life Technologies公司,BrdU细胞增殖试剂盒购于英国Promega公司,PGE2ELISA试剂盒购于美国R&D公司,RNeasy试剂盒购于美国Qiagen公司,M-MLV反转录试剂盒购于美国Invitrogen公司,兔抗人COX-2单克隆抗体、鼠抗人Vimentin(波形蛋白)单克隆抗体、鼠抗人CD31单克隆抗体、兔抗人F4/80单克隆抗体以及兔抗人细胞角蛋白-8(cytokeratin-8)单克隆抗体均购自英国Abcam公司。
1.2 方法
1.2.1 小鼠肺成纤维细胞分离和培养:参照我们之前培养成纤维细胞方法[7]。具体如下:小鼠称体质量,腹腔注射10%水合氯醛0.4 mL/100 g麻醉,完整取出心、肺、气管,分离肺并除去心脏和大气道,置于放有预冷的PBS(青霉素100 IU/mL、链霉素 100 IU/mL)的无菌培养皿中,反复用预冷的PBS液冲洗,用小剪刀将肺组织剪碎(<1 mm3),加入0.25%胰蛋白酶(37 ℃预温)适量,用吸管反复吹打1.5 min, 加入含15% FBS的DMEM培养液终止消化,1 000 r/min 离心5 min,弃上清,置于培养皿中,再加入少量15% FBS的DMEM培养液悬浮组织块,加入培养液以不飘起组织块为宜。37 ℃、5% CO2培养箱培养,1~2 d细胞爬出,加15% FBS的DMEM培养液(勿让组织飘起)。细胞接近融合时,按1:2接种传代,40 min后换培养液(差速贴壁法)。4~6代细胞用于实验。
1.2.2 HE染色:将传代的成纤维细胞消化成细胞悬液,计数细胞,调整细胞密度为1×104/mL,接种于24孔板内,吸弃上清液,加95%乙醇50 min,加入苏木素20 min染核,纯净水洗1遍,0.1%盐酸乙醇分化1 min,再用纯净水洗1遍,温水返蓝1 min,最后伊红染5 min,倒置显微镜下观察。
1.2.3 免疫荧光鉴定:将传代的成纤维细胞消化成细胞悬液,计数细胞,调整细胞密度为1×104/mL, 接种于24孔板内,吸去培养孔中的培养液,加入含4%多聚甲醛的0.01 mol/L PB(pH 7.2)1 mL,室温下固定30 min,PBS洗3次,含0.2% Triton的PBS洗2次,再PBS洗2次,10%山羊血清的0.01 mol/L PBS(pH 7.2)封闭40 min(室温),保持湿度一抗孵育过夜(4 ℃),次日晨用PBS洗3次,每次5 min,加结合有FITC的二抗(避光)室温孵育1 h,PBS洗3次,每次10 min,DAPI复染核15 min,PBS洗1次,荧光显微镜(Nikon eclipse 90i,Tokyo,日本)下观察检测成纤维细胞vimentin、CD31、F4/80以及cytokeratin-8的表达情况。
1.2.4 实验分组:LPS诱导急性炎症模型:①Control组:无任何处理;②LPS组:LPS(1 μg/mL)刺激6 h;③PDX+LPS组:PDX加LPS(1 μg/mL)刺激6 h。 TGF-β1诱导纤维化增殖模型:①Control组:无任何处理;②不同浓度TGF-β1组:不同时间点(24、48、72 h)给予不同浓度TGF-β1(1、10、20 ng/mL); ③不同浓度PDX+TGF-β1组:给予不同浓度(0、1、10、100 nmol/mL)PDX加上TGF-β1(10 ng/mL)刺激48 h。药物刺激前均无血清DMEM培养基培养24 h。
1.2.5 Western blot检测COX-2 蛋白的表达:取 1 μg/mL LPS合并PDX诱导培养6 h后的肺成纤维细胞,加入适量细胞裂解液,冰上孵育50 min, 12 000 r/min离心20 min。采用BCA试剂盒测蛋白浓度。取总蛋白进行电泳,然后电转膜上。把膜放入含5 g脱脂奶粉中室温封闭1 h,加入COX-2一抗1:1 000,4 ℃摇动过夜。次日室温下TBST洗膜3次,每次15 min,接着加入辣根酶标记山羊抗兔IgG抗体(1:2 000稀释),在室温下轻轻摇动1 h,然后洗膜3次,每次15 min。最后按化学发光显影试剂盒(ECL)要求加ECL试剂,室温下温育2 min后仪器进行曝光。在凝胶成像分析系统(Bio-Rad,美国)中测量目的蛋白特异性条带相对表达强度(灰度值),再与内参相对表达强度进行比较,得出相对比值。
1.2.6 ELISA法检测细胞上清液中PGE2的含量:LPS 和(或)PDX作用结束后收集细胞上清液,2 000 r/min 离心 5 min后待测。按照R&D公司ELISA试剂盒说明书操作,检测细胞上清液中PGE2的含量。
1.2.7 BrdU细胞浓度测定试剂盒检测细胞存活度:将分离纯化的4-6代细胞以4×105~8×105cells/mL 进行铺板(96孔,100 μL/孔,5复孔);细胞去血清化24 h后,应用PDX、TGF-β1等对细胞进行干预。培养24 h后,加入20 μL试剂盒增殖溶液。培养箱培养1.5 h。每孔内加入反应终止液终止反应。酶标仪检测490 nm吸光度值,应用培养液替代样品为阴性对照组。各孔检测的吸光度值减去阴性对照组的吸光度值。
1.2.8 Real time PCR检测胶原蛋白1α1(collagen 1α1)、胶原蛋白1α2(collagen 1α2)、α-SMA和纤连蛋白(fibronectin)mRNA的表达:取10 ng/mL TGF-β1+ PDX(100 nmol/mL)诱导培养48 h的小鼠原代肺成纤维细胞,根据说明书使用RNeasy试剂盒纯化RNA。采用M-MLV反转录试剂盒进行RNA反转录,获得cDNA。PCR引物序列如下:collagen 1α1的正向引物为5’-GAAGCACGTCTGGTTTGGA-3’,反向引物为5’-ACTCG AACGGGAATCCATC-3’;collagen 1α2的正向引物为5’- CCAACAAGCATGTCTGGTTAGGA-3’,反向引物为5’-TCAA ACTGGCTGCCACCAT-3’;α-SMA的正向引物为5’-GTCCCA GACATCAGGGAGTAA-3’,反向引物为5’-TCGGATACTTCAG CGTCAGGA-3’;fibronectin的正向引物为5’-AAGACCA TACCTGCCGAATG-3’,反向引物为5’-GAACATGACCGATTT GGACC-3’。把板置于LightCycler 480实时定量PCR反应仪上进行检测,95 ℃ 7 min预热,95 ℃ 18 s,56 ℃ 18 s,第二步至第三步共进行40个循环。根据CT值和标准曲线计算,并根据2-ΔΔCT计算基因相对表达水平[8]。
1.3 统计学处理方法 以GraphPad5.0软件进行分析处理。所有数据以±s表示,采用单因数方差分析进行组间比较,再进行方差齐性检验后,方差齐性者两两比较采用LSD法,方差不齐者进行Dunnet’sT3检验。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠肺成纤维细胞纯化及鉴定 组织块贴壁培养1~2 d后显微镜下可见长梭型细胞从组织块中爬出,3~5 d后细胞生长迅速并接近融合。成纤维细胞较大,呈突起的纺锤形或星形的扁平状结构,核椭圆形,核仁明显,细胞伸出多个突起(见图1)。传代后的肺成纤维细胞几乎长满整个培养瓶,偶见其他非成纤维细胞,细胞增殖能力强,但连续传4~6代后,细胞增殖能力逐渐下降。免疫荧光检测肺成纤维细胞呈vimentin(成纤维细胞标记)阳性,CD31(内皮细胞标志)阴性,F4/80(巨噬细胞标记)阴性,cyto-keratin-8(上皮细胞标记)阴性,见图2。
图1 传代后肺成纤维细胞(HE,×200)
2.2 PDX对于LPS刺激原代肺成纤维细胞COX-2蛋白表达的影响 Western blot结果显示正常小鼠原代肺成纤维细胞存在COX-2蛋白微量表达;LPS刺激诱导下,COX-2蛋白大量表达;PDX能抑制LPS诱导的COX-2蛋白的表达。Control组与LPS组比较差异有统计学意义(P<0.01),LPS组与LPS+PDX组比较差异有统计学意义(P<0.01),见图3。
2.3 PDX对于LPS刺激原代肺成纤维细胞上清液PGE2含量的影响 PDX能抑制LPS诱导后原代肺成纤维细胞上清中PGE2的含量。Control组与LPS组比较差异有统计学意义(P<0.01),LPS组与LPS+PDX组比较差异有统计学意义(P<0.01),见图4。
2.4 不同浓度TGF-β1刺激不同时间后细胞存活度检测 在TGF-β1的刺激下,小鼠原代肺成纤维细胞出现了增殖反应,3个浓度TGF-β1组与Control组相比,均出现了增殖反应(P<0.01)。在24、48 h,TGF-β110 ng/mL组与其他各浓度组比较细胞增殖反应更大 (P<0.05),在各个浓度的不同刺激时间里,48 h时细 胞增殖反应较大(P<0.05),因此可以确定TGF-β1刺激致细胞纤维增殖模型的最适刺激浓度为10 ng/mL, 最佳刺激时间为48 h。见图5。

图2 肺成纤维细胞免疫荧光检测结果(DAPI为细胞核染色,Merge为叠加图,×200)

图3 PDX抑制LPS诱导的肺成纤维细胞COX-2蛋白表达
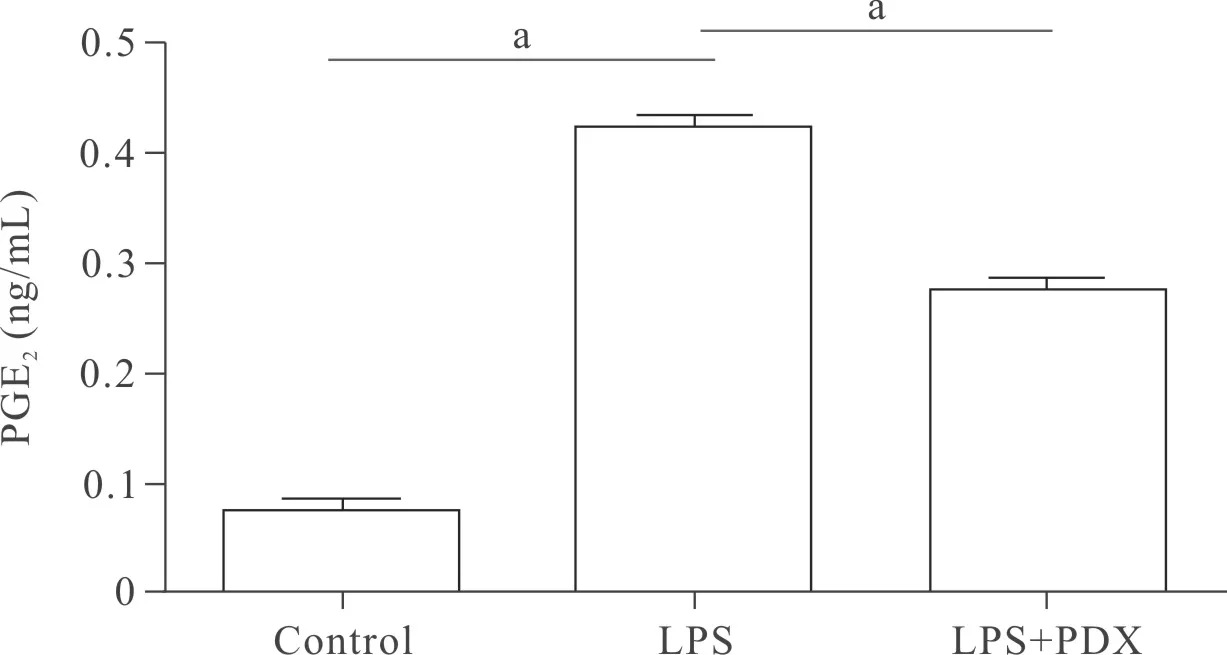
图4 PDX抑制LPS刺激6 h肺成纤维细胞的PGE2表达
2.5 PDX对TGF-β1诱导的小鼠原代肺成纤维细胞增殖的影响 实验结果显示,PDX呈剂量依赖方式抑制TGF-β1诱导的小鼠原代肺成纤维细胞增殖。Control组与TGF-β1组比较差异有统计学意义(P< 0.01);PDX组与Control组比较差异无统计学意义(P>0.05);100 nmol/L PDX组显著抑制学报纤维化增殖,与TGF-β1+PDX 1 nmol/L组、TGF-β1+PDX 10 nmol/L组相比,差异有统计学意义(P<0.01)。后续实验选择100 nmol/L作为PDX的浓度。见图6。
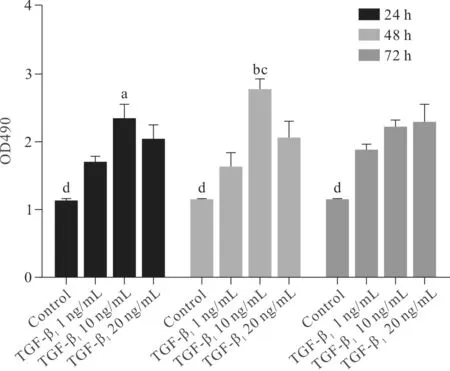
图5 不同剂量不同时间TGF-β1诱导对原代肺成纤维细胞增殖的影响
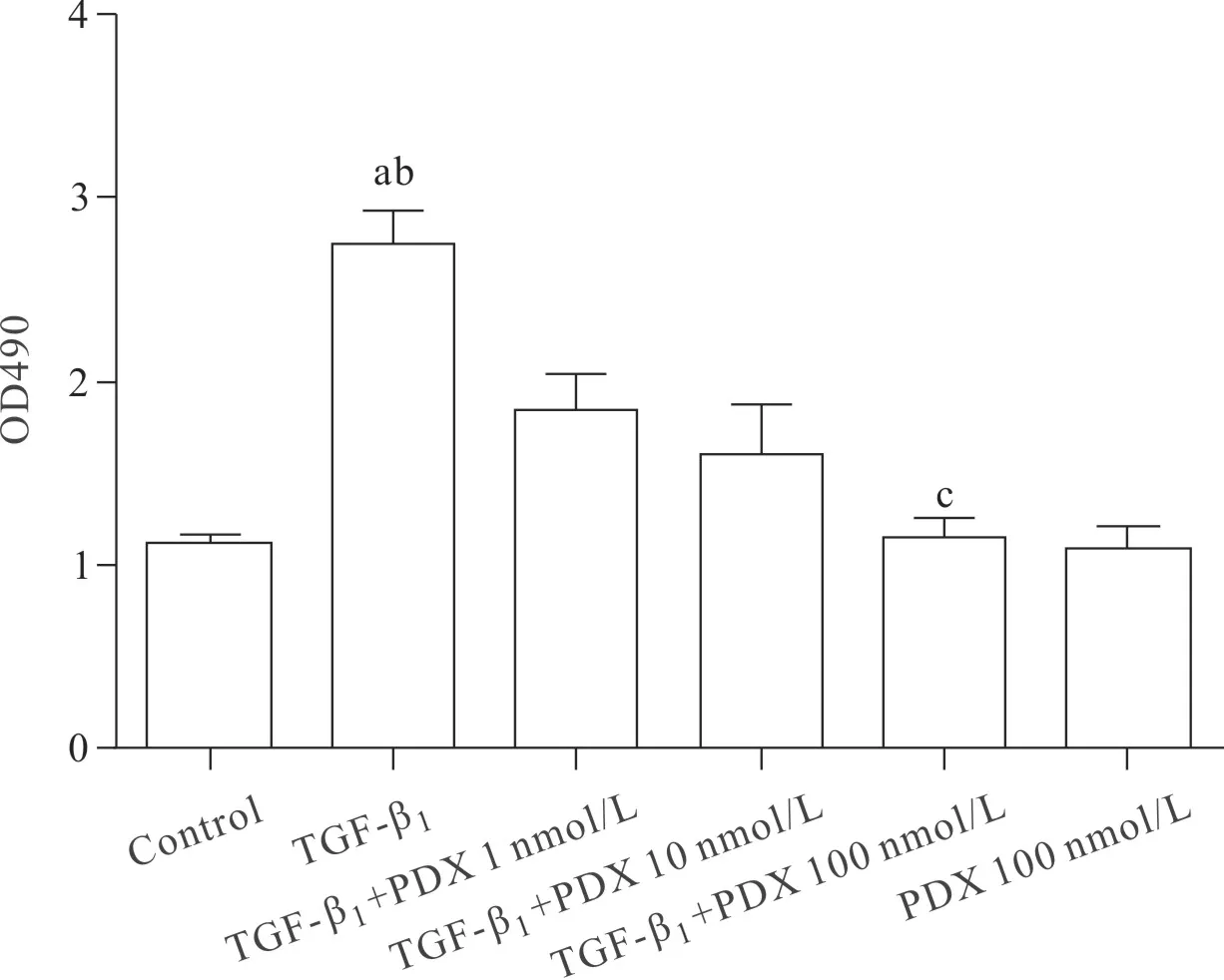
图6 PDX以剂量依赖方式抑制TGF-β1诱导的原代肺成纤维细胞的增殖
2.6 PDX对于TGF-β1诱导的原代肺成纤维细胞胶原蛋白合成以及α-SMA和fibronectin基因表达的影响 α-SMA以及fibronectin是成纤维细胞向肌成纤维细胞转化的标志物[9]。实验结果表明,TGF-β1能促进原代肺成纤维细胞collagen 1α1、collagen 1α2的合成以及α-SMA、fibronectin的基因表达,TGF-β1组与Control组相比较差异均有统计学意义(P<0.01);PDX能抑制TGF-β1诱导的原代肺成纤维细胞collagen 1α1、collagen 1α2的合成以及α-SMA、fibronectin的基因表达,TGF-β1组与TGF-β1+PDX组相比差异均有统计学意义(P<0.01)。见图7。
3 讨论

图7 PDX抑制TGF-β1诱导的原代肺成纤维细胞胶原蛋白的合成、fibronectin 基因及α-SMA的基因表达
ARDS分为3个阶段[10],初始化阶段为急性炎症期,炎症期后为纤维增生期,在此期间间充质细胞,特别是间质成纤维细胞增殖并分泌细胞外基质蛋白质如胶原蛋白[11],如果这时炎症还不能消退,会进入肺纤维化阶段。ARDS 3个阶段互相交叉重叠,而成纤维细胞的激活是其交叉重叠的标志[12]。成纤维细胞不仅能促进组织修复,而且能调节炎症发生发展及消退过程[12]。我们之前的研究表明,成纤维细胞在LPS诱导下能表达COX-2并伴随PGE2的产生[7]。COX-2是催化花生四烯酸转化为前列腺素类物质的限速酶[13],其在呼吸系统炎症发生发展过程中起到至关重要的作用。故本研究采用LPS诱导原代成纤维细胞建立体外炎症模型。
PDX是抗炎促炎症消退脂质介质家族成员之 一[5]。研究表明PDX降低活性氧生成,抑制中性粒细胞脱粒、浸润[14],并且能降低脓毒血症患者的生存率[15]。本研究表明,PDX能抑制LPS诱导的原代肺成纤维细胞COX-2蛋白的表达,ELISA法检测发现,PDX能降低LPS刺激后肺成纤维细胞上清中PGE2的水平,提示在ARDS早期炎症阶段PDX能抑制炎症瀑布样扩大,从而改善ARDS预后。
研究表明ARDS早期就可出现纤维化增殖,如增殖反应未减弱,会导致临床预后不佳[6]。这种纤维化增生阶段是一种潜在的可逆状态,被视为ARDS治疗过程中的最佳靶点[16]。炎症反应中成纤维细胞被过度激活,分泌炎症因子,同时过度纤维化增殖并促进其I胶原蛋白的合成及向肌成纤维细胞转化,最终导致肺功能障碍及肺纤维化[17]。因此可通过抑制肺成纤维细胞早期纤维化增殖及胶原蛋白的合成,促进肺功能的恢复,改善ARDS的转归和预后。α-SMA是成纤维细胞激活的标志。纤维化过程中I型胶原蛋白会大量合成并堆积,故影响I型胶原表达的因子是抗纤维化的研究重点[18]。TGF-β1能介导成纤维细胞纤维化增殖、向成纤维母细胞的转化以及纤维化相关基因的表达[19-20]。因此本实验采用不同浓度TGF-β1刺激原代成纤维细胞不同时间建立纤维化模型,发现采用10 ng/mL TGF-β1刺激原代成纤维细胞48 h建立纤维化模型是比较合理的。研究发现PDX能抑制博来霉素诱导的肺纤维化,抑制上皮细胞向间质转化,促进其肺功能恢复[6]。本实验结果表明PDX能通过剂量依赖方式抑制TGF-β1诱导的原代肺成纤维细胞的增殖,同时能抑制其I型胶原蛋白合成以及α-SMA和fibronectin基因的表达。
综上所述,PDX能抑制LPS诱导的小鼠原代肺成纤维细胞COX-2表达,抑制TGF-β诱导的小鼠原代肺成纤维细胞纤维化增殖转化。

