Let-7诱导自噬在酒精性肝病中的作用研究
钱倩宇潘然,2常开心田男钱颖杜仲燕李松涛窦晓兵
1.浙江中医药大学 杭州 310053 2.浙江大学
酒精性肝病(alcoholic liver disease,ALD)已成为全球关注的公共卫生问题。近年来在我国的发病率和死亡率逐步增加,已成为仅次于病毒性肝炎的第二大肝病[1]。如何有效防治ALD是现代医学迫切需要解决的问题。由于其发病机制复杂,迄今为止尚无安全有效治疗ALD的临床用药[2]。因此,更深入地探究ALD发病过程中的发病机制,对临床上寻求其有效治疗方法有着重要而迫切的意义。
近年来,越来越多的研究表明,MicroRNA(miRNA)参与酒精性肝损伤、脂肪肝、肝细胞癌等慢性肝病的发病过程[3-4]。Lethal-7(let-7)是目前研究最为广泛的 miRNA 之一[5],在人类中,let-7家族由13个成员组成,并在体细胞组织和器官中大量表达[6-7]。研究表明,let-7a通过调控细胞自噬抑制癌细胞增殖[8-11],而自噬在各种肝脏疾病发病机制中同样扮演着重要的角色[12-13]。ALD患者由于长期过量饮酒会导致肝脏内自噬水平下调[14-15],从而加剧 ALD的发生发展。因此,本研究推测let-7可能通过对自噬的调节来调控ALD及其它相关肝脏疾病的发生发展。
lncRNA(long con-coding RNA,lncRNA)是一类位于细胞核或细胞质内长度大于200个核苷酸的非编码RNA[16-22],广泛参与细胞分化、代谢、增殖等过程,并与多种疾病关系密切。在基因表达调控研究中,lncRNA对miRNA的调控是十分重要的一个环节,并进而介导了转录调控、转录后调控、翻译调控等几个重要的基因表达模块[24]。lncRNA可以发挥内源性miRNA“海绵”的功能,或通过与miRNA竞争结合靶基因以抑制miRNA表达[25]。因此,本研究探究lncRNA与 let-7 miRNA的潜在作用关系。
综上所述,本研究推测lncRNA可能通过调控let-7 miRNA的表达,从而影响肝细胞自噬,进而探究lncRNA和 let-7通过调控自噬在ALD发生发展中的潜在作用机制,为 ALD的临床诊断及治疗提供新的思路和理论依据。
1 材料与方法
1.1 主要实验材料与仪器 细胞:人肝细胞HepG2购自中科院上海细胞库。试剂:丙氨酸氨基转移酶(alanine aminotransferase,ALT)检测试剂盒购自南京建成生物有限公司,甘油三脂试剂盒购自北京普利莱基因技术有限公司,谷胱甘肽(glutathione,r-glutamyl cysteingl+glycine,GSH)和氧化型谷胱甘肽(oxidized glutathione,GSSG)试剂盒购自碧云天生物技术有限公司,硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)试剂盒购自亚诺法生计股份有限公司。其他实验试剂均购自Sigma Aldrich公司。仪器:微量紫外分光光度仪(型号QWell 5000)购自美国Quawell公司,酶标仪(型号MR-4100)购自美国Dynatech公司,台式高速冷冻离心机(型号5541RB31614)购自德国Beckman公司,二氧化碳培养箱(型号HEPA CLASS 1003111)购自美国Thermo Fisher Scientific公司。
1.2 方法
1.2.1 细胞培养及分组 人肝细胞HepG2用含10%胎牛血清、青霉素100 U/mL、链霉素100 μg/mL的DMEM培养液于37℃,5%CO2条件下培养。制备人肝细胞HepG2单细胞悬液,细胞按2×105个/mL密度接种于24孔培养板内,每孔1mL,分成2组:①空白对照组(untreated group,UT):不作任何药物处理;②模型组:用200 μΜ H2O2处理,过夜处理16h。以上两组每组设12个重复孔。
1.2.2 乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测 根据LDH检测试剂盒说明测定各组细胞培养上清中LDH水平,分析各组间的细胞毒性作用。
1.2.3 小鼠ALD模型 使用体质量为25±0.5g的雄性C57BL/6小鼠,采用Lieber-DeCarli法建立小鼠ALD模型。分别喂养含酒精的液体饲料(alcohol feeding group,AF组)以及等热量的对照液体饲料(pair feeding,PF组)喂养5周。每天记录小鼠进食量,每周记录小鼠体重。经过5周的喂食后,将小鼠禁食不禁水5小时,用戊巴比妥钠麻醉后通过下腔静脉采集血样。取肝脏组织,部分组织4%多聚甲醛固定,固定组织制作石蜡切片,HE染色法观察肝脏组织病理学改变,其余组织-80℃保存待用。
1.2.4 测定肝脏损伤及脂肪累积 将血样4℃下以3000 rpm离心5min制备血浆样品。通过使用ALT活性测定试剂盒测定血浆ALT水平来评价肝损伤程度。并且,通过使用甘油三酯(triglyceride,TG)检测试剂盒测量总肝TG含量和肝脏组织切片的HE染色来检测肝脏脂肪积累。
1.2.5 测定肝组织及细胞内GSH和GSSG水平及脂质过氧化测定 使用GSH和GSSG检测试剂盒,根据试剂盒说明书,定量检测PF和AF小鼠的肝组织及细胞模型中的GSH和GSSG比例,来评估过量酒精摄入导致的氧化性肝损伤程度。根据说明书使用TBARS试剂盒检测AF和PF小鼠的肝组织TBARS水平,据此评估肝脏脂质过氧化程度。
1.2.6 RNA提取、cDNA合成和Real-time PCR定量检测let-7及其下游靶基因 使用Trizol法提取肝组织样品和HepG2细胞总RNA,使用oligo-(dT)或序列特异性引物进行总RNA的逆转录。荧光定量PCR扩增let-7及其下游靶基因,以18S rRNA为内参,cDNA为模板,进行荧光定量PCR测定。
1.2.7 生物信息学辅助鉴定let-7靶标miRNA及lncRNA 使用Targetscan和miRanda鉴定了已明确的mRNA-miRNA和miRNA-lncRNA相互作用。为了预测miRNA结合位点,从NONCODEv4数据库下载了lncRNA的全长序列。基于TargetScan建立高可信赖miRNA-lncRNA对。为了减少假阳性的数量,仅包含携带至少两个miRNA结合位点的lncRNA。所有上述相互作用的数据导入Cytoscape,构建数据库。
1.2.8 统计学方法 利用SPSS17.0统计软件分析,数据以均数±标准差(±s)表示,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 长期酒精饮食导致小鼠肝组织损伤和脂肪蓄积结果表明,与PF组相比,AF组小鼠肝损伤更为显著,血清ALT水平及肝内TG水平均有显著升高,差异有统计学意义(P<0.05)。此外,HE染色结果也显示模型组与对照组的小鼠相比肝脏内脂滴蓄积明显增多。见图1。
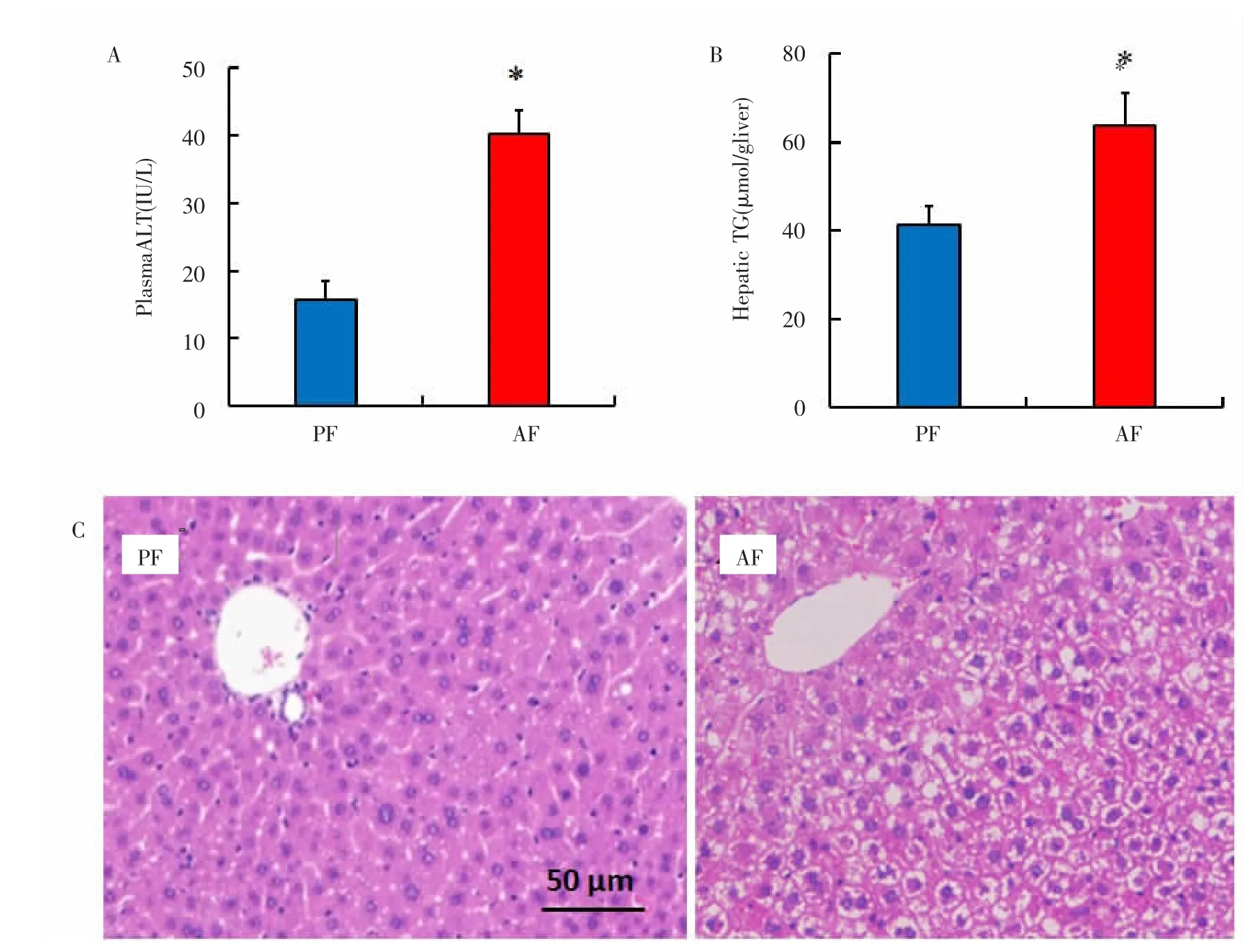
图1 长期酒精饮食导致的小鼠肝组织损伤和脂肪蓄积Fig.1 Liver tissue injury and lipopexia of mice caused by long-term alcohol diet
2.2 过量酒精摄入引起肝脏氧化损伤并抑制let-7基因的表达 酒精对小鼠肝损伤程度结果表明,AF组小鼠肝脏GSH/GSSG水平较PF组明显降低,差异有统计学意义(P<0.05)。此外,与PF组相比,AF组的总TBARS浓度显著升高,差异有统计学意义(P<0.05)。qRT-PCR结果表明,与PF组相比,AF组中6个let-7基因均有明显下调,且let-7c、let-7d和let-7g最为显著,差异有统计学意义(P<0.05)。用 200 μM H2O2处理HepG2细胞,数据显示细胞中GSH/GSSG比例下降了70%左右,差异有统计学意义(P<0.05)。与动物模型一致,H2O2处理的细胞中所有6种let-7基因的表达水平均显著低于对照组,差异有统计学意义(P<0.05)。见图 2。
2.3 过量的酒精摄入会改变可能与let-7相互作用的自噬相关标志基因表达 进一步使用Targetscan 6.2和miRanda 3.3a等生物信息学方法,分析确定了几种可能是let-7下游靶标的自噬相关标志基因,包括beclin、atg1、atg4和LC3B。然后通过qRT-PCR在ALD小鼠模型中检测其表达水平。结果表明,AF组中4种自噬相关标志基因均明显下调,差异有统计学意义(P<0.05),表明这些自噬相关基因的调节可能由于lncRNA与let-7之间相互调控作用抵消了let-7对以上基因的调控。见图3。
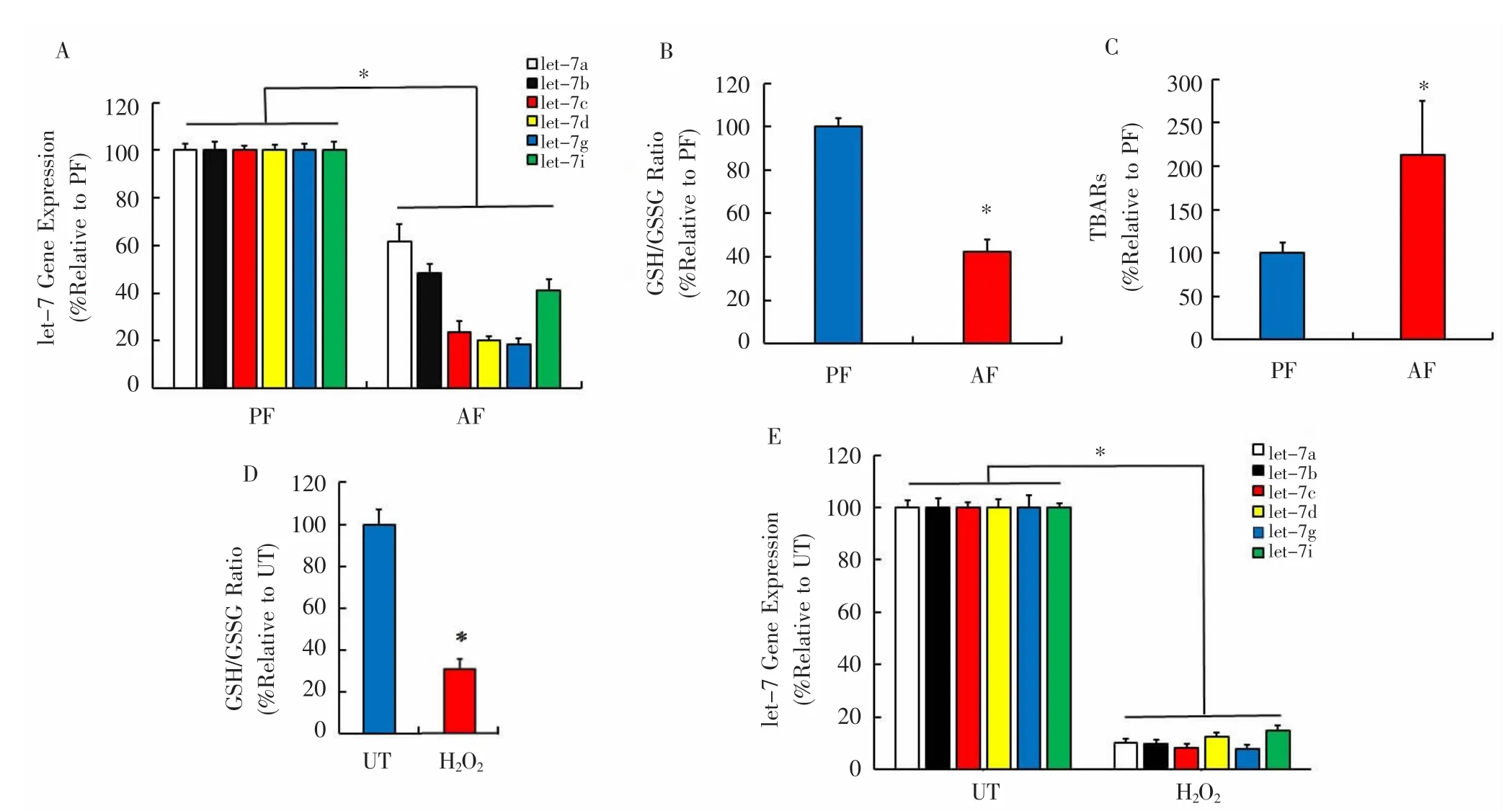
图2 长期酒精摄入后抑制let-7基因表达Fig.2 Inhibition of let-7 gene expression after long-term alcohol intake
2.4 检测可能与let-7相互作用的lncRNA表达运用Targetscan 6.2和miRanda 3.3a分析可能与let-7相互作用的lncRNA,并选出其中可能性最高的 3个 lncRNA,分别是 NONMMUT012132、NONMMUT019851和NONMMUT068425。随后用qRT-PCR定量分析小鼠肝组织中候选lncRNA的表达水平。与PF组相比,AF组小鼠的NONMMUT012132表达水平明显升高,差异有统计学意义(P<0.05),而NONMMUT019851和NONMMUT068425表达水平均有显著降低,差异有统计学意义(P<0.05)。见图4。
3 讨论
肝脏是酒精代谢的主要部位,长期的酒精摄入会导致肝细胞发生氧化应激和脂质过氧化,通过调控细胞内许多信号传导通路诱导肝细胞死亡。已有研究表明miRNA在 ALD发生发展过程中起到重要的调控作用。K.Kodys等研究表明,四周含酒精饮食导致七只小鼠miRNA的下调和两只小鼠miRNA的上调[26]。在ALD患者或大鼠ALD模型中也得到了以上结果[27-28]。Chen等最近研究显示ALD大鼠肝脏的let-7b水平仅为对照组的39%[28]。然而,let-7家族的其他成员是否参与ALD发生,且let-7的异常表达和酒精诱导的肝脏病理变化之间的关联尚不清楚。已有研究表明过量酒精消耗对正常细胞过程的破坏机制的主要包括醇脱氢酶途径,微粒体乙醇氧化酶系统和过氧化氢酶途径[29],均与氧化还原稳态的调节有关。同时,有证据表明let-7在减轻肝氧化损伤中的作用[30]。这些研究表明损伤在氧化应激状态下,ALD的发生与let-7有关。本研究的数据证实,至少有六名let-7家族成员在酒精摄入组中被下调。同时,细胞实验也证实H2O2触发的氧化应激可诱导let-7表达的失调,这表明let-7可能是受酒精影响更大的miRNA家族之一。
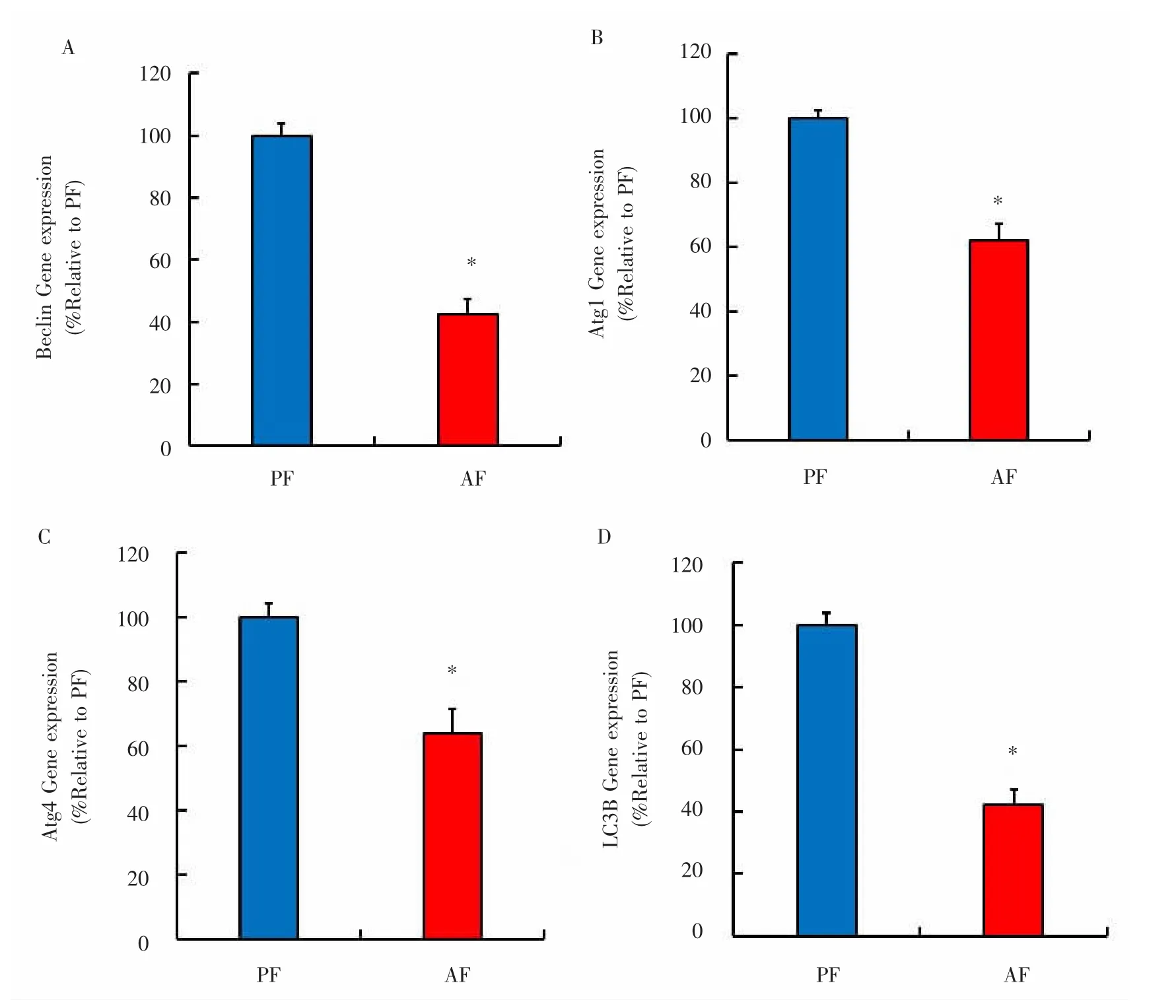
图3 过量的酒精摄入会改变可能与let-7相互作用的自噬相关生物标志基因表达Fig.3 Excessive alcohol intake alters the expression of autophagy-associated biomarker genes that may interact with let-7
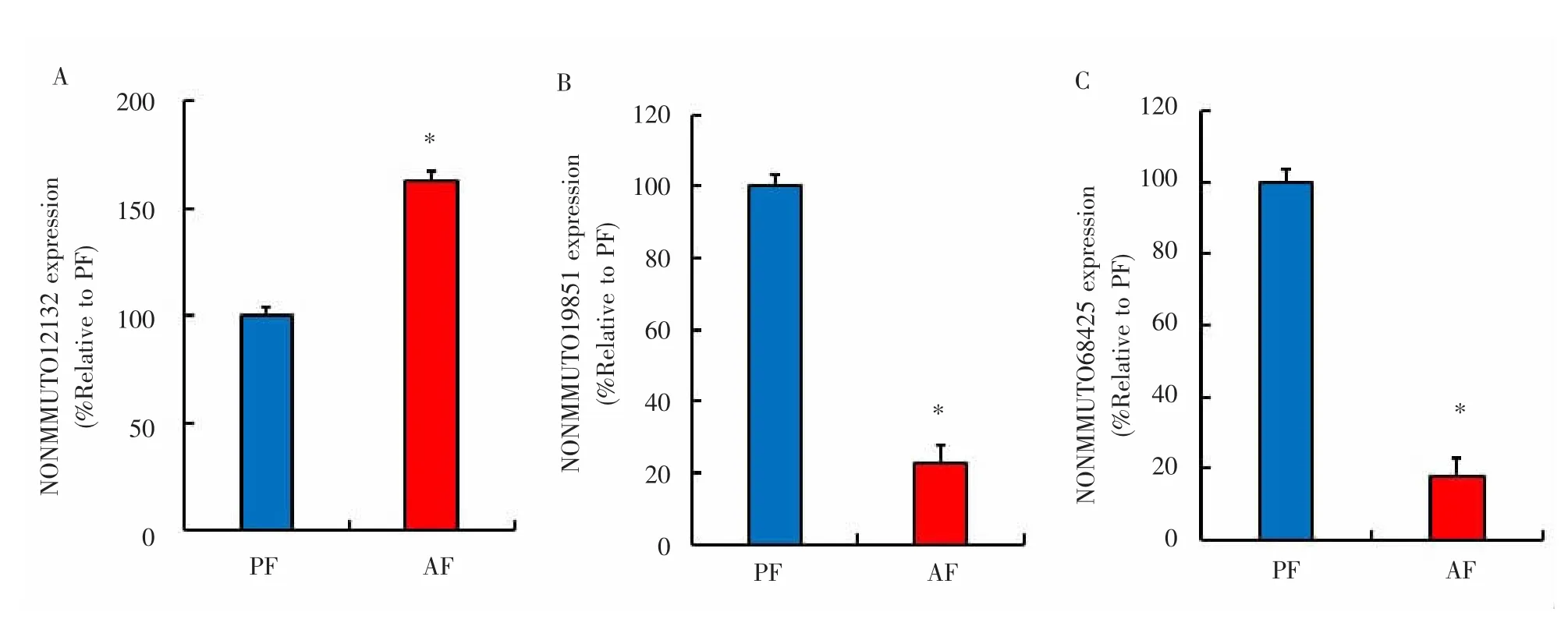
图4 与let-7相互作用的lncRNA表达Fig.4 lncRNA expression interacting with let-7
自噬涉及各种酒精诱导的病理生理学变化,如线粒体损伤和氧化损伤,已经成为ALD和其他酒精性疾病发病机理的关键因素。本研究显示let-7的下游自噬标志基因如beclin、Atg1、Atg4和LC3B在酒精摄入组小鼠中均有明显下调。虽然酒精摄入和自噬之间的确切关系非常复杂,且目前其具体机制尚不明确,但已有研究表明肝细胞自噬被慢性酒精消耗抑制[31-33],本研究结果显示酒精引起肝细胞自噬可能受let7调控。
本研究推测,let-7对自噬生物标志物的调节作用可能受到其他非编码RNA(如lncRNA)的影响。本研究发现,与let-7家族成员相互作用的3个候选lncRNA,其表达在AF处理组中表达情况有所不同。越来越多的研究表明miRNA和lncRNA之间的调节是相互的。一方面,已知lncRNA补充其靶miRNA,导致后者受抑制的mRNA去抑制。另一方面,许多lncRNA的细胞丰度由miRNA重复调控[34-35]。lncRNA的参与可能为let-7和自噬相关miRNA的同时下调提供了合理的解释。例如,NONMMUT019851和NONMMUT068425可能会抑制let-7的监管活动,因此它们的下调可能对let-7的降低水平产生补偿作用。另一种解释是,上调的NONMMUT012132可能与let-7竞争结合自噬miRNA靶标。但具体的调控机制仍需进一步研究。
综上所述,本研究表明,小鼠慢性酒精消耗能诱发肝细胞氧化损伤,而lncRNA/let-7在氧化损伤抑制的线粒体自噬过程中可能起重要作用。本研究为以let-7为靶点诊断及治疗ALD奠定了初步的试验基础。

