何首乌不同萃取部位对斑马鱼幼鱼的肝脏毒性观察
郑海洋,杨晓歌,赵崇军,孙修成,马志强,李霄
(1 北京工业大学生命科学与生物工程学院,北京100124,2 北京中医药大学中药学院)
何首乌是蓼科植物何首乌的干燥块根,主要成分包括二苯乙烯苷、蒽醌、鞣质及磷脂,生何首乌具有解毒、消痈、截疟、润肠通便的功效,用于疮痈、瘰疬、风疹瘙痒、久疟体虚、肠燥便秘的治疗[1]。制何首乌具有补肝肾、益精血、乌须发、强筋骨、化浊降脂的功效,临床上常用于血虚萎黄、眩晕耳鸣、须发早白、腰膝酸软、肢体麻木、崩漏带下和高脂血症的治疗。由于何首乌具有多种功效,在临床和民间都有广泛应用,近年来发现由于何首乌导致的肝毒性病例时有发生,引起专家和学者高度重视,有关何首乌肝毒性的研究也多见报道。古代药学著作《本草汇言》认为何首乌有微毒,现代研究[2~4]认为其毒性成分可能与蒽醌类成分有关,也有研究[5~7]表明可能与二苯乙烯苷和鞣质有关。斑马鱼作为一种模式生物,早期胚胎透明,可在显微镜下观察幼鱼器官发育情况,通过对肝脏的表型、卵黄囊吸收情况观察以及对相关酶的测定,可以对幼鱼的肝脏损伤情况作出快速评价。2018年1月15日~2018年11月27日,本研究对何首乌不同萃取部位(氯仿部位、乙酸乙酯部位、剩余水相部位)对斑马鱼幼鱼的肝脏毒性进行观察,并探讨其作用机制。
1 材料与方法
1.1 斑马鱼、斑马鱼幼鱼 AB野生型斑马鱼亲本由北京中医药大学惠赠,养殖及繁殖条件参照Zebrafish Book[8]。繁殖:前1天晚上将斑马鱼按照雌雄鱼1∶2的比例放置在繁殖盒内,雌雄鱼之间用隔板分开;第2天早上将隔板拿掉,接受自然光照,雄鱼开始追逐雌鱼,到上午10时左右,产卵受精完毕。将受精卵用灭菌后并加了培养液的净化水清洗1遍后,转移至直径15 cm的培养皿内,再置于27 ℃的培养箱内孵化,期间早晚各换水1次。选取受精后第4天、发育正常、无畸形的斑马鱼幼鱼用于后续实验。
1.2 药材、试剂及仪器 生何首乌购自北京同仁堂。二甲基亚砜(DMSO)购自天津市福晨化学试剂厂,三氯甲烷(氯仿)、乙酸乙酯、无水乙醇、盐酸、二甲苯购自北京化工厂,甲基纤维素钠购自国药集团。丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、总超氧化物歧化酶(T-SOD) 购自南京建成生物工程研究所。考马斯亮蓝蛋白测定试剂盒购自北京天根公司。Axio Observer A1荧光倒置显微镜购自德国Zeiss公司,DP70荧光倒置显微镜购自日本Olympus公司,酶标仪购自美国PerkinElmer公司,Agilent 1200高效液相色谱仪购自美国Agilent公司,电热恒温培养箱DHP-9052型购自上海一恒科技有限公司,电子天平购自瑞士Precisa公司。
1.3 何首乌不同萃取部位的萃取、制备及后续实验中给药剂量的确定 称取1 000 g生何首乌,适当破碎,用70%乙醇加热回流提取,每次1.5 h,合并3次提取液,过滤,使用旋转蒸发仪浓缩乙醇至无醇味,用氯仿和乙酸乙酯先后萃取提取液至接近无色,得到氯仿、乙酸乙酯萃取部位及剩余水相部位萃取液。将3个部位萃取液分别浓缩之后,氯仿和乙酸乙酯部位真空减压干燥,剩余水相部位冷冻干燥,即得何首乌不同萃取部位固体提取物。将斑马鱼幼鱼随机分配到12孔板中,每孔20尾,采用24 h急性毒性实验测算何首乌不同萃取部位对斑马鱼幼鱼的10%致死剂量(LC10),据此确定后续实验中何首乌不同萃取部位的给药剂量,其中氯仿部位的低、中、高给药剂量分别为3、6、9 μg/mL,乙酸乙酯部位的低、中、高给药剂量分别为10、20、30 μg/mL,剩余水相部位的低、中、高给药剂量分别为20、40、60 μg/mL。
1.4 加入高剂量何首乌不同萃取部位后斑马鱼幼鱼肝脏表型观察及肝体比、卵黄囊占比测算 将斑马鱼幼鱼随机分配到12孔板中,每孔20尾,分别记为a、b、c、d组,其中a组加入高剂量氯仿部位药液4 mL,b组加入高剂量乙酸乙酯部位药液4 mL,c组加入高剂量剩余水相部位药液4 mL,d组加入等量不添加药物的培养水。各组均置于27 ℃恒温培养箱内培养24 h后,用培养水清洗3次除去药液,将幼鱼侧位固定在涂有3%甲基纤维素钠的载玻片上,在同一光学条件,显微镜下观察各组斑马鱼幼鱼的肝脏表型,使用Image J软件进行图像处理,计算斑马鱼幼鱼肝体比和卵黄囊占比。肝体比=(肝脏面积/幼鱼身体面积)×100%,卵黄囊占比=(卵黄囊面积/幼鱼身体面积)×100%。
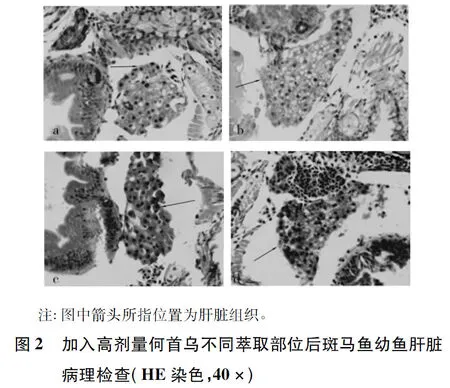
1.5 加入高剂量何首乌不同萃取部位后斑马鱼幼鱼肝脏病理学观察 斑马鱼幼鱼分组方法同“1.4”。分组后置于27 ℃恒温培养箱内培养24 h,用PBS清洗3次除去药液,将幼鱼置于已灭菌的离心管中,加入4%的多聚甲醛固定24 h,用梯度乙醇作脱水剂逐渐脱去水分,以二甲苯替换出酒精,浸蜡包埋,常规4 μm切片,脱蜡完成后苏木精染色5 min,流水冲洗,盐酸-乙醇分色10 s,自来水中浸泡20 min,再经伊红染色2 min后,脱水、透明、封固,显微镜下观察斑马鱼幼鱼肝脏病理学变化情况。
1.6 加入低、中、高剂量何首乌不同萃取部位后斑马鱼幼鱼ALT、AST、T-SOD检测
1.6.1 加入低、中、高剂量氯仿部位后斑马鱼幼鱼ALT、AST、T-SOD检测 将斑马鱼幼鱼随机分配到12孔板中,每孔20尾,设4个复孔,即每组80尾幼鱼,设A1、A2、A3、A4组,其中A1、A2、A3组分别加入低、中、高剂量氯仿部位药液,每孔4 mL,A4组加入等量不添加药物的培养水。各组置于27 ℃恒温培养箱内培养24 h后,用培养水清洗幼鱼3次除去药液,然后将幼鱼转移至称重并已灭菌的1.5 mL离心管内,将离心管置于碎冰之上,赖氏法检测各组斑马鱼幼鱼ALT、AST,羟胺法检测各组斑马鱼幼鱼T-SOD。实验重复3次,取平均值。
1.6.2 加入低、中、高剂量乙酸乙酯部位后斑马鱼幼鱼ALT、AST、T-SOD检测 选取发育正常、无畸形、受精4 d的斑马鱼幼鱼随机分配到12孔板中,每孔20尾,设4个复孔,即每组80尾幼鱼,设B1、B2、B3、B4组,其中B1、B2、B3组分别加入低、中、高剂量乙酸乙酯部位药液,每孔4 mL,B4组加入等量不添加药物的培养水。检测方法同“1.6.1”。
1.6.3 加入低、中、高剂量剩余水相部位后斑马鱼幼鱼ALT、AST、T-SOD检测 选取发育正常、无畸形、受精4 d的斑马鱼幼鱼随机分配到12孔板中,每孔20尾,设4个复孔,即每组80尾幼鱼,设C1、C2、C3、C4组,其中C1、C2、C3组分别加入低、中、高剂量剩余水相部位药液,每孔4 mL,C4组加入等量不添加药物的培养水。检测方法同“1.6.1”。
2 结果
2.1 加入高剂量何首乌不同萃取部位后斑马鱼幼鱼肝脏表型及肝体比、卵黄囊占比比较 如图1所示,c、d组斑马鱼幼鱼肝脏透明,轮廓明显,形态完整,a、b组斑马鱼幼鱼肝脏变为暗灰色,透明度降低,肝脏变大,提示肝脏出现损伤。
a、b、c、d组斑马鱼幼鱼肝体比分别为9.631%±0.011%、10.061%±0.014%、8.235%±0.010%、7.785%±0.013%,a、b组与d组相比,P均<0.05;其余组间相比,P均>0.05。
a、b、c、d组斑马鱼幼鱼卵黄囊占比分别为3.679%±1.131%、3.648%±1.388%、3.862%±1.345%、3.893%±0.601%,组间相比,P均>0.05,提示没有出现卵黄囊吸收迟延。

2.2 加入高剂量何首乌不同萃取部位后斑马鱼幼鱼肝脏病理学变化 如图2所示,与d组相比,a、b组肝细胞数量减少,并出现空泡变性及排列不规则现象,显示出肝损伤;c组无显著差异。
2.3 加入低、中、高剂量何首乌不同萃取部位后斑马鱼幼鱼ALT、AST、T-SOD水平比较 如表1~3所示,A1、A2、A3组ALT水平均显著高于A4组(P均<0.05),B1、B2、B3组ALT水平均显著高于B4组(P均<0.05),C2、C3组ALT水平均显著高于C4组(P均<0.05)。A3组AST水平显著高于A4组(P<0.05),B3组AST水平显著高于B4组(P<0.05)。A3组T-SOD水平显著高于A4组(P<0.05),B1、B2、B3组T-SOD水平均显著高于B4组(P均<0.05)。
表1 加入低、中、高剂量氯仿部位后斑马鱼幼鱼ALT、AST、T-SOD水平比较
注:与A4组相比,﹡P<0.05。
表2 加入低、中、高剂量乙酸乙酯部位后斑马鱼幼鱼ALT、AST、T-SOD水平比较
注:与B4组相比,﹡P<0.05。
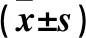
表3 加入低、中、高剂量剩余水相部位后斑马鱼幼鱼ALT、AST、T-SOD水平比较
注:与C4组相比,﹡P<0.05。
3 讨论
急性毒性实验是中药安全性评价的重要指标之一,对阐明药物的毒性作用和了解其毒性靶器官具有重要意义[9]。斑马鱼与人类基因具有较高的同源性,基因相似度达到87%,是理想的药理毒理模型[10,11]。本研究应用斑马鱼为药理模型,观察了何首乌不同萃取部位对斑马鱼幼鱼的肝脏毒性,为何首乌肝脏毒性的研究提供一定依据,也验证了斑马鱼模型作为药物毒性评价的可行性。实验结果表明,加入高剂量何首乌氯仿部位、高剂量何首乌乙酸乙酯部位后,斑马鱼幼鱼肝脏面积增大,颜色变为暗灰色,肝细胞数量减少,出现空泡变性及排列不规则现象,提示出现肝损伤。斑马鱼幼鱼发育早期阶段,幼鱼口未开,无法对外摄食,此时卵黄囊作为斑马鱼幼鱼的内源性物质为其发育提供营养物质,肝脏作为幼鱼早期发育的重要器官,如果肝脏受到一定程度的损伤,卵黄囊即会出现一定的吸收延迟,呈现膨大状态[12]。本研究中,各组卵黄囊吸收没有显著性差异,可能与给药时间较短有关,这还有待进一步的研究。
何首乌导致的肝损伤并不是单纯的一种机制导致的。研究[13,14]发现,给予大鼠口服何首乌水提物后,大鼠肝脏中细胞色素1A2(CYP1A2)或CYP2E1的活性受到显著抑制,表明何首乌导致的肝损伤可能与CYP450酶系有关系。人类肝脏CYP450酶系中至少有9种酶与药物代谢相关,而参与外源物质代谢的家族主要为CYP1、CYP2、CPY3家族,此3个家族约占人类肝脏总CYP450量的70%,在药物代谢过程中起着重要作用[15]。另一方面,Li等[16]研究表明,何首乌导致的肝损伤极有可能属于特异质肝损伤一类,即患者本身存在炎症或本身对某些药物过敏等。本研究对各组斑马鱼幼鱼的ALT、AST水平进行了测定,结果显示,A1、A2、A3组ALT水平均显著高于A4组,B1、B2、B3组ALT水平均显著高于B4组,C2、C3组ALT水平均显著高于C4组;A3组AST水平显著高于A4组,B3组AST水平显著高于B4组。综合ALT和AST指标,可见何首乌氯仿部位和乙酸乙酯部位对肝脏损伤严重,提示何首乌肝脏毒性成分存在于这2个萃取部位中。T-SOD是一种在机体氧化与抗氧化平衡过程中起着重要作用的酶,其能及时清除体内的超氧阴离子自由基,以保护细胞免受损伤,其活性的高低可反映机体的氧化应激水平[17~20]。本研究显示,B1、B2、B3组T-SOD水平均高于B4组,提示乙酸乙酯部位中的化学成分破坏了肝细胞的氧化应激平衡,导致肝细胞损伤。
综上所述,本研究发现,何首乌氯仿部位和乙酸乙酯部位对斑马鱼幼鱼具有肝脏毒性,其作用机制可能是何首乌中的毒性成分通过破坏斑马鱼幼鱼肝细胞的氧化应激平衡,进而导致肝细胞损伤,为进一步研究何首乌肝脏毒性成分提供了依据。

