Ig/TCR基因重排在儿童急性T淋巴细胞白血病中的表达模式特点
王婵娟 崔 蕾 李伟京 赵晓曦 高 超 吴敏媛 王天有 李志刚
在儿童急性淋巴细胞白血病(ALL)中,T细胞ALL(T-ALL)占10%~15%,其早期诱导死亡率高,缓解后易复发,预后明显较前体B细胞ALL差[1]。定量监测微小残留病(MRD)水平有助于精确评估ALL患儿的复发风险,指导治疗方案和化疗强度的调整,实施个体化精准治疗[2]。免疫球蛋白(Ig)和T细胞受体(TCR)合称淋巴细胞抗原识别受体,在干细胞向淋巴细胞分化过程中,Ig/TCR原先分隔的胚系基因片段V、(D)、J发生重排,所形成的连接区序列可作为肿瘤特异性的标志来追踪MRD[3]。Ig/TCR基因重排模式在T-ALL与B前体ALL中不同,T-ALL中MRD水平及其对预后的意义与B前体ALL相比也有一定的差异[4]。本研究采用欧洲BIOMED-2协作组提出的标准化Ig/TCR基因重排PCR扩增体系[5,6],对儿童T-ALL初诊时抗原受体基因重排进行检测,以获取患儿特异性Ig/TCR基因克隆性重排的基因序列信息,为检测MRD提供理论依据,并探讨了Ig/TCR基因重排情况与患儿临床特征的关系。
1 方法
1.1 知情同意和伦理 患儿家长在诊断和治疗T-ALL时签署知情同意书。本研究方案通过首都医科大学附属北京儿童医院(我院)伦理委员会审批(审批号:2019-k-99)。
1.2 病例纳入标准 ①我院2005年1月1日至2008年12月31日收治的初治T-ALL患儿;②患儿在我院生物样本库中有足量临床检查剩余的初诊骨髓样本(≥ 1×107个细胞)可行Ig/TCR基因重排及SIL-TAL1融合基因检测。
1.3 病例排除标准 ①确诊T-ALL后未按照既定方案治疗者;②入我院前曾在其他医院接受化疗者。
1.4Ig/TCR基因重排及SIL-TAL1融合基因检测
1.4.1 骨髓单个核细胞DNA的提取 抽取患儿骨髓2 mL,用红细胞裂解液(美国BD公司)分离单个核细胞,冻存于-80℃冰箱待用。采用血DNA提取试剂盒(安徽优晶生物工程有限公司)提取基因组DNA。紫外分光光度计检测提取DNA的质量并进行定量,4℃保存备用。
1.4.2 多重PCR方法扩增克隆性Ig/TCR基因重排 采用BIOMED-2协作组建议的多重PCR体系[6]扩增初诊骨髓单个核细胞基因组DNA,筛选克隆性TCRB、TCRG、TCRD和IgH基因重排,设11个平行PCR管(表1)。PCR扩增体系:12.5 μL反应体系,含5×Gold Buffer(英国AB基因公司)2.5 μL,MgCl 21.5 mmol·L-1,上下游引物各2.5 pmol,Taq DNA聚合酶(北京大学第一医院卜定方教授惠赠)0.25 U,DNA模板 100 ng。反应条件:95℃预变性7 min, 95℃变性30 s,60℃退火30 s,72℃延伸30 s,共35个循环,最后72℃延伸10 min。阴性对照为在我院血液科病房住院的非白血病患儿外周血单个核细胞提取的DNA和水。
1.4.3 PCR扩增产物分析 PCR产物经6%聚丙烯酰胺凝胶电泳和银染色,目的片段处出现单一条带且边缘清晰者为单克隆基因重排;2个条带为双等位基因或双克隆基因重排;≥3个条带考虑为寡克隆;条带边缘模糊者为多克隆;无条带或条带极弱者为阴性。目的片段大小见表1。
1.4.4 DNA序列测定及连接区分析 按1.4.2中的PCR扩增体系和条件,反应总体积扩大至50 μL,由上海生工生物工程技术服务有限公司采用ABI PRISM3730型测序仪进行纯化测序。将DNA序列输入IMGT 数据库进行序列比对(http://imgt.cines.fr),分析白血病患儿的特异性结合部位Ig/TCR重排靶基因序列。

表1 多重PCR方法扩增克隆性Ig/TCR基因重排的类型
1.4.5SIL-TAL1融合基因的检测 用Trizol试剂(美国Invitrogen 公司)按照说明书提取患儿初诊时骨髓样本中的单个核细胞总RNA,紫外分光光度计测定RNA纯度和浓度。用逆转录试剂盒(美国Invitrogen公司)将2 μg RNA反转录为cDNA。用逆转录多重巢式聚合酶链反应方法检测样本中的白血病特异性融合基因SIL-TAL1,方法和引物参照文献 [8]。
1.5 T-ALL的治疗和早期治疗反应评估 我院2005年1月1日至2008年4月1日首次入院的初诊T-ALL病例,采用我院BCH-2003 ALL方案治疗,2008年4月1日至2008年12月31日收治的初诊病例采用中国儿童白血病协作组CCLG-ALL2008方案治疗。T-ALL根据危险度评估[7]予中危或高危方案治疗。
1.6 随访 患儿停药后每半年至1年来我院随访,随访内容包括外周血细胞分析和免疫功能检查。本研究随访截止日期为2018年12月31日,根据门诊或住院病历记录判断其是否发生不良事件(包括复发、死亡、第二肿瘤),如无这些不良事件发生,通过电话随访其预后情况。①骨髓复发:第一次完全缓解后骨髓中原始及幼稚淋巴细胞≥25%。②CNS复发:初诊时无CNS受累或初诊时为脑膜白血病而之后脑脊液呈阴性的患儿,在治疗过程中脑脊液中原始及幼稚淋巴细胞>5个/μL,或完全缓解后出现颅神经损伤或脑组织受累。③睾丸白血病复发:完全缓解后组织活检提示原始或幼稚淋巴细胞浸润。④联合复发:髓外复发同时骨髓中原始及幼稚淋巴细胞≥5%。⑤长期缓解标准:患儿停药后无复发、死亡、第二肿瘤等事件的发生。
1.7 资料采集 ①患儿入院时的年龄、性别、初诊时WBC、免疫表型、融合基因SIL-TAL1的检测情况、危险度;②治疗方案及早期治疗反应;③初诊和复发时的Ig/TCR基因重排检测结果;④随访情况和预后。
1.8 统计学分析 应用SPSS16.0 for windows软件包(SPSS Inc., Chicago, IL, USA)进行分析。采用精确概率法χ2检验比较阳性组与阴性组在临床、生物学特征方面及早期治疗反应的差异。
2 结果
2.1 一般情况 共52例T-ALL儿童进入本文分析,男37例(71.2%);入院时中位年龄8.0(1.8~16.0)岁;初诊时WBC中位数140.5(2.7~667.1)×109·L-1。所有病例均经临床、骨髓形态、组织化学染色、免疫学、细胞遗传学、分子生物学确诊和分型。
中危38例(73.1%)、高危14例(26.9%)。采用BCH-2003 ALL方案治疗40例,采用CCLG-ALL2008方案治疗12例。第8 d强的松反应好39例(75.0%)、差13例(25.0%);第33 d缓解率90.4%(47/52);第33 d MRD共检测48例,<10-4为10例(19.2%)、~10-2为23例(44.2%)、 ≥10-2为15例(28.8%);第78 d MRD 共检测43例,<10-3为36例(69.2%)、 ≥10-3为7例(13.5%)。
中位随访时间为136.3(1.2~171.7)个月,长期完全缓解38例(73.1%)、 复发10例(19.2%),其他原因死亡4例(7.7%)。
52例中,SIL-TAL1融合基因阳性14例(26.9%)。
2.2Ig/TCR基因重排在儿童T-ALL中的检测情况
2.2.1 克隆性Ig/TCR基因重排的发生率 94%(49/52)儿童T-ALL中TCRB、TCRG、TCRD和IgH4种Ig/TCR基因重排至少检出1种,3例患儿4种重排均未检出,88%(46/52)至少检出2种重排。TCR基因重排中TCRB、TCRG、TCRD基因重排的发生率分别为85%(44例)、85%(44例)和38%(20例),其中27例(52%)检出3种TCR重排,44例(85%)检出2种TCR重排,5例(10%)检出1种TCR重排。TCRB和TCRG均阳性42例(81%);TCRB和TCRD均阳性、TCRG和TCRD均阳性患儿均为16例(31%)。IgH重排跨系表达阳性11例(21%),91%(10/11)的IgH重排阳性患儿同时为TCRD重排阳性,1例IgH重排阳性的患儿TCRD重排为阴性,P<0.001。
在44例TCRB重排阳性患儿中,61%(26/44)为单克隆,27%(12/44)为双克隆/双等位基因重排,12%(5/44)为寡克隆。TCRG重排中,27%(12/44)为单克隆,68%(30/44)为双克隆/双等位基因重排,5%(2/44)为寡克隆。TCRD重排中单克隆占70%(14/20),其余30%为双克隆/双等位基因重排。11例IgH重排阳性患儿中82%(9/11)为单克隆,双克隆/双等位基因重排和寡克隆各1例。
2.2.2Ig/TCR基因重排类型和胚系片段使用情况 在49例Ig/TCR基因重排阳性患儿中,共检出180种克隆性基因重排,包括66种TCRB重排、74 种TCRG重排、26种TCRD重排和14种IgH重排,见表2。
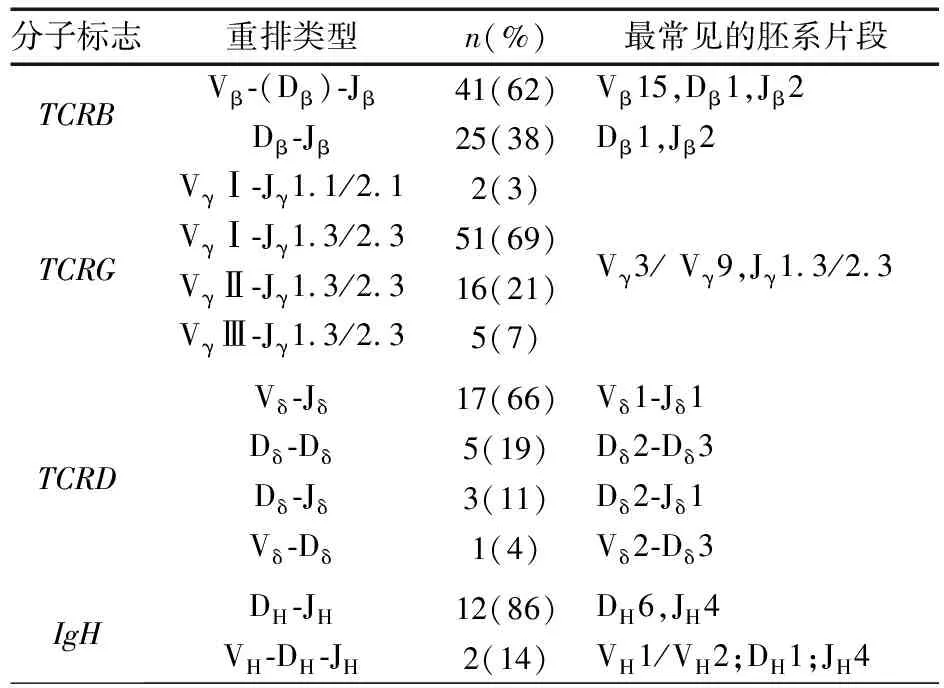
表2 Ig/TCR基因重排在儿童T-ALL中的类型和胚系片段情况
66个TCRB克隆中,完全性Vβ-(Dβ)-Jβ重排占62% (41/66),不完全性Dβ-Jβ重排占38%(25/66)。TCRB完全重排中,共检出24种Vβ片段, Vβ15、Vβ18、Vβ19、Vβ28和 Vβ7-2都较常见;D片段中Dβ1与Dβ2使用频率分别为49%和44%,有7%的完全重排未使用Dβ片段。在TCRB不完全重排中,Dβ1、Dβ2分别占52%和48%。不论是TCRB完全重排还是不完全重排,Jβ2都比Jβ1使用频繁,其中Jβ2.1、Jβ2.3和 Jβ2.7使用均较多(均为15%),其次为Jβ1. 2(14%),未发现Jβ2.4和 Jβ2.6的使用。
在检出的74个TCRG克隆中,以VγⅠ-Jγ1.3/2.3检出率最高(69%),其次为VγⅡ-Jγ1.3/2.3(21%)、VγⅢ-Jγ1.3/2.3(7%)和VγⅠ-Jγ1.1/2.1(3%)。Vγ片段中VγⅠ家族使用最频繁(72%),包括Vγ3(22%)、Vγ2(15%)、Vγ5(15%)、Vγ4(12%)、Vγ8(8%);VγⅡ家族(Vγ9)检出率为22%;VγⅢ家族(Vγ10)为6%;未检出VγⅣ家族。
检出的26个TCRD克隆中以Vδ-Jδ完全重排为主(66%),其中以Vδ1-Jδ1重排最常见(27%),检出少见的Jδ3重排2例。不完全重排Dδ2- Dδ3、Dδ2-Jδ1和Vδ2-Dδ3的发生率依次为19%、11%和4%。
14种IgH基因重排中包括12个(86%)DH-JH不完全重排和2个(14%)VH-DH-JH完全重排。DH片段使用频率最多的为DH6-19和DH7-27(均为21%),还有DH1-1、DH1-7、DH1-20、DH1-26、DH2-21、DH4-4和DH5-18等。JH片段使用频率依次为JH4(50%)、JH1(21%)、JH3(17%)、JH5 (8%)和JH6(8%),未检出JH2。
2.2.3Ig/TCR基因重排的连接区特点 表3显示,TCRDVδ-Jδ完全重排连接区插入的核苷酸数中位数为23.0 b p,Vδ3'端和Jδ5'端删除的核苷酸数中位数分别为1.5 bp和1.0 bp;TCRG重排连接区序列较小,插入核苷酸中位数为7.0 bp。TCRB完全重排与不完全重排在Dβ-Jβ连接部位核苷酸的插入和删除数目相近。IgH的完全性VH-DH-JH重排连接区插入核苷酸数(N1区中位数10.5 bp和N2区中位数14.0 bp)高于不完全DH-JH重排(中位数9.0 bp)。
2.2.4 初诊与复发时Ig/TCR基因重排模式比较 10例复发患儿中6例检测了复发时的Ig/TCR基因重排模式,4例Ig/TCR基因重排模式(基因重排类型、胚系片段使用情况及连接区序列)与初诊时完全一致,2例改变。1例复发时TCRD单克隆基因重排消失,TCRB和TCRG基因重排保持不变。另1例复发时1个TCRBDβ-Jβ不完全重排消失,另1个Vβ-(Dβ)-Jβ和TCRG重排与初诊时完全相同。
2.3Ig/TCR基因重排与T-ALL患儿临床生物学特征的关系 表4显示,TCRB基因重排阳性和阴性患儿中高危组比例分别为20.5%(9/44)和62.5%(5/8),P=0.025。TCRB或TCRG基因重排阳性患儿的第33 d缓解率为89.4%(42/44),阴性患儿为10.6%(5/8),P=0.022。TCRB或TCRG基因重排阳性患儿第78天MRD水平(≥10-3)为10.8%(4/37),阴性患儿为50.0%(3/6),P=0.045。
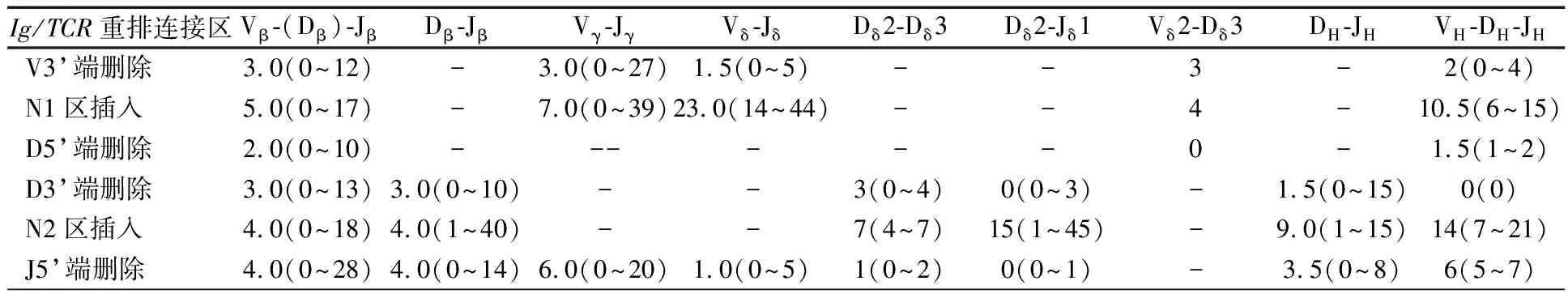
表3 Ig/TCR基因重排连接区核苷酸插入、删除情况(核苷酸中位数,bp)
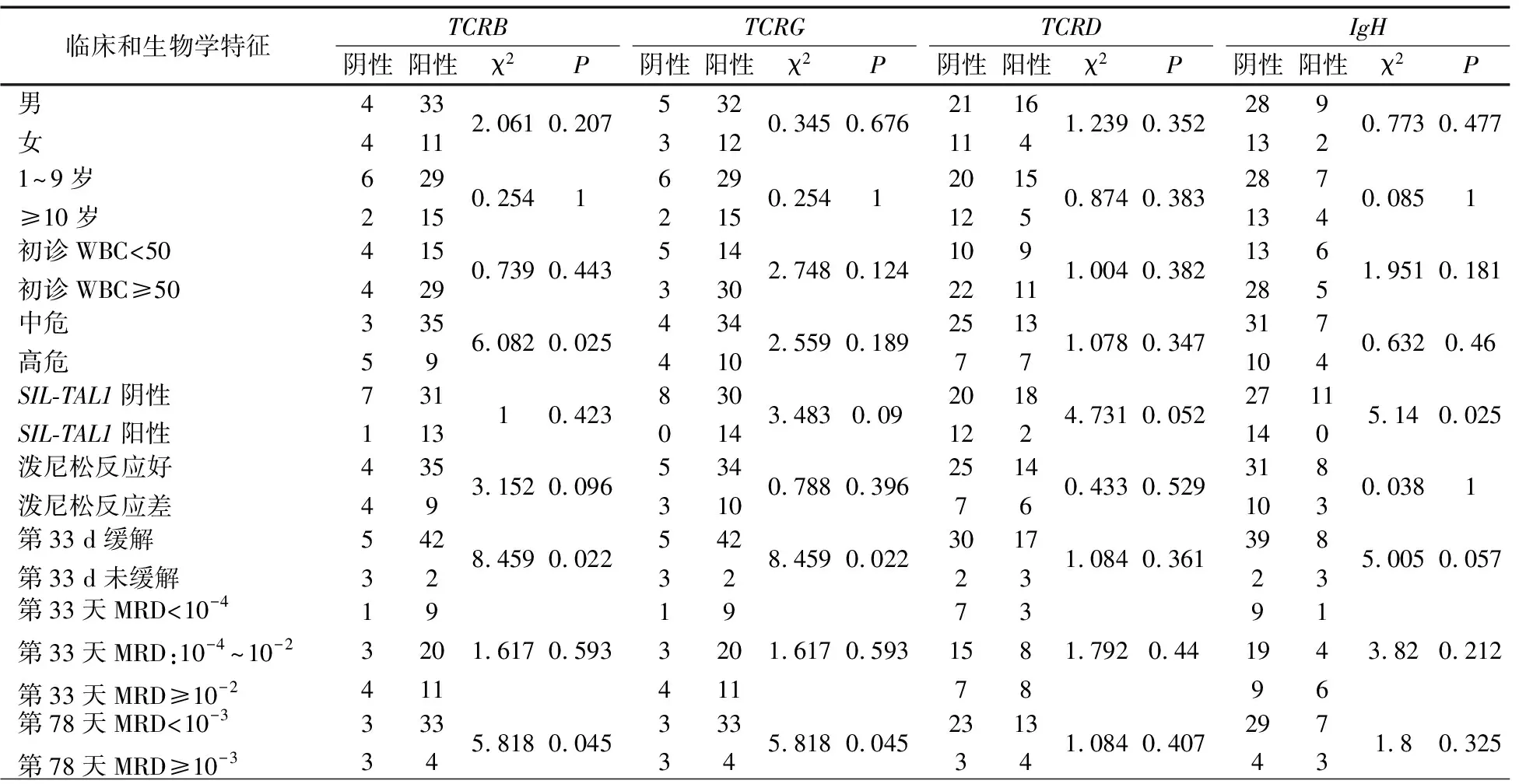
表4 儿童T-ALL中Ig/TCR基因重排与临床生物学特征的相关性(n )
SIL-TAL1融合基因阳性率在11例IgH重排阳性患儿中为0,在41例IgH重排阴性患儿中为34.1%(14/41),P=0.025。
3 讨论
在T细胞分化过程中,TCRD、TCRG基因相继发生重排并表达TCRγδ,或接下来发生TCRB重排和TCRD缺失,TCRA基因重排通常发生于T细胞发育晚期,随后可能出现TCRαβ表达[9,10]。由于胚系基因片段数量多,连接区核苷酸的随机插入与删除,导致重排后的核苷酸序列极富多样性。白血病是恶性增殖性克隆性疾病,每个患者体内的白血病细胞都具有各自特异的基因重排序列,这一特定的序列可作为该恶性克隆的分子标志[11]。TCRA的胚系基因片段数量众多,且基因重排方式复杂,一般不作为MRD监测的标志。此外,Ig家族中的IgH基因重排在T-ALL中存在跨系表达[12],而IGL和IGK则鲜有报道。因此,本研究选择TCRB、TCRG、TCRD和IgH基因重排进行检测。
TCRB基因重排不仅见于TCRαβ+T-ALL中,在多数TCRγδ+T-ALL中也可发生。本研究中TCRB基因重排在儿童T-ALL中检出率为85%,与国外报道(70%~90%)相近,胚系片段使用情况与文献一致[13]。TCRB连接区插入和删除核苷酸数目变化较大,序列多样性丰富,加上胚系片段数量众多,使得MRD检测具有较高的敏感度和特异性,90%以上T-ALL中MRD检测的定量范围可达到10-4 [14]。因此,TCRB基因重排是T-ALL MRD检测理想的分子标志。
TCRG基因重排也是T-ALL的主要标志之一,本研究中85%病例有TCRG重排,68%病例检测到2个TCRG重排,以VγⅠ-Jγ1.3/2.3重排发生频率最高(69%)。不同国家的研究对于儿童T-ALL中TCRG重排检出率为60%~90%,且重排模式也有差异。欧洲和印度的研究显示TCRG重排中以VγⅠ-Jγ1.3/2.3为主要重排类型(55%~60%),与本研究相似,而巴西报道则以VγⅡ-Jγ1.3/2.3重排最多见(46%)[15-17]。因而抗原受体基因重排在ALL中的表达模式可能存在种族和地区的差异。但是由于TCRG胚系基因种类较少,连接区多样性有限,导致在定量PCR过程中产生较高的背景扩增,降低了检测的敏感度。在一些以TCRG为标志进行MRD的研究中,只有67%的T-ALL中定量范围达到10-4,在前体B-ALL中仅为21%,因而限制了其在MRD检测中的应用[18]。TCRD基因重排主要发生于TCRγδ+ALL及未成熟T-ALL中,本研究显示TCRD以Vδ-Jδ完全重排为主,Vδ-Jδ连接区序列核苷酸插入数目较多,因而比较适于MRD的定量检测。IgH基因重排在T-ALL中以DH-JH不完全重排为主,可以作为TCR重排检测的有益补充。
本研究还对6例患儿初诊和复发时抗原受体基因重排模式进行比较,大多数保持稳定,无克隆消失,未见新增克隆。在2例患儿中,均各有1个重排消失(分别为TCRD重排和Dβ-Jβ不完全重排),考虑为该重排所代表的克隆被化疗消灭所致,也可能是发生克隆演化。这2例患儿中的其他2个基因重排均保持不变。因此在MRD检测中,对于每例患者建议同时检测至少2个Ig/TCR靶分子,以减少假阴性率[19]。
本研究还对Ig/TCR基因重排与T-ALL患儿临床生物学特征进行了分析,发现TCRB或TCRG基因重排阳性患儿的第33 d缓解率高于重排阴性患儿,第78 d MRD水平明显低于重排阴性患儿,TCRB基因重排阳性患儿中高危组比例明显低于TCRB阴性患儿。本文发现IgH重排与SIL-TAL1融合基因相关,SIL-TAL1阳性患儿均未检出IgH重排;既往本课题组研究发现,SIL-TAL1阳性T-ALL患儿具有诊断时外周血WBC水平较高、对早期强化治疗反应性较差的临床特点。
一些研究显示,Ig/TCR重排在ALL中的表达模式存在种族、地区、年龄、免疫表型和基因型的差异。欧洲BIOMED-2协作组于2003年提出标准化Ig/TCR基因重排PCR扩增体系,为不同实验室间的结果比较提供了有利条件。本文采用该体系的PCR 引物扩增Ig/TCR基因重排,绝大多数(94%)儿童T-ALL中存在至少1种Ig/TCR基因重排,88%的患儿具有两种重排。每个患儿都具有特异性的连接区序列,可作为儿童T-ALL治疗中监测MRD的指标。
综上所述,T-ALL初诊时Ig/TCR基因重排模式特点的分析显示,克隆性基因重排的胚系片段使用和连接区序列极具多样性,分析T-ALL儿童初诊时Ig/TCR基因重排的DNA序列信息,有助于进一步行MRD检测标志物的筛选。

