城镇污泥中神经酰胺的分离纯化
董 仪,朱芬芬*,张荣岩,王 鹏,陈佰灵,张冬蕊
城镇污泥中神经酰胺的分离纯化
董 仪1,朱芬芬1*,张荣岩1,王 鹏2,陈佰灵2,张冬蕊1
(1.中国人民大学环境学院,北京 100872;2.中国人民大学化学系, 北京 100872)
以A2O-MBR工艺的冷冻干燥污泥作为原料,以索氏提取法,获得污泥中的粗脂;再经硅胶柱层析,以石油醚-乙酸乙酯 100:1, 10:1和7:3 (/)的顺序梯度洗脱,利用薄层色谱法,将洗脱液与神经酰胺标准品对比,(石油醚) :(乙酸乙酯)=7:3为合适的洗脱梯度.经Q-Exactive液相色谱-高分辨质谱检测各组成成分,就峰面积比,经柱层析洗脱前后神经酰胺从60.88%提高到98.34%.最后,用另一种A2O工艺的污泥进行尝试,柱层析前后神经酰胺从79.06%提高至94.15%.
城镇污泥;神经酰胺;提取;纯化
城镇污泥是城镇污水处理厂污水处理过程中产生的副产品,随着日益严格的污水排放标准和污水处理率[1-2]的逐年提高,城镇污泥的产生量不断增长.资料显示,美国干污泥年产量约700万t[3],欧盟国家日处理污水超过3亿m3[4],年产干污泥约1200万 t,日本年产污泥干基约220万t[5].2015年,我国湿污泥(80%含水率)全年产量约3359万t(相当于干基670万t),已成为继美国之后的第二大污泥产生大国,随着新建污水处理厂增多和现有污水处理厂升级改造,这一数字还会继续快速增长,估计到2020年,全国全年城镇污水处理厂污泥(80%含水率)产量将达6170万t[6].污泥的资源化与其中的有机质息息相关,脂类是重要的有机质,在生物细胞中起着异常重要的作用,在本课题组[7]对A2O和MBR 2种市政污水处理工艺中污泥主要脂类组成的研究中,作为鞘酯中的一大类——神经酰胺(ceramide),其含量(2.82%)要远远高于其他的各种脂类的含量,是细胞脂类中资源化潜力最大的成分.
神经酰胺,即N-脂酰基鞘氨醇,是由长链鞘氨醇与脂肪酸经酰胺键缩合而成的生物活性物质,作为鞘脂类的基本构成单位之一,存在于动植物细胞中.神经酰胺具有屏障、粘合、保湿、提高免疫和防癌抗癌的功能[8-10],此外,高效保湿作用使其成为各类化妆品公司市场产品的重要有效成分,开拓了神经酰胺的应用价值.目前,神经酰胺的制造途径主要包括生物工程、有机合成和天然来源提取分离.生物工程上,利用鞘磷脂酶解法制备神经酰胺[11],或通过酵母菌株发酵制得神经酰胺[12].有机合成根据其手性源的不同,可将合成方法分为3类:以丝氨酸为起始原料构建神经鞘氨醇的立体结构;以碳水化合物作为天然手性源构建神经鞘氨醇的立体结构;以-内酰胺等作为天然手性源构建神经鞘氨醇的立体结构[11].相对于生物工程和有机合成,从自然生物中提取分离目前仍然是获取神经酰胺的主要方式[13].有研究者利用海洋生物[14]、米糠[15]、小麦[16]、魔芋[17-18]、羊毛[19]等天然来源提取神经酰胺,但植物来源的神经酰胺含量不高(0.15%~0.2%)[20-21],而且,为了得到这些原料还需要支付费用.城镇污泥中神经酰胺含量(2.82%)丰富,并且廉价又源源不断,因此污泥中神经酰胺资源化的前景引人注目.
本文以“A2O+MBR工艺混合污泥”为主要研究对象,探索“干化-索氏提取-柱层析”技术路线分离纯化神经酰胺的可行性.最后与A2O工艺污泥分离纯化神经酰胺比较,探寻处理工艺可能造成的影响.
1 材料与仪器
城镇污泥:(1)北京市某污水处理厂WWTP(Ⅰ) A2O和MBR工艺的混合污泥.(2)北京市某污水处理厂WWTP(Ⅱ) A2O工艺中来自初沉池和二沉池的混合污泥.
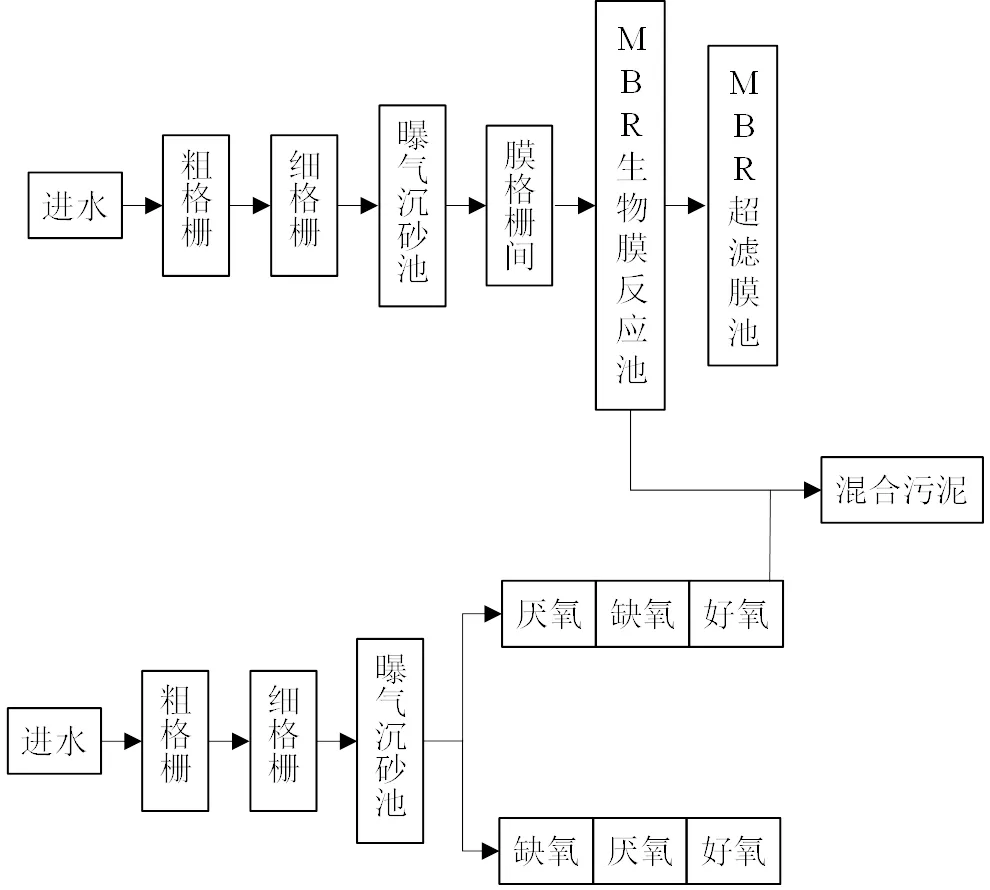
图1 污水处理厂WWTP(Ⅰ) A2O-MBR工艺流程
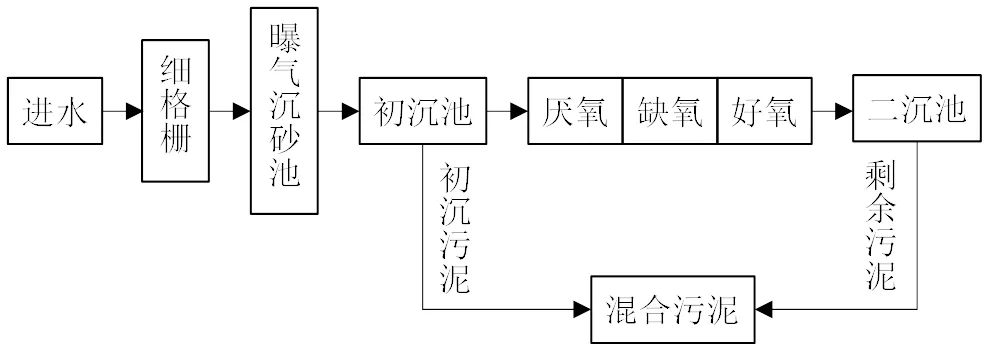
图2 污水处理厂WWTP(Ⅱ)A2O工艺流程
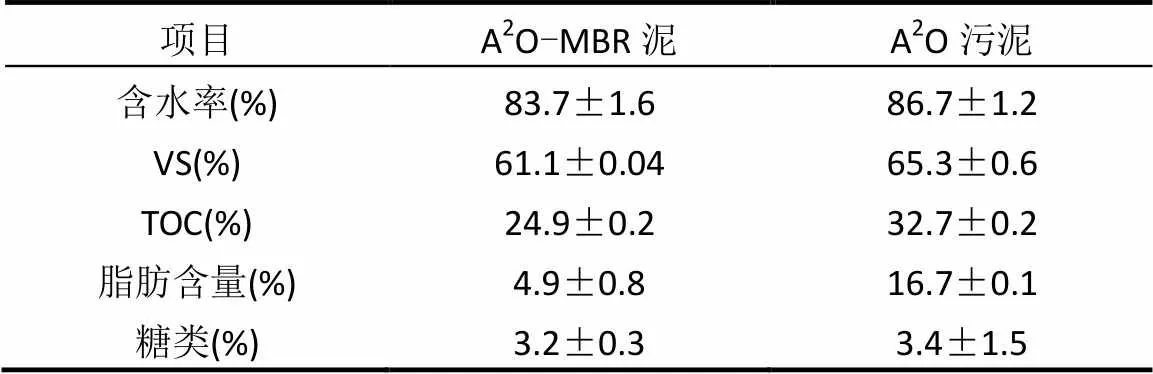
表1 污泥基本性质
正己烷(纯度³95%)、乙醇(纯度³99.5%)、石油醚(沸程60~90℃)、乙酸乙酯(纯度³99.5%)等试剂都是分析纯级别,购自北京化工厂;柱层析硅胶,200~ 300目,购于青岛海洋化工厂;HSGF254薄层色谱硅胶预制板(烟台市化学工业研究所,中国);玻璃层析柱,46´203mm(北京欣维尔玻璃仪器公司,中国); WGLL-45BE鼓风干燥箱;索式提取器,Q-Exactive液相色谱-高分辨质谱.
2 方法
2.1 泥样制备
脱水污泥经真空冷冻干燥48h后,置于振动磨上,调节振动磨时间为2min;泥样磨碎后,贮存于白色聚四氟乙烯瓶中,于4℃冰箱中备用.
2.2 提取与纯化方法
干污泥首先经索氏提取得到污泥中的粗脂,之后将粗脂置于硅胶柱中,进行梯度洗脱,将不同梯度洗脱流出液用薄层色谱(TLC)初步检测该流出液中是否含有神经酰胺.最后,对目标流出液进行Q- Exactive液相色谱-高分辨质谱(Q-Exactive UHPLC-MS)分析.
2.2.1 提取 索式提取需要的溶剂量小,操作简便,直接对萃取剂进行加热,从根本上保证了能量的快速传导和充分利用.为了获得神经酰胺粗品,首先提取城镇污泥中的粗脂.
提取率(%)=[粗脂(g)/干污泥(g)]×100% (1)
准确称取10g干泥样(精确至0.001g),置于索氏提取器中,圆底烧瓶内加入一定量的正己烷-乙醇(/,1:1),于80℃下水浴加热提取8~10h后,提取液经旋转蒸发器浓缩,得棕色膏状粗脂,提取率为(4.9±0.14)%.
2.2.2 分离纯化 粗脂经硅胶柱层析分离纯化,按顺序分别用表2中的梯度洗脱,各梯度洗脱至少5次,流速5~8mL/min.收集分离后的目标组分,得神经酰胺样品.
硅胶柱装柱时,先用石英棉、石英砂垫底,防止硅胶泄露;然后将约40g的硅胶混合于一定量的石油醚中,湿法装柱,赶出柱中所有的气泡;最后覆盖上一层厚度1cm的石英砂.
2.2.3 神经酰胺的定性检测 神经酰胺的定性检测采用薄层色谱分析(TLC分析),使用前将硅胶板置于100~105℃烘箱活化0.5~1h.用内径0.3mm毛细点样管吸取一定量的提取液,在硅胶板距底端1cm处进行点样(图3).
将神经酰胺标准品和已制好的样品在同一薄层硅胶板上点样,用合适的展开剂使初始状态位于同一位置的组分在薄层硅胶板上展开至不同的位置.标准品和样品分别使用茜素显色剂(0.1%茜素溶液)和磷钼酸显色剂(10%磷钼酸溶液),进行浸渍显色,观察结果.
分别用(1)乙酸乙酯-乙酸(100:1,/);(2)正己烷-乙酸乙酯(3:1,/); (3)氯仿-甲醇-乙酸(19:0.9:0.1,//),乙酸乙酯-乙酸(100:1,/)二次展开;(4)氯仿-甲醇(95:5,/);(5)氯仿-甲醇-乙酸(19:0.9:0.1,//)作展开剂,以磷钼酸溶液做显色剂,观察结果.
2.2.4 柱层析过程神经酰胺分析 分析采用超高效液相色谱与Q-Exactive 台式四极杆—轨道阱高分辨质谱仪结合的仪器.
液相条件:色谱柱为Cortecs C18柱(100×2.1mm,1.6μm,waters);柱温:40℃;流速: 220μL/min;进样体积:2μL;流动相:A:乙腈:水(60: 40)10mmol/L的醋酸铵,B:异丙醇:乙腈(90:10) 10mmol/L的醋酸铵,梯度洗脱.
质谱条件:离子化方式:正离子模式;喷雾电压: 3800V(正离子模式);气化温度:300℃;鞘气压(N2): 35arb;辅助气压(N2):10arb;离子传输管管温度:320℃;扫描范围:正离子/240~2000;二级质谱: 基于母离子列表的数据依赖采集(R17500).
3 结果与讨论
3.1 污泥分离纯化神经酰胺的可行性分析
3.1.1 显色剂的选择 茜素是胺类物质的专属性显色剂,磷钼酸是一般有机化合物的通用显色剂.从图3中可以看出,茜素溶液的显色效果不明显,对神经酰胺标准品不显色.用磷钼酸溶液形成的点比较清晰,重现性比较好,适合用作显色剂.
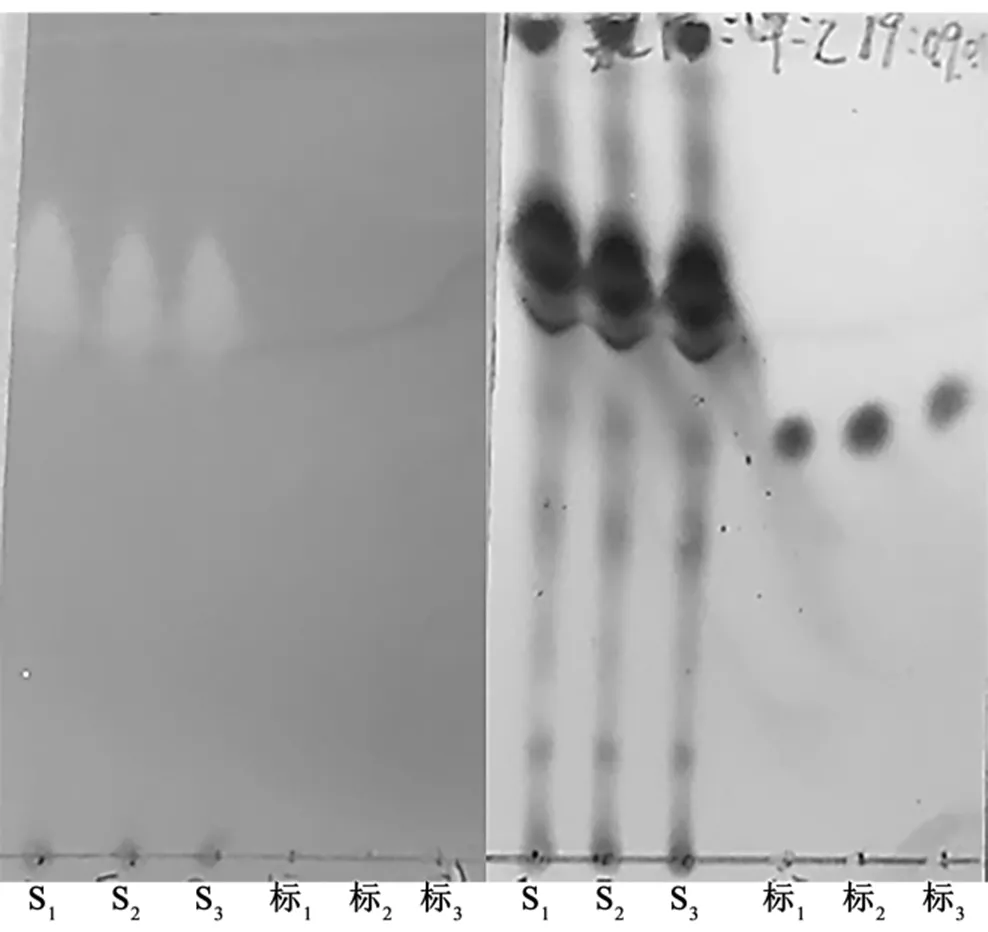
图3 显色剂的对比
左边为茜素溶液显色;右边为磷钼酸溶液显色“S”代表污泥粗脂样品,“标”代表神经酰胺标准品
3.1.2 展开剂的选择 从图4(a)中看出,乙酸乙酯-乙酸(100:1,/)、正己烷-乙酸乙酯(3:1,/)、氯仿-甲醇-乙酸(19:0.9:0.1,//),乙酸乙酯-乙酸(100:1,/)二次展开的条件下,粗脂样品中各成分并没有明显分离开,拖尾严重.在图4(b)中,相对于氯仿-甲醇-乙酸(19:0.9:0.1,//),氯仿-甲醇(95:5)作展开剂时,斑点界限更清晰,各成分的分离效果较好.
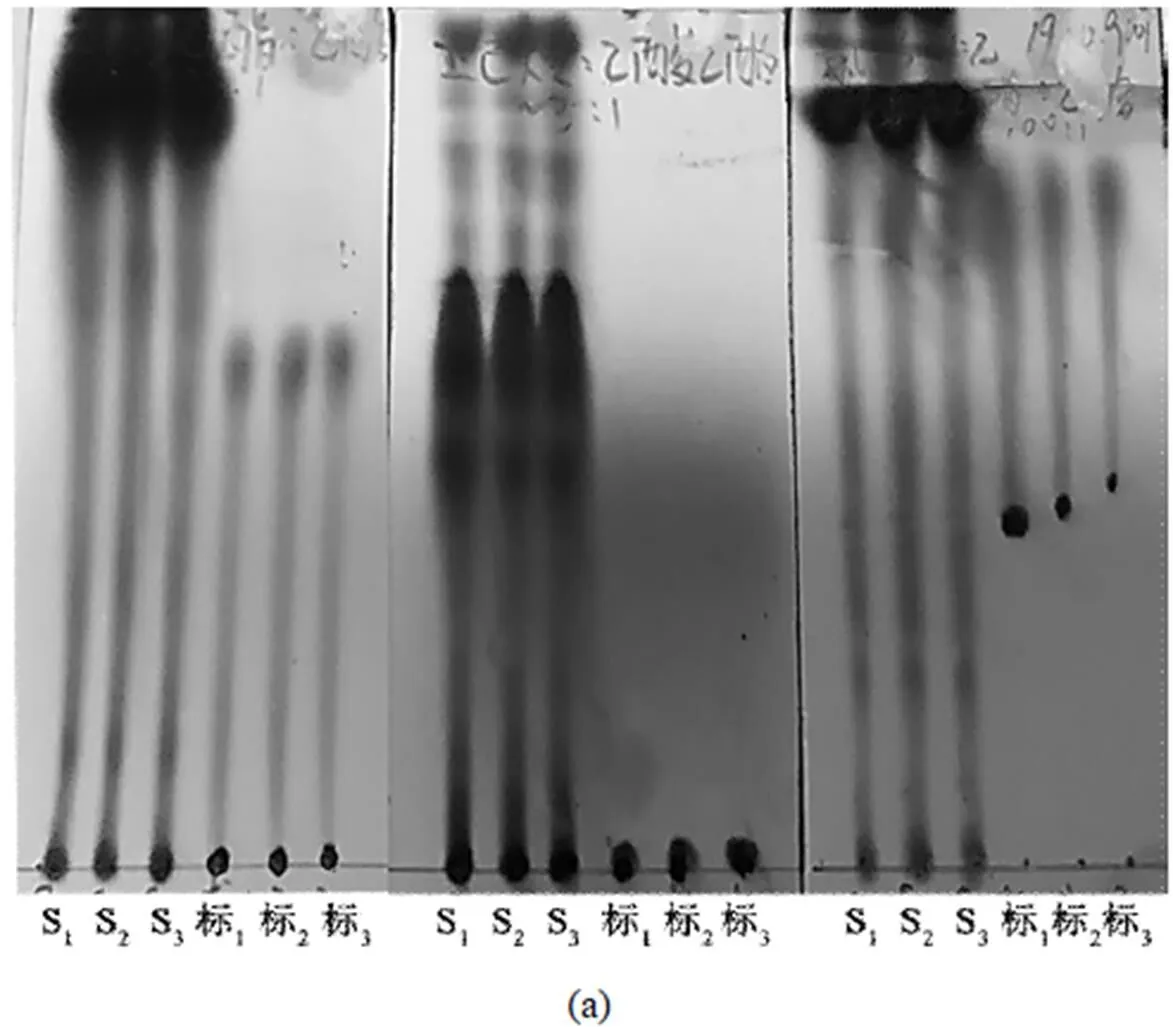
(a)从左至右分别为 (1)乙酸乙酯-乙酸(100:1,/);(2)正己烷-乙酸乙酯(3:1,/);(3)氯仿-甲醇-乙酸(19:0.9:0.1,//),乙酸乙酯-乙酸(100:1,/)二次展开;(b)从左至右分别为 (4)氯仿-甲醇(95:5,/);(5)氯仿-甲醇-乙酸(19:0.9:0.1,//)作展开剂
3.1.3 柱层析结果 柱层析时,用不同洗脱梯度的溶剂洗脱粗脂中的各种组分,用薄层色谱(TLC)检测各种组分中是否含有神经酰胺的部分.

表2 粗脂柱层析分离时的梯度洗脱顺序
注:洗脱顺序中的数字代表用1×10cm的试管承接洗脱流出液时,间隔大约50mL流出液时计数一次,并在薄层硅胶板上点样一次.
从图4(b)中可以看出有粗脂中在神经酰胺物质的极性附近包含4种成分(①②③④),和神经酰胺标准品对比后,初步判断第④种组分为柱层析分离时的目标产物.
用不同极性的石油醚-乙酸乙酯进行洗脱(表2),结果如图5所示.洗脱梯度为石油醚:乙酸乙酯 200:1, 180:1, 160:1, 140:1, 120:1和100:1 (/)时,从粗脂中分离出的组分均为弱极性物质.洗脱梯度为石油醚-乙酸乙酯80:1, 60:1, 40:1, 20:1和10:1 (/)时,洗脱出极性大小接近待分离的目标产物物质,即图4中标记的①②③成分.当石油醚-乙酸乙酯 9:1, 8:2和7:3 (/)洗脱时,从流出液中检测到目标产物.硅胶柱为正相柱,相对强极性的洗脱剂可以将样品中的弱极性物质洗脱出来,则可以将洗脱梯度简化为石油醚-乙酸乙酯100:1, 10:1和7:3 (/).

3.2 A2O-MBR工艺污泥分离纯化神经酰胺
将污水处理厂WWTP(Ⅰ) A2O-MBR工艺污泥索氏提取得到的粗脂分别经石油醚、乙酸乙酯梯度洗脱,通过薄层色谱(TLC)检测(图6),当洗脱梯度为石油醚-乙酸乙酯7:3(/)时,收集流出液.粗脂和神经酰胺产物经Q-Exactive UPLC-MS检测后的总离子流色谱图如图7所示.从原粗脂和分离提纯后产物的各组成成分峰面积比例图(图8)可以看出,神经酰胺由污泥原粗脂的(60.88±11.0)%,经柱层析后得到的分离提纯后产品提高到(98.34±0.19)%.这说明柱层析分离纯化粗脂中的神经酰胺是可行的.
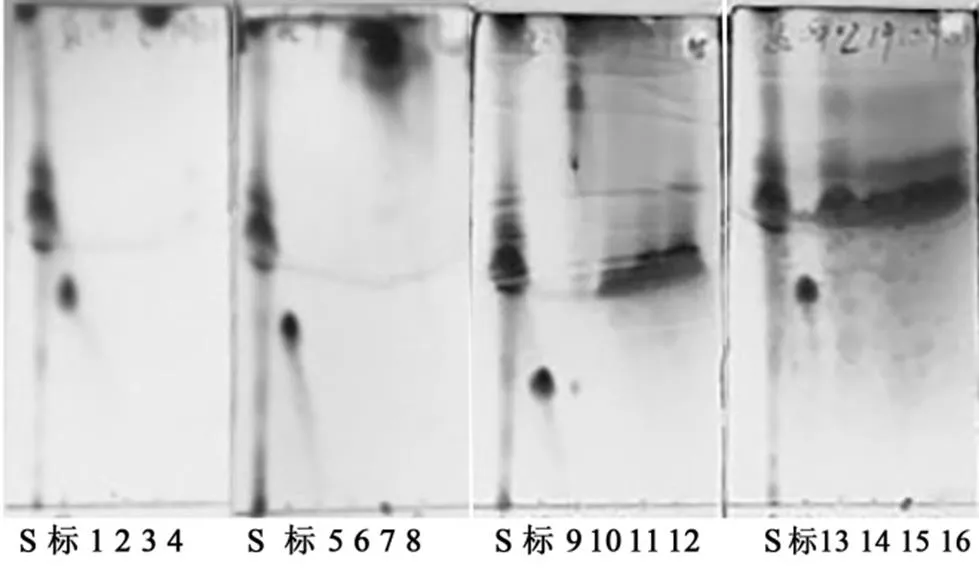
注:“S”代表污泥粗脂样品,“标”代表神经酰胺标准品,数字1~42均代表柱层析的洗脱流出液
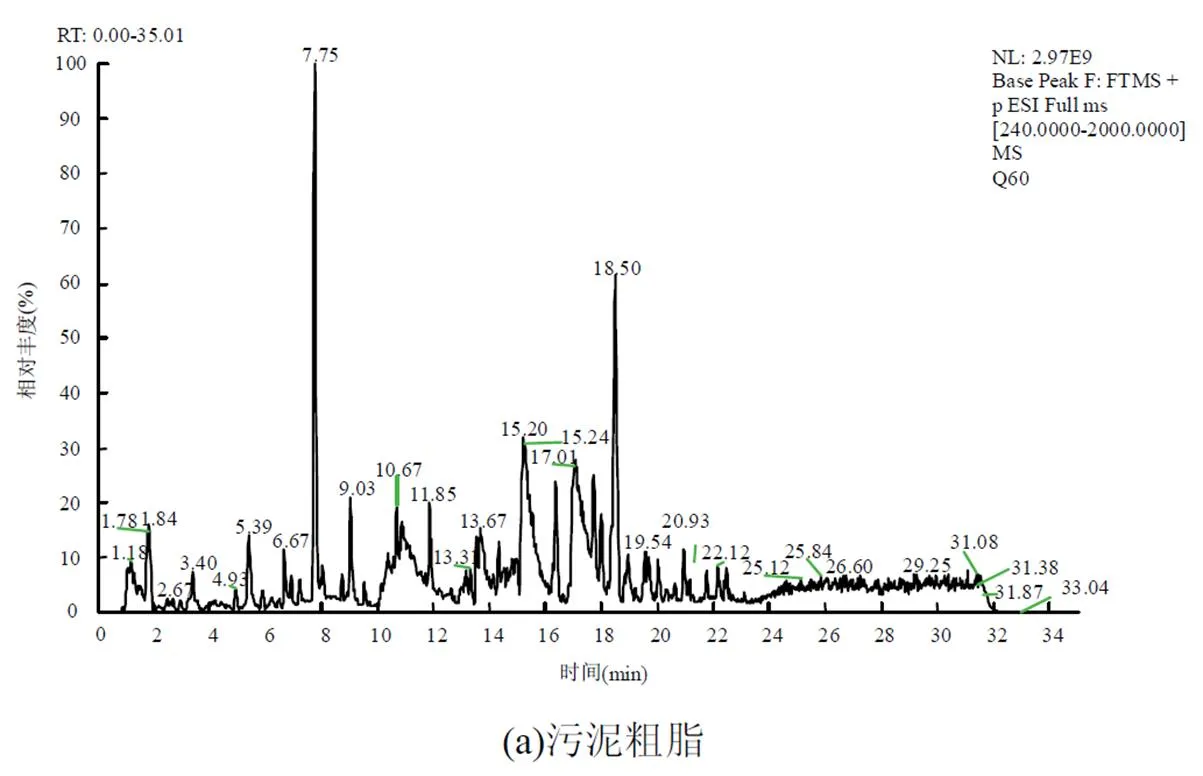
表3 脂类大致分类
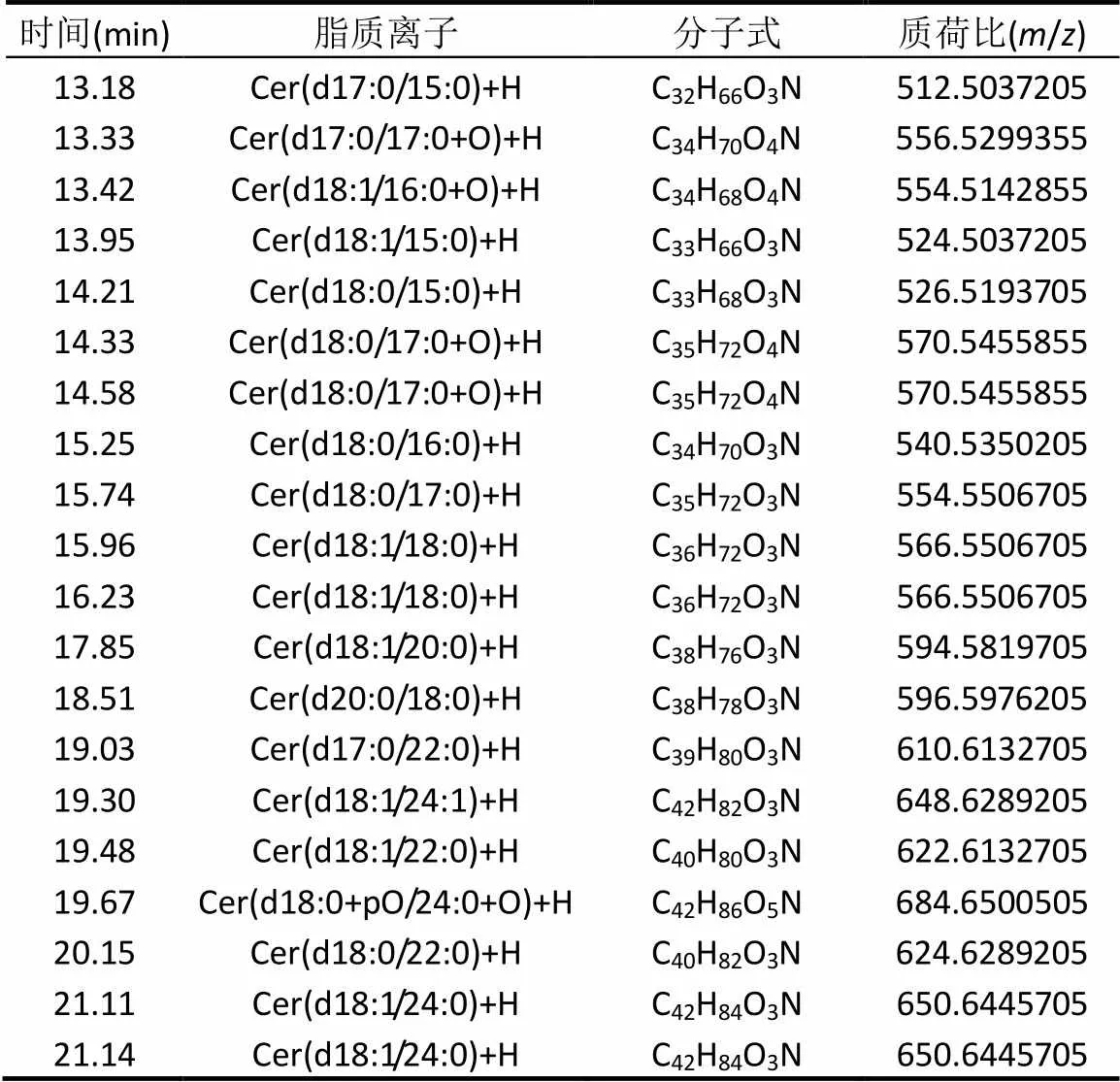
表4 神经酰胺色谱表(正离子模式)
注:表中为峰面积排列在前20的神经酰胺种类.
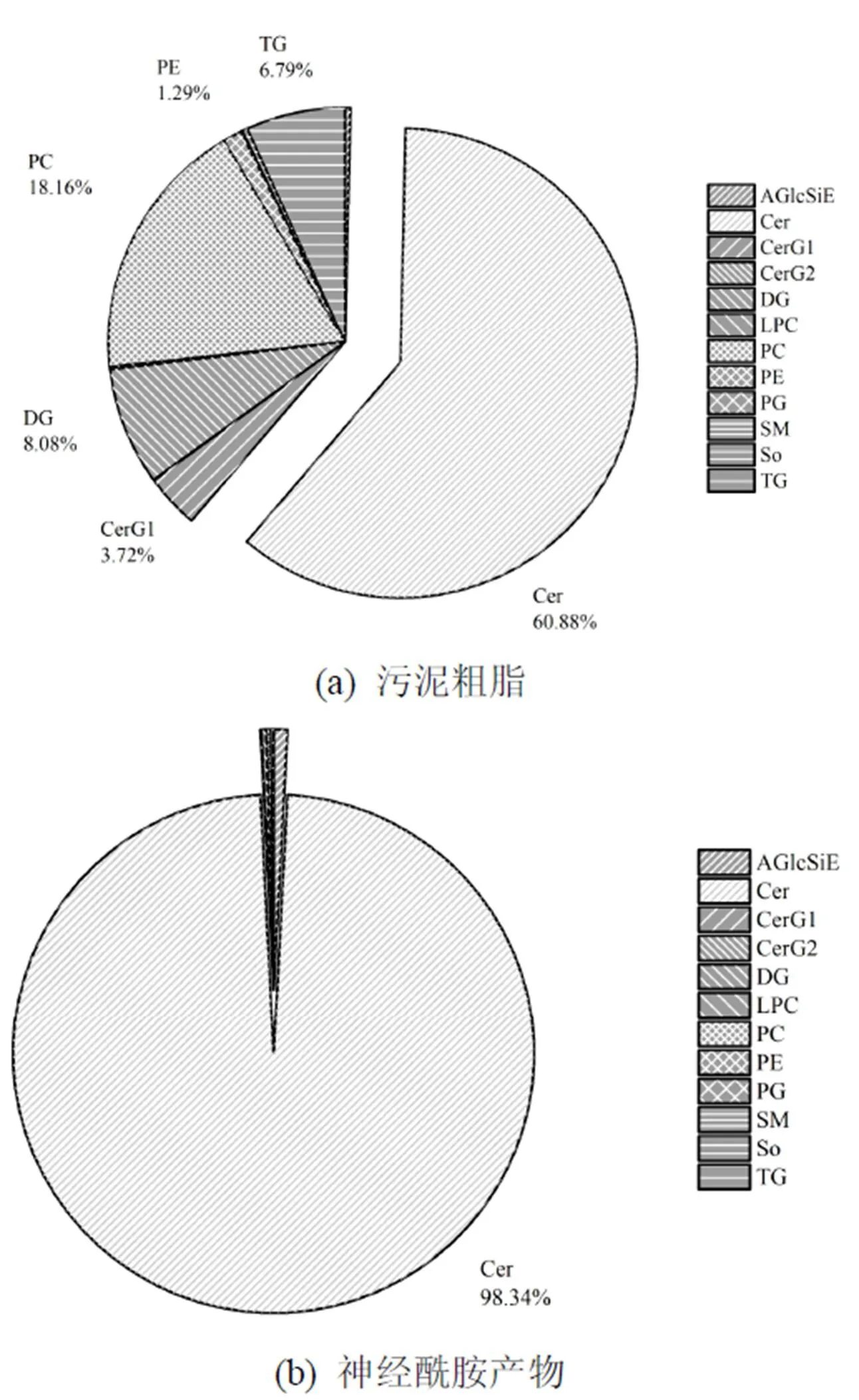
图8 WWTP(Ⅰ) A2O-MBR污泥中脂类和神经酰胺产物的各组成成分峰面积比例
3.3 A2O工艺污泥分离纯化神经酰胺
注:“S”代表污泥粗脂样品,“标”代表神经酰胺标准品,数字1~87均代表柱层析的洗脱流出液
由污泥样品(I)的分离提纯结果可知本研究使用的方法可行,所以,将该方法应用于污泥样品(II).

图10 WWTP(Ⅱ) A2O污泥中粗脂和神经酰胺产物的总离子流色谱图(正离子模式)
从图11结果可以看出,WWTP(Ⅱ)A2O污泥粗脂中神经酰胺(79.06%)更高,但是经过本文的分离提纯后的样品中神经酰胺并没有WWTP(Ⅰ) A2O-MBR污泥分离提纯后高.这可能是2个污泥样品中各种成分来源有区别导致的.由图1工艺流程图可以看出WWTP(Ⅱ)A2O污泥由2部分组成—初沉池污泥和二沉池污泥,初沉池污泥主要来源于污水中的悬浮颗粒(大部分为有机颗粒)以及颗粒上吸附的成分,二沉池污泥则主要由生物池(A2O中好氧池的微生物)组成;而WWTP(Ⅰ)A2O-MBR污泥,因为污水处理工艺没有初沉池,其来源则只有MBR池中的微生物以及一些被微生物絮体包裹拦截的一小部分污水中的悬浮颗粒.所以从来源来说,A2O- MBR污泥的成分会相对单一一些,所以分离纯化后能得到更高的神经酰胺.同时,也说明本研究的分析提纯方法针对不同污水处理工艺还有提升空间.

图11 WWTP(Ⅱ) A2O污泥中脂类和神经酰胺产物的各组成成分峰面积比例
4 结论
4.1 通过索氏提取-硅胶柱层析法,实现城镇污泥中神经酰胺的分离纯化是可行的.以A2O-MBR污泥为例,过程如下:(1) 80℃下,索氏提取污泥粗脂,提取剂为正己烷-乙醇1:1(/);(2)对粗脂进行柱层析洗脱.且石油醚-乙酸乙酯7:3()洗脱时获得最多的神经酰胺.正己烷、乙醇作为提取剂,石油醚、乙酸乙酯作为洗脱剂,安全性较高.
4.2 不同来源污泥的成分会影响神经酰胺分离提纯结果.A2O-MBR污泥成分相对A2O污泥更单一,分离纯化后能得到更高的神经酰胺.该方法针对不同污水处理工艺还有提升空间.
4.3 索氏提取-硅胶柱层析法分离纯化神经酰胺,其经济可行性还需要通过技术优化以及放大试验后论证.有可能使得成本过高的原因有以下几点:污泥干化和索氏提取时的能耗,以及提取溶剂、柱层析洗脱剂的物耗.对应可做以下优化以降低成本,尝试使用湿污泥直接索氏提取,优化索氏提取的工艺参数(如时间、固液比)、试剂回收再利用等.
[1] 高旭阔,张 迪.考虑环境因素的城镇污水处理投资效率——基于三阶段DEA的方法[J]. 中国环境科学, 2018,38(9):3594-3600. Gao X K, Zhang D. Efficiency evaluation of the investment in urban sewage treatment via the three stage DEA method considering environmental factors [J]. China Environmental Science, 2018,38(9): 3594-3600.
[2] 崔建鑫,赵海霞.城镇污水处理设施空间优化配置研究[J]. 中国环境科学, 2016,36(3):943-952. Cui J X, Zhao H X. Method for spatial optimal allocation of urban sewage treatment facilities [J]. China Environmental Science, 2016, 36(3):943-952.
[3] Dufreche S, Hernandez R., French T, et al. Extraction of lipids from municipal wastewater plan microorganisms for production of biodiesel [J]. Journal of the American Oil Chemists Society, 2007,84(2):181- 187.
[4] Eurostat. Sewage sludge production and disposal from urban wastewater (in dry substance (d.s)) [EB/OL]. https://ec.europ-a.eu/ eurostat/web/products-datasets/-/ten00030.
[5] Zhu F F, Takaoka M, Wang H C, et al. Sewage sludge disposal and recycling trends in japan [J]. China Water & Wastewater, 2012,28(11): 102-104.
[6] 戴晓虎.我国城镇污泥处理处置现状及思考[J]. 给水排水, 2012, 48(2):1-5. Dai X H. The current state and consideration on urban sewage sludge disposal in China [J]. Water & Wastewater Engineering, 2012,38(2): 1-5.
[7] Zhu F F, Wu X M, Zhao L Y, et al. Lipid Profiling in Sewage Sludge [J]. Water Research, 2017,116:149-158.
[8] Urubauer U, Feingold K R., Elias P M. Relationship of epidermal lipogenesis to cutaneous barrier function [J]. Journal of Lipid Research, 1987,28(6):746-752.
[9] Hannun Y A, Bell R M. Functions of sphingolipids and sphingolipid breakdown products in cellular regulation [J]. Science, 1989, 234(4890):500-507.
[10] Merrill J A, Schmelz E M, Wang E, et al. Role of dietary sphingolipids and inhibitors of sphingolipid metabolism in cancer and other diseases [J]. Journal of Nutrition, 1995,125(6Suppl):1677S-1682S.
[11] Zhang L, Hellgren L I, Xu X. Kinetic study of sphingomyelin hydrolysis for ceramide production [J]. Journal of Molecular Catalysis B Enzymatic, 2008,51(3):93-99.
[12] Kwun K H., Lee J H, Rho K H, et al. Production of ceramide with saccharomyces cerevisiae [J]. Applied biochemistry and biotechnology, 2006,133(3):203-210.
[13] 刘希望.神经酰胺类似化合物的合成及其生物活性研究[D]. 杨凌:西北农林科技大学, 2010. Liu X W. Synthesis of ceramide analogs and study of their bioactivities [D]. Yangling: Northwest A & F University, 2010.
[14] 刘静雯,李 健,马亚瑞,等.一种从海洋球石藻中提取神经酰胺的方法:中国, CN108017554A [P]. 2018. Liu J W, Li J, Ma Y R, et al. A method for extracting ceramide from marine coccidian, China, CN108017554A [P]. 2018.
[15] Sahoo M R, Varma S R, Patel N K, et al. In vitro anti-inflammatory and skin protective properties of extract comprising ceramides from de-oiled rice bran [J]. Journal of Food Biochemistry, 2017,41.
[16] Cui S H, Kun M A, Zhao Y N, et al. Extraction and structure analysis of a species of ceramide from wheat powder [J]. Science & Technology of Food Industry, 2011,32(2):79-78.
[17] 李玮滋,李 献.一种从魔芋中高效提取神经酰胺的方法:中国, CN108623492A [P]. 2018. Li W Z, Li X. A highly efficient method for extracting ceramide from konjac: China, CN108623492A [P]. 2018.
[18] 王兴林,侯秋红.魔芋飞粉中神经酰胺的提取分离方法:中国, CN103755583A [P]. 2014-04-30. Wang X L, Hou Q H. Extraction and separation of ceramide from konjac flying powder: China, CN103755583A [P]. 2014-04-30.
[19] Coderch L, Fonollosa J, Martí M, et al. Extraction and analysis of ceramides from internal wool lipids [J]. Journal of the American Oil Chemists Society, 2002,79(12):1215-1220.
[20] 周秀秀,丁亚平,徐乐乐,等.花魔芋中三种功能性成分联产分离工艺[J]. 天然产物研究与开发, 2017,29(7):1224-1229. Zhou X X, Ding Y P, Xu L L, et al. Joint producing technology of three function ingredients from konjac [J]. Natural Product Research and Development. 2017,29(7):1224-1229.
[21] 李海池,马晋芳,史庆龙,等.超临界CO2萃取-分子蒸馏提取分离磨芋神经酰胺[J]. 中药材, 2017,40(10):2401-2405. Li H C, Ma J F, Shi Q L, et al. Supercritical CO2extraction-molecular distillation extraction for ceramide of koniac [J]. Journal of Chinese Medicinal Materials, 2017, 40(10):2401-2405.
[22] Qi J J, Zhu F F, Wei X, et al. Comparison of biodiesel production from sewage sludge obtained from the A(2)/O and MBR processes by in situ transesterification [J]. Waste Management, 2016,49(4):212-220.
致谢:本实验神经酰胺的超高效液相色谱与Q Exactive台式四极杆——轨道阱高分辨质谱检测工作由清华大学代谢组学平台协助完成,在此表示感谢.
Preliminary study on extraction and purification of ceramide in sewage sludge.
DONG Yi1, ZHU Fen-fen1*, ZHANG Rong-yan1, WANG Peng2, CHEN Bai-ling2, ZHANG Dong-rui1
(1.School of Environment & Natural Resources, Renmin University of China, Beijing 100872, China;2.Department of Chemistry, Renmin University of China, Beijing 100872, China)., 2019,39(5):2063~2070
Using the freeze-dried sludge of A2O-MBR process as raw material, we firstly obtained the crude lipid in the sludge by Soxhlet extraction. Then the crude lipid was eluted in a sequence of petroleum ether-ethyl acetate 100:1, 10:1 and 7:3 () by silica gel column chromatography. Compared the eluent with ceramide standard by thin layer chromatography, it was proved that the appropriate elution gradient was petroleum ether-ethyl acetate 7:3 (). Through Q Exactive bench quadrupole orbitrap high-resolution mass spectrometry, the peak area ratio of ceramide was increased from 60.88% to 98.349% in the process of column chromatography. When the sludge of A2O process was used as raw material in the same experiment, the peak area ratio of ceramide was increased from 79.06% to 94.15%.
sewage sludge;ceramide;extraction;purification
X703
A
1000-6923(2019)05-2063-08
董 仪(1993-),女,湖北咸宁人,硕士,研究方向为固体废弃物处理处置.发表论文2篇.
2018-10-29
北京市自然科学基金资助项目(8172029)
*责任作者, 副教授, zhufenfen@ruc.edu.cn

