冬季黄渤海DMS、DMSP和CH4的分布及影响因素
谭丹丹,张洪海,2,翟 星,高旭旭,杨桂朋,2,3*
冬季黄渤海DMS、DMSP和CH4的分布及影响因素
谭丹丹1,张洪海1,2,翟 星1,高旭旭1,杨桂朋1,2,3*
(1.中国海洋大学化学化工学院,山东 青岛 266100;2.青岛海洋科学与技术国家实验室,海洋生态与环境科学功能实验室,山东 青岛 266237;3.中国海洋大学海洋化学研究所,山东 青岛 266100)
于2017年12月~2018年1月现场测定了黄、渤海表层海水中二甲基硫(DMS)、二甲巯基丙酸内盐(DMSP)以及溶解甲烷(CH4)的含量,对DMS、DMSP及CH4的浓度分布和相互关系进行了研究.通过培养实验探究了DMSP降解对DMS和CH4生成的影响,并估算了DMS及CH4的海-气通量.结果表明,表层海水中DMS、DMSPd、DMSPp及CH4的平均浓度分别为(1.39±1.21),(2.87±1.54),(5.59±4.64),(6.91±2.77)nmol/L.DMS、DMSP与Chl-a水平分布基本一致,均呈现近岸高、远海低的趋势.垂直分布上,DMS、DMSP浓度最大值均出现在浅水层,而CH4浓度则随深度的增加而增大,至底层达到最大值.相关性分析表明,DMS、DMSPp与Chl-a存在显著的正相关关系,CH4与DMSPd、DMSPp浓度均存在一定的正相关性(<0.05).培养实验结果表明,海水中本底DMSPd的浓度越高,DMS的生产速率越大.冬季黄、渤海DMS和CH4海-气通量的平均值分别为(2.73±3.18),(8.14±7.68)μmol/(m2⋅d),表明冬季黄、渤海是大气中DMS、CH4重要的源.
二甲基硫;二甲巯基丙酸内盐;甲烷;黄海;渤海
二甲基硫(dimethylsulfide, DMS)是海水中最重要的一种可挥发性生源有机硫化物,其向大气中的排放量约占全球海洋硫释放量的2/3[1],是参与全球硫循环的重要物质.DMS由海水释放到大气中后,氧化生成甲基磺酸盐(MSA)和二甲亚砜(dimethylsulfoxide, DMSO)等,并进一步生成非海盐硫酸盐(nss-SO42-)气溶胶,后者是大洋海区云凝结核(CCN)的重要来源,从而对全球气候产生重要影响[2].此外,这些氧化产物大多具有较强的酸性,是酸雨的重要贡献者,因而有关DMS的来源与分布、通量与循环的研究对于更深入了解全球硫循环及气候变化具有重要意义.
二甲巯基丙酸内盐(dimethylsulfoniopropionate, DMSP)是DMS的重要前体物质,为藻类的一种硫代谢产物.DMSP主要由海洋植物产生,海洋中的微藻、大型藻类和盐生植物都是其重要来源,但不同种类的藻体细胞中DMSP的含量差异明显[3].海水中一部分的DMSP可以被某些藻类或细菌释放的DMSP裂解酶裂解成为DMS和丙烯酸[4],所以DMSP的含量及转化途径直接影响着DMS的生产与分布,在DMS的生物地球化学过程中具有重要的作用.
甲烷(CH4)是大气中的一种微量气体,对温室效应有重要贡献,同时对平流层和对流层化学也有重要影响[5].海洋作为大气CH4的重要自然源,每年向大气输送5~50Tg CH4,约占全球释放总量的1%~ 10%[6-7].传统认为CH4的生成过程是在以微生物为媒介的严格厌氧和高度还原环境下的反应过程,但是近年来,在开阔大洋和陆架海区发现的表层海水过饱和状态和混合层CH4的极大值现象[8-9]引起了海水中CH4生成的争论,科研工作者们也在积极寻找富氧环境下CH4可能产生的途径.Damm等[10]发现藻华时期叶绿素-a(Chl-a)和CH4浓度有显著的正相关关系,并且假设甲基化合物如DMSP可能是产CH4的基质;Zindler等[11]的研究也发现,在贫营养的西太平洋,DMSP和DMSO都可能是CH4产生的潜在基质.众多证据显示,甲基化合物的分解可能是水体中CH4好氧产生的潜在途径.
本文选取中国近海黄、渤海为重点调查区域.黄海和渤海二者相连,是西北太平洋陆架边缘海的一部分.渤海的水文条件主要受近岸河流输入和渤海环流的影响,黄海则受到黄海暖流、对马暖流、江苏沿岸流及黑潮水等的综合影响,这些综合作用必将影响到DMS、DMSP和CH4在黄海中的分布,并使其具有明显的季节变化特征.目前国内学者杨桂朋[12-14]、胡敏等[15]对中国近海中DMS、DMSP水平分布、垂直分布以及与海区内生物环境因子之间的相关关系进行了系统研究,张桂玲等[16-18]对中国近海不同海域中溶存CH4的分布、通量、产生及释放等进行了较系统的探究.这些科研成果对深入了解中国近海二甲基硫化物及CH4的生物地球化学过程奠定了坚实的基础.然而目前对二甲基硫化物与CH4的研究相对独立,较为缺乏对两者在浓度分布及生产释放方面的联系相关的研究.因此,本文对黄、渤海中DMS、DMSP、CH4的浓度分布特征及其与生态环境因子之间的关系进行了较为系统的研究,并通过培养实验重点探讨了DMSP降解对DMS和CH4生成的影响.此外,定量估算了调查海域DMS及CH4的海-气通量.本研究对于更好地认识中国近海生源硫化物(DMS、DMSP)及CH4的生产、分布及迁移转化过程提供参考.
1 材料与方法
1.1 样品采集
于2017年12月18日~2018年1月11日随中国海洋大学“东方红2号”科学考察船对黄、渤海海域进行现场调查(图1),共包括75个大面站位.每站均采集表、底层海水样品,在35°N断面各站点采集了不同深度的垂直样品.

图1 2017年冬季黄、渤海海域调查站位
☆表示同时采集培养样品站位
海水样品由12L Niskin采水器采集,现场海水温度、盐度和水深由直读式温盐深仪CTD装置获得.因为DMS易挥发且易受生物活动的影响,为减少误差对其进行现场测定.对于DMSP样品,取4mL海水样品用内置Whatman GF/F玻璃纤维滤膜(直径47mm)的Gelman过滤器进行重力过滤,滤液装入5mL聚丙烯离心管中,后加入40µL 50% H2SO4固定(用来除去海水样品中存在的DMS[19]),即为溶解态DMSP(DMSPd)样品;另外,取4mL海水样品直接装入5mL的离心管中,加入40µL 50% H2SO4固定,用于测定总DMSP(DMSPt)含量;对于CH4样品,在采样前先用海水冲洗样品瓶3次,然后将乳胶管插入样品瓶底部慢慢注入海水,避免产生气泡和漩涡.待海水溢出约瓶体积的一半后,缓慢抽出乳胶管,加入1mL饱和HgCl2溶液抑制微生物活动,用带PTFE衬层的橡胶塞和铅帽将样品瓶密封.除DMS现场测定外,其它样品均在4℃下密封避光保存,待返回实验室后尽快分析测定.
1.2 分析方法
1.2.1 DMS测定 DMS样品采用吹扫-捕集气相色谱法测定[20-21].用5mL玻璃注射器取2mL样品注入到10mL干燥的顶空样品瓶中,在高纯氮气的吹扫下将其中的DMS吹出,经过Nafion干燥器干燥后通过六通阀富集于浸在液氮中的1/16Teflon捕集管中;吹扫3min后将捕集管立即放入热水(90℃)中进行加热解析,在载气(氮气)携带下进入配有火焰光度检测器的气相色谱仪(岛津GC-2014)进行分析测定.
1.2.2 DMSP测定 对于DMSP样品的测定, DMSP在碱性条件下(pH³13)可以转化成为DMS,然后通过测定DMS的含量,来间接得到DMSP的含量,其中颗粒态(DMSPp)的浓度由DMSPt减去DMSPd的浓度获得.测定时,取2mL DMSPt和DMSPd样品于10mL顶空样品瓶中,分别加入200µL 10mol/L的KOH溶液,密封后避光冷藏(4℃)反应24h,保证DMSP完全转化为DMS,测定其中DMS的量.
1.2.3 CH4测定 海水样品中CH4采用吹扫-捕集气相色谱法测定[22].海水样品经高纯氦气吹扫,吹扫气体首先进入装填有无水高氯酸镁的干燥管中除去水蒸气,随后进入填有Porapark-Q (80/100目)填料并置于液氮中的不锈钢吸附管中富集5min,待富集结束,将吸附管迅速加热到100℃解析,被吸附的CH4经解析后进入配有FID检测器的气相色谱(安捷伦GC-7890A)中测定.由于FID检测器的响应信号与CH4浓度之间有良好的线性关系,故采用同一浓度不同体积的多点校正法建立色谱峰面积与CH4浓度的线性关系,然后根据待测样品校正空白后的色谱峰面积,利用标准曲线进行校正.本方法的检出限为0.06nmol/L,精密度<3%[23].
1.2.4 Chl-a样品分析 量取300mL海水样品用0.7µm的Whatman GF/F滤膜低压(<15kPa)过滤,将滤膜对折用预先灭菌的锡纸包好后避光冷冻(-20℃)保存.测定时,将滤膜用10mL 90%的丙酮溶液(丙酮:Q水)低温避光萃取24h,在4000r/min转速下离心10min,取上清液用分子荧光分光光度计(F-4500, Hitachi,日本)进行测定.方法检测限为0.01µg/L[24].
1.2.5 DMSP降解培养实验 本文依据不同海域及近岸、远海二甲基硫化物及CH4浓度分布上的差别分别选取南黄海H02、H10站位,北黄海B21站位、渤海B60站位进行了添加外源DMSPd的DMSP降解培养实验.取3个1L的透光培养袋(Thermo,美国)分别编号为1,2,3,采集表层海水样品后,1号袋注入1L的海水作为对照组,2号袋在注入1L海水的同时加入DMSP标准溶液,控制袋中DMSPd初始浓度为1µmol/L,3号袋加入DMSP标准溶液控制DMSPd初始浓度为5µmol/L,排出袋中气泡,将培养袋密封混匀后在现场海水温度下接触光照培养,以48h为周期,每隔8h取一次样,探究培养袋内DMSP降解过程中DMS和CH4的产生情况.
2 结果与讨论
2.1 表层海水中DMS、DMSP和CH4的水平分布特征
冬季黄、渤海表层海水温度、盐度变化范围分别为1.89~13.91℃和30.02~33.51.冬季黄海最典型的水文现象为黄海暖流所形成的高温、高盐水舌首先自济州岛以西向西北方向伸展,到达南黄海中部后转向北扩展,有进入北黄海的趋势[25].从图2可以看出,表层温度整体呈现南高北低的变化趋势,南黄海东部外海温度、盐度明显高于近岸海域,这主要是黄海暖流入侵的结果.渤海海域莱州湾口附近出现盐度最低值,并向四周逐渐升高,这主要是受黄河冲淡水以及莱州湾周边河流输入的影响.冬季黄、渤海表层海水中Chl-a的浓度变化范围为0.1~1.77μg/L,平均值为(0.53±0.32)μg/L.如图2所示,Chl-a浓度分布整体呈现由近岸到远海逐渐降低的趋势,其浓度高值区主要出现在山东半岛和辽东半岛附近海域,且北黄海和渤海海域Chl-a浓度(0.60μg/L)要明显高于南黄海海域(0.43μg/L).
调查海域表层海水中DMS浓度变化范围在0.07~6.30nmol/L之间,平均值为(1.39±1.21)nmol/L,该结果与杨剑[26]冬季相同海域的调查结果(0.95nmol/L)相近.与DMS相比,DMSP浓度在分布上变化范围更大,DMSPd和DMSPp的浓度变化范围分别是0.63~9.58,0.37~23.82nmol/L,平均值分别为(2.87±1.54),(5.59±4.64)nmol/L.如图2所示,DMS和DMSP在水平分布上虽然有一定差异,但整体上呈现近岸高外海低的分布特征.在山东半岛北部和东部海域、黄河口附近海域均出现了DMS和DMSP浓度的高值,Chl-a、DMS和DMSPd浓度的最高值均出现在莱州湾附近的B70站位,说明近岸海域丰富的营养盐促进了浮游植物对DMSP的生产和释放.此外,南黄海122°E以东海域出现了Chl-a、DMSPd与DMSPp浓度的高值区,这可能受黄海暖流入侵的影响,使得此处海域温度高于近岸,因此促进了浮游植物的生长及DMSP的产生.与Chl-a分布相似,DMS在渤海和北黄海的平均浓度(1.82nmol/L)要明显高于南黄海(0.76nmol/L),宋以柱[27]在秋季黄、渤海海域也观察到类似的分布特征.相对于南黄海来说,北黄海和渤海受人类活动的影响更为明显,频繁的人为活动为海区带来丰富的营养盐[28],促进了浮游植物的生长及二甲基硫化物的生产.
冬季黄、渤海表、底层海水中CH4浓度变化范围分别为4.52~20.74,4.27~37.15nmol/L,平均值分别为(6.91±2.77),(7.32±4.32)nmol/L.如图2所示,表层CH4浓度基本呈现近岸高远海低的分布趋势,底层CH4浓度与表层分布规律表现出一定的差异性,在南黄海及渤海中部海域浓度较大,其中B41站位表、底层海水中溶存CH4浓度远高于其余站位,且其底层海水中浓度(20.74nmol/L)远高于表层(37.15nmol/ L),约是其1.8倍,是其余站位底层平均浓度的约5倍,表明此处底层可能存在一个CH4的强源.南黄海122°E以东海域CH4浓度明显高于近岸海域,这也是受到了黄海暖流入侵的影响.总体来看,冬季黄、渤海底层海水中CH4浓度略微高于表层,这可能与沉积物中CH4的产生和释放有关.
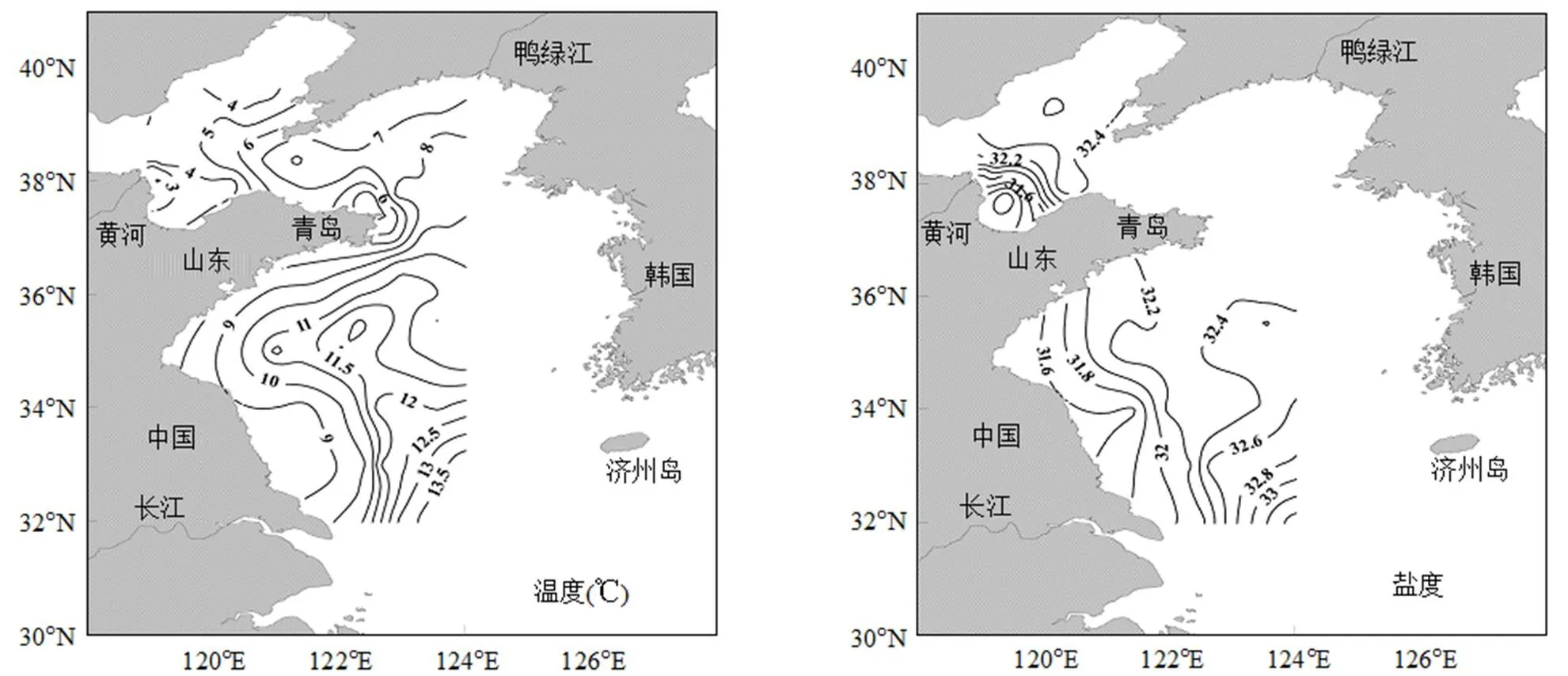
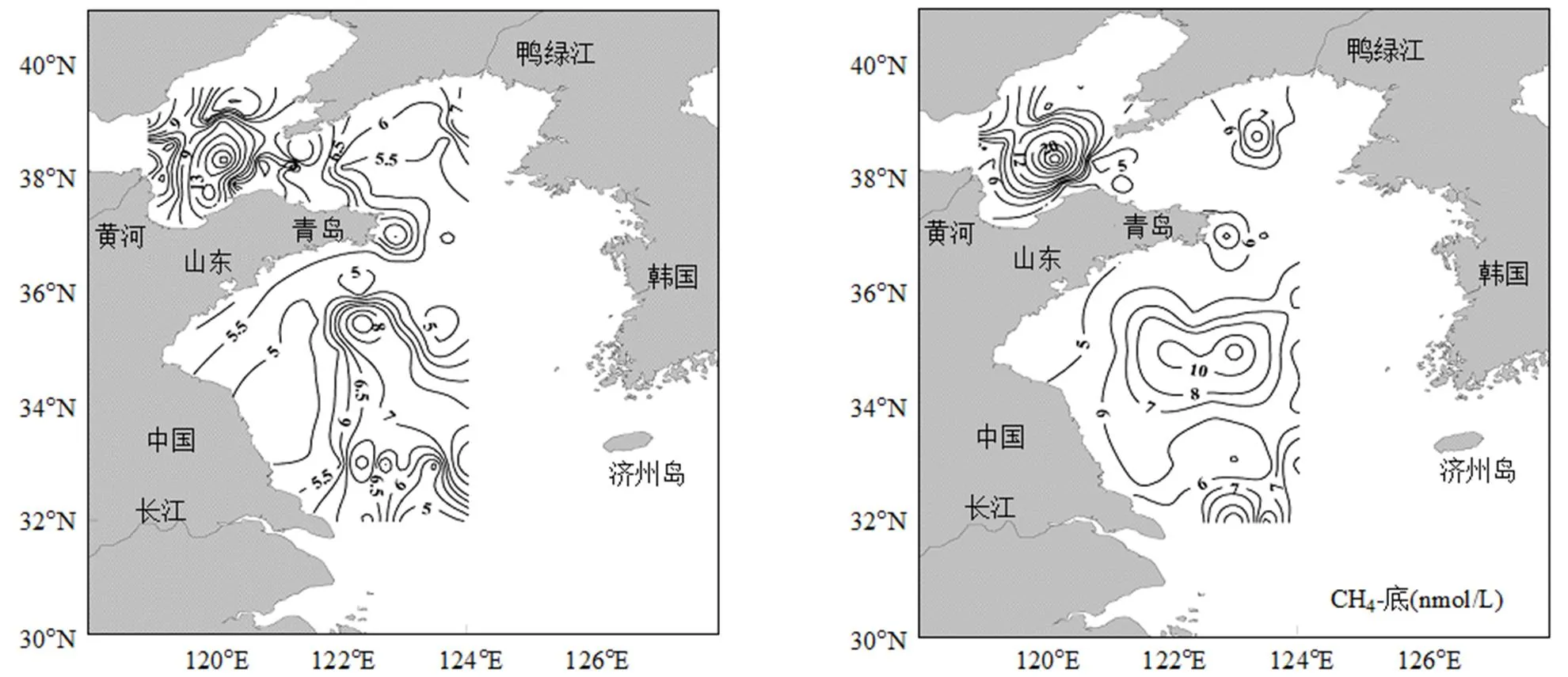
图2 冬季黄渤海海域温度、盐度、Chl-a、DMS、DMSPd、DMSPp和CH4水平分布
2.2 冬季35°N断面DMS、DMSP和CH4的垂直分布
冬季水体混合的增强及黄海暖流的入侵均会对黄海海域的生态环境产生重要作用,为了解黄海暖流及水体混合对该海域二甲基硫化物及CH4垂直分布的影响,本文选取35°N断面对二甲基硫化物及CH4浓度的垂直分布展开研究.由温度盐度分布图可以看出,水体中温度分布较为均匀,盐度在近岸站位水体中分布较为一致,垂直混合均匀(图3).但在断面东侧H13~H10站位,盐度在水深40m以下出现了层化现象,说明在该区域水体的垂直混合尚不完全,垂直交换作用未达海底.此外,黄海中部水域水体温度盐度略高于沿岸站位,可能是受到了黄海暖流的影响,且近岸海域受低温低盐的沿岸流影响[29],温度和盐度整体较低.
如图3所示,Chl-a浓度整体分布较为均匀,DMS及DMSP的垂直分布规律与Chl-a相似.近岸站位受陆源输入和人为活动的影响比较明显,Chl-a、DMS、DMSPd均在近岸的H18站位出现了最大值,可能是因为此处位于海州湾渔场附近[30],营养盐浓度比较高,因而导致Chl-a浓度也比较高,近岸较高的生产力极大影响了二甲基硫化物的生产.在黄海中部水域的上层水体中Chl-a及二甲基硫化物浓度均存在高值区,断面东侧20m以下的深水区Chl-a浓度则随水深增加逐渐下降,DMS及DMSP的浓度也略低于上层水体,可能是因为深水区光照受到限制不利于浮游植物的生长,从而影响了二甲基硫化物的生产.从35°N断面上CH4的分布可以看出,在该断面的深层水体中,CH4浓度随深度的增加而增大,至底层达到最大值,表明底层水体或沉积物中存在CH4的源.
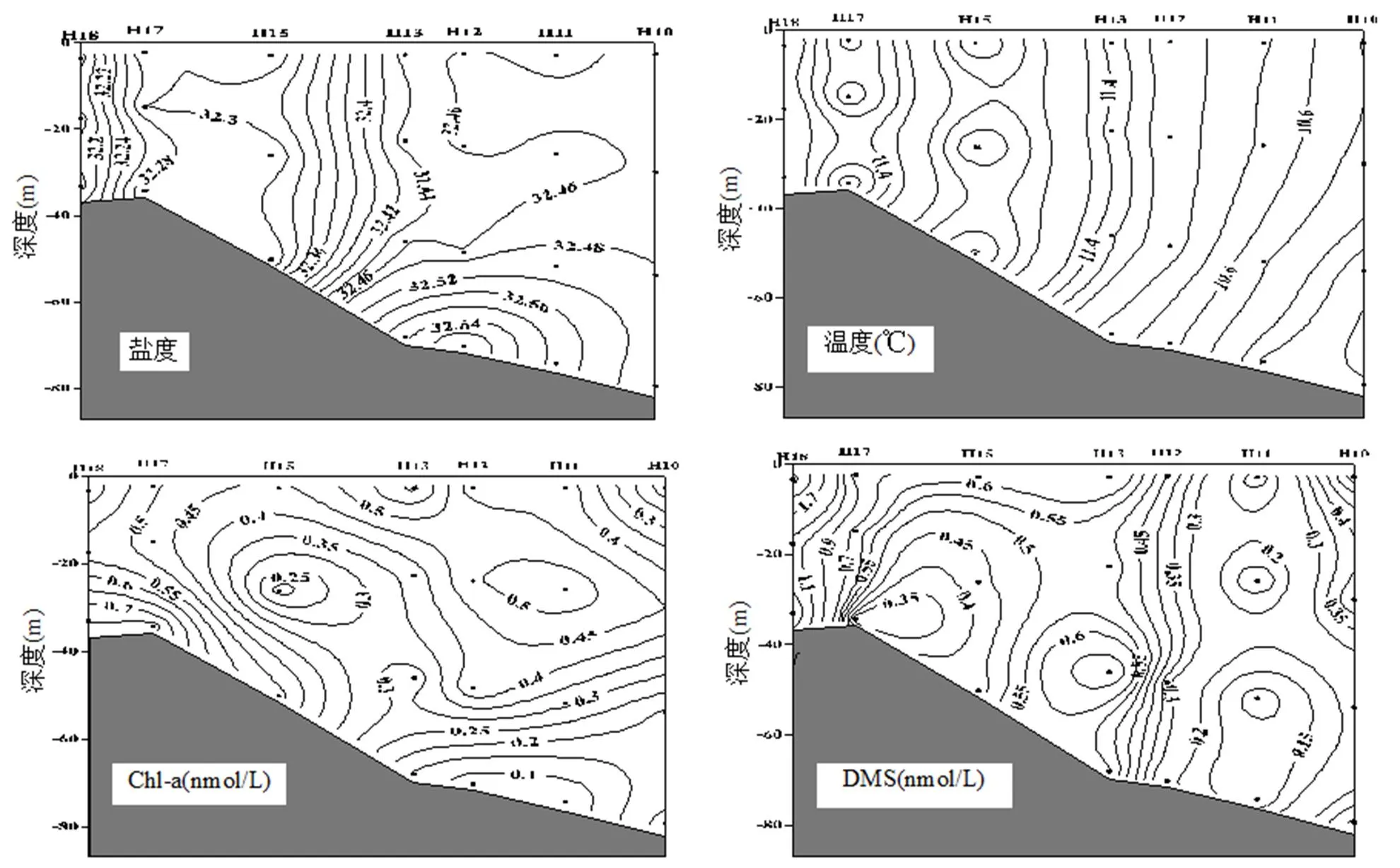
如图3所示,Chl-a浓度整体分布较为均匀,DMS及DMSP的垂直分布规律与Chl-a相似.近岸站位受陆源输入和人为活动的影响比较明显,Chl-a、DMS、DMSPd均在近岸的H18站位出现了最大值,可能是因为此处位于海州湾渔场附近[30],营养盐浓度比较高,因而导致Chl-a浓度也比较高,近岸较高的生产力极大影响了二甲基硫化物的生产.在黄海中部水域的上层水体中Chl-a及二甲基硫化物浓度均存在高值区,断面东侧20m以下的深水区Chl-a浓度则随水深增加逐渐下降,DMS及DMSP的浓度也略低于上层水体,可能是因为深水区光照受到限制不利于浮游植物的生长,从而影响了二甲基硫化物的生产.从35°N断面上CH4的分布可以看出,在该断面的深层水体中,CH4浓度随深度的增加而增大,至底层达到最大值,表明底层水体或沉积物中存在CH4的源.
2.3 DMS、DMSP、CH4及Chl-a间的相互关系
海水中的DMS、DMSP主要来源于浮游植物的生产,而Chl-a的含量可以在一定程度上反映海区内浮游植物生物量,因此,DMS、DMSP与Chl-a之间的相互关系一直是人们研究的热点.如表1所示,海区内表层海水中DMS、DMSPp均与Chl-a存在显著的正相关关系,表明浮游植物生物量对冬季黄、渤海海域DMS、DMSPp的生产有着重要的影响.Yang等[14]在夏季和秋季的黄渤海海域中均发现DMS、DMSPp与Chl-a具有显著的相关性,此外,Uzuka等[31]也发现东海DMS与Chl-a浓度呈正相关关系,这些数据都表明了浮游植物生物量在控制海水中DMS、DMSP浓度分布方面发挥着重要作用.
调查海域CH4与Chl-a浓度分布之间不存在明显的相关性,然而Zindler等[10]在西太平洋的调查结果表明表层海水中CH4与Chl-a浓度存在明显的正相关关系(2=0.69,<0.001,=36),并且发现CH4浓度与标记金藻之间有良好的相关性(2=0.76,< 0.001,=35).造成这种差异的原因可能是不同海域不同季节浮游植物种群的差异,王俊[32]通过对黄海冬季浮游植物种群调査发现,硅藻在冬季黄海浮游植物组成上占有绝对优势,而金藻只占到了非常小的比例.此外,不同海域营养盐和氧化环境也存在很大区别,加之CH4的产生及去除途径较为复杂,因此两者之间的关系存在很大的不确定性.
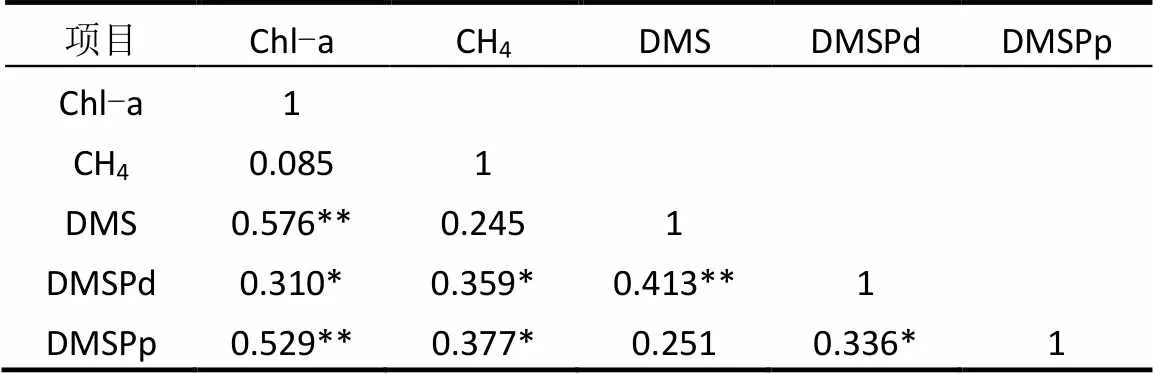
表1 冬季黄、渤海表层海水中DMS、DMSPd、DMSPp、CH4和Chl-a之间的相关关系
注:*为<0.05,**为<0.01.
此外,由表1的数据可知,表层海水中CH4浓度与DMSPd、DMSPp浓度均存在一定的相关性(<0.05),这说明DMSP可能作为甲基型产CH4反应的重要底物,其浓度在一定程度上影响CH4的产生及浓度分布.Zindler[10]在西太平洋的研究中指出,由于营养盐的限制和氧化环境,表层海水中DMSP大量产生并聚集,DMSP与甲烷呈明显的正相关关系; Damm等[33]的研究也发现,当硝酸盐耗尽且磷酸盐作为磷源时观测到了明显的CH4产生,说明低的N/P加强了微生物竞争磷酸盐的能力,此时DMSP被用作C源,分解后最终产生副产物CH4.由此可以看出,研究海域的营养盐条件可能是DMSP分解产生副产物CH4这一途径的重要影响因素.如表2所列,本航次北黄海表现为明显的氮限制,而南黄海和渤海都表现出磷限制的特点,据分析,不同研究海区并未因为N/P的差异使得CH4与DMSPd、DMSPp浓度之间的相关性出现差别,这说明营养盐并不是影响DMS、DMSP与CH4相关关系的唯一因素,DMSP向CH4的转化是一个复杂的生物化学过程,该过程可能还受海水温度、浮游植物种类和数量、微生物群落等多种条件的影响.

表2 冬季黄、渤海表层海水中溶解无机氮(DIN)、PO43--P平均浓度及N/P比值
2.4 DMSP降解对DMS、CH4生产的影响
海水中的DMS和CH4都存在复杂的生产及微生物消耗途径,这些过程都会对其浓度产生影响.本文在南黄海、北黄海和渤海分别选取站位(H02、H10、B21、B60),通过添加不同浓度的DMSPd标准溶液,分析不同DMSPd初始浓度(0,1,5µmol/L分别对应:对照组,实验组1,实验组2)对DMS及CH4产生的影响.从图5可以看出,4个站位中实验组DMS浓度随时间延长皆呈明显的增长趋势,且实验组2相对于实验组1来说,培养袋内DMS浓度增长更快,生产速率更大.Kiene等[34]研究表明,不同初始浓度的DMSPd影响DMSP降解的方式,当DMSP浓度低时,浮游细菌主要通过去甲基化降解途径提供高能量来吸收还原态硫;当DMSP浓度高时,未被吸收的DMSP通过酶裂解途径进行裂解从而产生DMS和丙烯酸.所以当向海水中外源性添加DMSPd时,大量的DMSPd通过酶裂解产生DMS,提高了培养体系内的DMS浓度.因此可以看出,水体中DMSPd的浓度对DMS的产生具有重要影响.
此外,在渤海的B60站位和南黄海的近岸站位H02,不同的DMSPd初始浓度对培养袋内CH4的浓度变化没有较为明显的影响,说明在该附近海域DMSPd的浓度对CH4的产生没有较为明显的贡献,可能是因为近岸及河口区域海水中CH4的来源较复杂,富甲烷冲淡水以及陆源输入携带的大量营养物质极大程度上决定了海水中CH4的浓度分布.而在远海的H10和B21站位,实验组1和实验组2中CH4浓度均有显著提高,对照组则变化不明显.从图5可以看出,H10和B21站位培养实验中不同DMSPd初始浓度的实验组中CH4浓度变化相当,1,5µmol/L DMSPd的添加使得CH4浓度变化10nmol/L左右,说明外源性DMSPd的添加对该站位表层海水CH4的生产释放有较大的影响.远海站位培养结果的差异可能是因为在较为开阔的外海海域决定CH4产生的因素较为单一,因而DMSPd更易作为甲基型产CH4反应的重要底物,在一定程度上影响CH4的产生及浓度分布.事实上,DMSP降解产生CH4这一过程的限制因素较多,限制条件包括:营养盐(N/P)、微生物组成底物浓度、温度及pH值等.
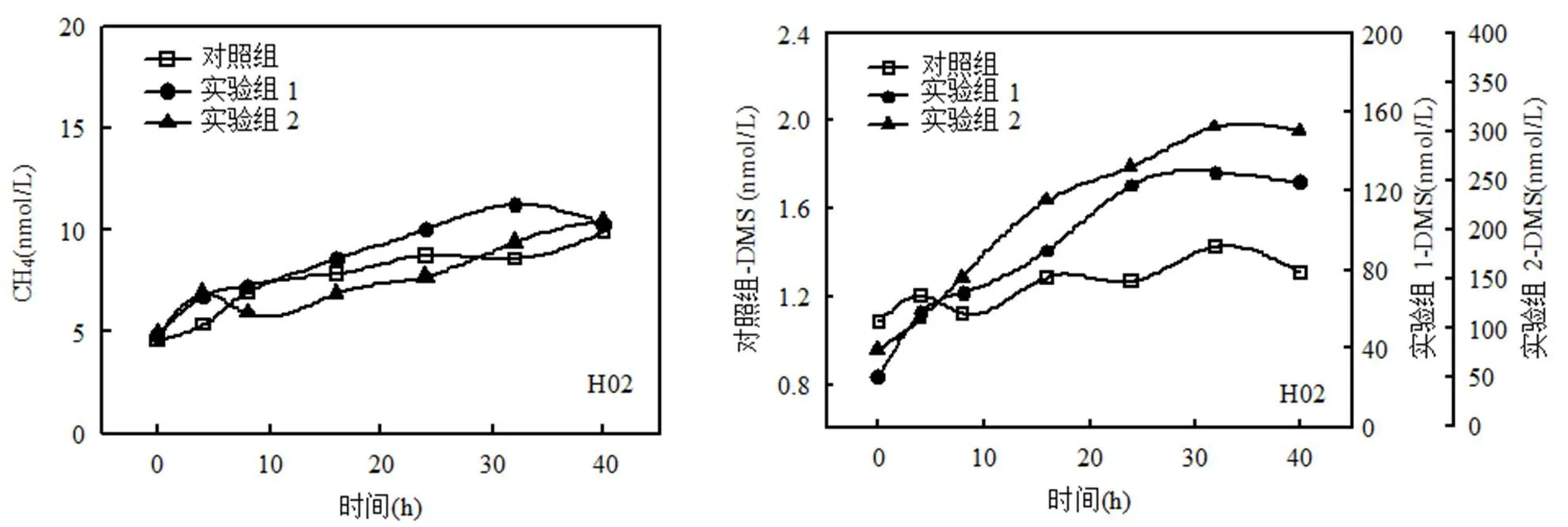

图5 表层海水中不同DMSPd浓度条件下DMS、CH4浓度变化曲线
2.5 冬季黄、渤海DMS和CH4的海-气通量
2.5.1 冬季黄、渤海DMS的海-气通量 为了评价研究海区DMS对全球硫循环的贡献,本文采用Liss等[35]建立的滞膜模型估算了DMS的海-气通量,计算公式为:
=(w-g/)=w(1)
式中:是海-气传输速率;w和g分别为DMS在海水和大气中的浓度;是亨利常数;由于g/远小于w,可忽略.其中海-气传输速率有多种计算方法,本文采用目前国际上最常用的N2000法[36]来计算.
计算结果表明,冬季黄、渤海DMS海气通量介于0.04~17.4μmol/(m2×d)之间,平均值为(2.73±3.18) μmol/(m2×d).DMS海-气通量呈现出明显的空间差异,这是由于不同站位的DMS浓度和风速都存在较大差异.在风速变化不大的情况下,DMS海-气通量与水体中DMS浓度变化较为一致;当风速变化较大时,DMS的海-气通量也发生剧烈的变动.DMS海-气通量的最大值出现在南黄海海域的H18站位,该站位风速(12.7m/s)和DMS浓度(2.65nmol/L)都相对较高,它们的共同作用产生了DMS海-气通量的最大值,DMS海-气通量的最小值则出现在风速最低(0.8m/s)的H15站位.基于本论文冬季黄渤海海域DMS海-气通量的平均值(2.73μmol/(m2×d)),根据黄渤海海域的面积为45.7×104km2,大致估算了2017年冬季DMS的释放量为3.59×10-3Tg S.这说明了作为陆架海区的黄、渤海DMS的年释放量较大,DMS海-气通量受人为活动影响显著,其释放产生的DMS对于全球海洋DMS的释放发挥着不可忽视的作用.
2.5.2 冬季黄、渤海CH4的饱和度和海-气通量 海水中溶解CH4的饱和度和海-气通量可由下式计算得出[37]:
=obs/eq(2)
=K×(obs-eq) (3)
式中:obs为CH4在表层海水中的实测浓度;eq为气体在表层海水中与大气达平衡时的浓度,可根据大气中甲烷浓度、现场水温、盐度等,利用Wiesenburg公式[38]计算得到;w为气体交换速率,利用N2000法[36]来计算.
根据2016年全球大气CH4的平均浓度(1853±2)×10-9和年增长率0.5%~1%(取平均值),可推算出2017年全球大气中CH4的平均浓度约为1867×10-9.冬季黄、渤海表层海水中CH4的饱和度范围是152.8%~641.9%,平均值为(222.7±84.9)%,均处于轻微过饱和状态,表明冬季黄、渤海是大气CH4的一个净源.利用N2000法[36]计算得到的CH4海-气通量范围和平均值分别为0.20~41.02μmol/(m2×d), (8.14±7.68)μmol/(m2×d).根据黄、渤海海域的面积为45.7×104km2,大致估算出2017年冬季黄、渤海CH4释放量为4.69×10-3Tg CH4.
3 结论
3.1 冬季黄、渤海表层海水中Chl-a、DMS、DMSP和CH4的浓度都相对较低,DMS和DMSP的分布特征与Chl-a基本一致,呈现出近岸高、外海低的分布趋势.渤海和北黄海海域DMS、DMSP的浓度整体上要高于南黄海.该海域底层海水中CH4浓度略微高于表层.黄海中部海域上层水体中DMS、DMSP浓度存在高值区,在20m以下的深水区两者的浓度随水深增加逐渐下降.CH4浓度则随深度的增加而增大,表明底层水体或沉积物中存在CH4的源.
3.2 冬季黄、渤海表层海水中DMS、DMSPp均与Chl-a存在显著的正相关关系,CH4与Chl-a浓度不存在明显的相关关系,而其与DMSPd、DMSPp浓度均存在一定的相关性,这说明二甲基硫化物可能是CH4产生的潜在基质.
3.3 添加不同浓度的DMSPd至海水样品中,DMS浓度随时间延长呈明显的增长趋势,且添加DMSPd的浓度越大,DMS的平均生产速率越大,说明水体中DMSPd的浓度对DMS的产生具有重要影响.南海、黄海远海站位及北黄海站位的实验组CH4浓度均有显著提高,说明外源性DMSPd的添加对该站位表层海水CH4的生产释放有较大的影响.
3.4 根据冬季黄、渤海DMS及CH4的海-气通量大致估算了2017年冬季DMS、CH4的释放量分别为3.59×10-3Tg S和4.69×10-3Tg CH4,表层海水中CH4基本处于轻微过饱和状态,表明冬季黄、渤海是大气中DMS、CH4重要的源.
[1] Andreae M O. Ocean-atmosphere interactions in the global biogeochemical sulfur cycle [J]. Marine Chemistry, 1990,30:1-29.
[2] 李和阳,王大志,林益明,等.海洋二甲基硫的研究进展 [J]. 厦门大学学报(自然版), 2001,40(3):715-725. Li H Y, Wang D Z, Lin Y M, et al. Progress in study of marine dimethylsulfide [J]. Journal of Xiamen University (Natural Science), 2001,40(3):715-725.
[3] Stefels J, Steinke M, Turner S, et al. Environmental constraints on the production and removal of the climatically active gas dimethylsulphide (DMS) and implications for ecosystem modeling [J]. Biogeo chemistry, 2007,83(1-3):245-275.
[4] Visscher P T, Taylor B F. Demethylation of dimethylsulfoniopropionate to 3-mercaptopropionate by an aerobic marine bacterium. [J]. Applied and Environmental Microbiology, 1994,60(12):4617-4619.
[5] Crutzen P J. Methane's sinks and sources [J]. Nature, 1991,350(6317): 380-381.
[6] Zhou H, Yin X, Yang Q, et al. Distribution, source and flux of methane in the western Pearl River Estuary and northern South China Sea [J]. Marine Chemistry, 2009,117(1–4):21-31.
[7] Bange H W, Bartell U H, Rapsomanikis S, et al. Methane in the Baltic and North Seas and a reassessment of the marine emissions of methane [J]. Global Biogeochemical Cycles, 1994,8(4):465-480.
[8] Bange H. Air-sea exchange of nitrous oxide and methane in the Arabian Sea: A simple model of the seasonal variability [J]. Indian Journal of Geo-Marine Sciences, 2004,33(1):77-83.
[9] Karl D M, Beversdorf L, Björkman K M, et al. Aerobic production of methane in the sea [J]. Nature Geoscience, 2008,1(7):473-478.
[10] Damm E, Kiene R P, Schwarz J, et al. Methane cycling in Arctic shelf water and its relationship with phytoplankton biomass and DMSP [J]. Marine Chemistry, 2008,109(1/2):45-59.
[11] Zindler C, Bracher A, Marandino C A, et al. Sulphur compounds, methane, and phytoplankton: interactions along a north-south transit in the western Pacific Ocean [J]. Biogeosciences, 2013,10(5):3297- 3311.
[12] Yang G P, Li L, Qi J L, et al. Dimethylsulfide in the surface water of the East China Sea [J]. Continental Shelf Research, 2000,20(1):69-82.
[13] Yang G P. Spatial distributions of dimethylsulfide in the South China Sea [J]. Deep-Sea Research Part I Oceanographic Research Papers, 2000,47(2):177-192.
[14] Yang G, Song Y, Zhang H, et al. Seasonal variation and biogeochemical cycling of dimethylsulfide (DMS) and dimethylsulfoniopropionate (DMSP) in the Yellow Sea and Bohai Sea [J]. Journal of Geophysical Research Oceans, 2015,119(12):8897- 8915.
[15] Hu M, Tang X Y, Li J L, et al. Distributions of dimethylsulfide in the Bohai sea and Yellow Sea of China. [J]. Journal of Environmental Science, 2003,15(6):762-767.
[16] Zhang G L. Distributions and fluxes of methane in the East China Sea and the Yellow Sea in spring [J]. Journal of Geophysical Research, 2004,109(C7):C07011.
[17] Zhang G, Zhang J, Liu S, et al. Methane in the Changjiang (Yangtze River) Estuary and its adjacent marine area: riverine input, sediment release and atmospheric fluxes [J]. Biogeosciences,7,11(2010-11- 09),2010,91(1):71-84.
[18] Zhang G, Zhang J, Ren J, et al. Distributions and sea-to-air fluxes of methane and nitrous oxide in the North East China Sea in summer [J]. Marine Chemistry, 2008,110(1):42-55.
[19] Bates T S, Kelly K C, Johnson J E, et al. Regional and seasonal variations in the flux of oceanic Dimethylsulfide to the atmosphere [J]. Journal of Geophysical Research Atmospheres, 2012,100(D11): 23093-23101.
[20] 杨桂朋,康志强,景伟文,等.海水中痕量DMS和DMSP分析方法的研究 [J]. 海洋与湖沼, 2007,38(4):322-328. Yang G P, Kang Z Q, Jing W W, et al. An analytical method of determining trace quantities of dimethylsulfide and dimethylsulfoniopropionate in seawater [J]. Oceanologia ET Limnologia Sinica, 2007,38(4):322-328.
[21] Kiene R P, Service S K. The influence of Glycine Betaine on Dimethyl Sulfide and Dimethylsulfoniopropionate concentrations in seawater [M]. Biogeochemistry of Global Change, 1993:654-671.
[22] 张桂玲,张 经.海洋中溶存甲烷研究进展 [J]. 地球科学进展, 2001,16(6):829-835. Zhang G L, Zhang J. Advances in studies of dissolved methane in seawater [J]. Advance in Earth Sciences, 2001,16(6):829-835.
[23] 张桂玲.中国近海部分海域溶解甲烷和氧化亚氮的生物地球化学研究 [D]. 青岛:中国海洋大学, 2004. Zhang G L. Studies on biogeochemistry of dissolved methane and nitrous oxide in the coastal waters of China [D]. Qingdao: Ocean University of China, 2004.
[24] 张洪海,杨桂朋.胶州湾及青岛近海微表层与次表层中二甲基硫(DMS)与二甲巯基丙酸(DMSP)的浓度分布 [J]. 海洋与湖沼, 2010,41(5):683-691. Zhang H H, Yang G P. Distribution of dimethylsulfide (DMS) and dimethylsulphoniopropionate (DMSP) in the microlayer and subsurface water in Jiaozhou bay and Qingdao coastal water [J]. Oceanlogia ET Limnologia Sinica, 2010,41(5):683-691.
[25] 王保栋,王桂云,郑昌洙,等.南黄海冬季生源要素的分布特征 [J]. 黄渤海海洋, 1999,(1):40-45. Wang B D, Wang J Y, Zheng C Z, et al. Distribution features of bioactive elements in seawater in the Southern Yellow Sea in Winter [J]. Journal of Oceanography of Huanghai and Bohai seas, 1999,(1): 40-45.
[26] 杨 剑.中国东部陆架海生源硫的分布、通量及其对气溶胶中非海盐硫酸盐的贡献 [D]. 青岛:中国海洋大学, 2014. Yang J. Distribution and sea-to-air flux of biogenic sulfur from the eastern China continental seas and its contribution to the non-sea-salt sulfate in aerosol. [D]. Qingdao: Ocean University of China, 2014.
[27] 宋以柱.中国黄海、渤海DMS和DMSP的浓度分布及影响因素研究 [D]. 青岛:中国海洋大学, 2014. Song Y Z. Studies on the distribution of DMS and DMSP and influencing factors in the Yellow Sea and Bohai Sea, China [D]. Qingdao: Ocean University of China, 2014.
[28] Zhang J. Nutrient elements in large Chinese estuaries [J]. Continental Shelf Research, 1996,16(8):1023-1045.
[29] Chen J F, Roald S. Hydrographic condition and variability in the Yellow Sea and East China Sea during winter [J]. Progress in Fishery Sciences, 2001(4):21-28.
[30] Wei H, Su J, Wan R J, et al. Tidal front and the convergence of anchovy (Engraulis japonicus) eggs in the Yellow Sea [J]. Fisheries Oceanography, 2010,12(4/5):434-442.
[31] Uzuka N, Watanabe S, Tsunogai S. Dimethylsulfide in coastal zone of the East China Sea [J]. Journal of Oceanography, 1996,52(3):313-321.
[32] 王 俊.渤海近岸浮游植物种类组成及其数量变动的研究 [J]. 海洋水产研究, 2003,24(4):44-50. Wang J. Species composition and quantity variation of phytoplankton in inshore waters of the Bohai Sea [J]. Marine Fisheries Research, 2003,24(4):44-50.
[33] Damm E, Helmke E, Thoms S, et al. Methane production in aerobic oligotrophic surface water in the central Arctic Ocean [J]. Biogeosciences, 2010,7(3):46–48.
[34] Kiene R P, Linn L J, Bruton J A. New and important roles for DMSP in marine microbial communities [J]. Journal of Sea Research, 2000,43(3/4):209-224.
[35] Liss P S, Merlivat L. Air-sea gas exchange rates: introduction and synthesis [J]. The Role of Air-Sea Exchange in Geochemical Cycling, 1986,185:113-127.
[36] Nightingale P D, Malin G, Law C S, et al. In situ evaluation of air-sea gas exchange parameterizations using novel conservative and volatile tracers [J]. Global Biogeochemical Cycles, 2000,14(1):373-387.
[37] 曹兴朋,张桂玲,马 啸,等.春季东、黄海溶解甲烷的分布和海气交换通量 [J]. 环境科学, 2013,34(7):2565-2573. Cao X P, Zhang G L, M X, et al. Distribution and air-sea fluxes of methane in the Yellow Sea and the East China Sea in spring [J]. Environmental Science, 2013,34(7):2565-2573.
[38] Wiesenburg D A, Jr N L G. Equilibrium solubilities of methane, carbon monoxide, and hydrogen in water and seawater [J]. Journal of Chemical & Engineering Data, 1979,24(4):356.
Distributions of dimethylsulfide, dimethylsulfoniopropionate, methane and influencing factors in the Yellow Sea and Bohai Sea during winter.
TAN Dan-dan1, ZHANG Hong-hai1,2, ZHAI Xing1, GAO Xu-xu1, YANG Gui-peng1,2,3*
(1.College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China;2.Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;3.Institute of Marine Chemistry, Ocean University of China, Qingdao 266100, China)., 2019,39(5):2143~2153
The concentrations of dimethylsulfide (DMS), dimethylsulfoniopropionate (DMSP) and dissolved methane (CH4) were measured in situ in the Yellow Sea and Bohai Sea from December 2017 to January 2018 to study their distributions, correlations and the air-sea fluxes of DMS and CH4. In addition, the influences of DMSP degradation on the productions of DMS and CH4were also studied through incubation experiments. The average concentrations of DMS, DMSPd, DMSPp and CH4were (1.39±1.21), (2.87±1.54), (5.59±4.64) and (6.91±2.77) nmol/Lin the surface water, respectively. The horizontal distributions of DMS, DMSP, and chlorophyll a (Chl-a) exhibited the same pattern of decreasing from inshore to offshore. The vertical profiles of DMS and DMSP showed that the maximum concentrations both appeared in the upper mixed layer, whereas, the concentration of CH4increased with depth and reached the maximum at the bottom. Significant correlations were observed between DMS, DMSPp and Chl-a, positive correlations between DMSPd, DMSPp and CH4were also found (<0.05). DMSP degradation experiments showed that higher initial concentration of DMSP in seawater, the higher production rate of DMS was. The average air-sea fluxes of DMS and CH4were estimated to be (2.73±3.18) and (8.14±7.68) μmol/(m2⋅d) during this investigation, suggesting that the Yellow Sea and Bohai Sea acted as an important source for atmospheric DMS and CH4in winter.
dimethylsulfide;dimethylsulfoniopropionate;methane;Yellow Sea;Bohai Sea
X55
A
1000-6923(2019)05-2143-11
谭丹丹(1994-),女,山东潍坊人,中国海洋大学硕士研究生,主要研究方向为海洋有机硫循环.
2018-10-24
国家重点研发计划项目(2016YFA0601301);国家自然科学基金资助项目(41576073);中央高校基本科研业务费资助项目(201762032);海洋国家实验室“鳌山人才”卓越科学家计划项目(2015ASTP)
*责任作者, 教授, gpyang@ouc.edu.cn

