兴安百里香茎芽增殖途径的植株再生
魏晓雪 姜明月 张文天 吕跃东 张妍妍

摘 要:为探索野生兴安百里香组织培养最佳培养条件获得完整再生植株,以五大连池野生兴安百里香为研究对象,研究外植体类型、消毒时间和培养基种类对兴安百里香茎芽增殖与微枝生根的影响。结果表明:带腋芽茎段为兴安百里香组培的最佳外植体,采用质量浓度0.1%升汞浸泡4 min的方法消毒效果最佳;最适愈伤组织诱导培养基为MS+6-BA1.0 mg/L+2,4-D0.5 mg/L+蔗糖30 g/L+瓊脂粉6 g/L;最适茎芽增殖培养基为MS+6-BA1.0 mg/L+2,4-D0.5 mg/L;最适微枝生根培养基为MS+6-BA 1.0 mg/L+2,4-D 0.8 mg/L。此研究结果为通过工厂化育苗技术培育野生兴安百里香优质观赏苗木奠定了基础。
关键词:兴安百里香;带芽茎段;组织培养;再生体系
中图分类号:S573.9 文献标识码:A 文章编号:1006-8023(2019)04-0022-06
Plant Regeneration of the Stem Bud Proliferation Pathway of Thymus dahuricus
WEI Xiaoxue1, JIANG Mingyue1, ZHANG Wentian1, LV Yuedong2, ZHANG Yanyan2*
(1. Institute of Volcanoes and Mineral Springs, Heilongjiang Academy of Science, Wudalianchi 164155; 2.Forestry Research Institute of Heilongjiang Province, Harbin 150040)
Abstract:In order to explore the optimal culture conditions for wild Thymus dahuricus tissue culture to obtain a complete regenerated plant, we studied the effects of explant type, disinfection time and medium variety on stem bud proliferation and microbranched rooting of Thymus dahuricus with Wudalianchi wild Thymus dahuricus. The results showed that: the best explants for tissue culture of Thymus dahuricus were axillary bud stem segment. The best disinfection effect was achieved by soaking for 4 min with a mass concentration of 0.1% mercury. The best medium for callus induction was: MS+6-BA1.0 mg/L+2,4-D0.5 mg/L+ saccharose 30 g/L+ powdered agar 6 g/L. The most suitable medium for stem-bud multiplication was: MS+6-BA1.0 mg/L+2,4-D0.5 mg/L. The best medium for rooting of microtwigs was: MS+6-BA 1.0 mg/L+2,4-D 0.8 mg/L. The results laid a foundation for the cultivation of high quality ornamental seedlings of wild Thymus dahuricus by means of industrial seedling raising technology.
Keywords:Thymus dahuricus; stem with axillary bud; tissue culture; regeneration system
0 引言
百里香属(Thymus)植株具有强烈的芳香气味,其花茎叶可提取芳香油,是重要的芳香和药用植物,也可作为观赏、环保以及蜜源植物[1-3]。百里香芳香油是重要的天然香料,具有一定的商业价值,广泛应用于化妆品、医疗、保健和食品等方面,具有广阔的开发前景[4-8]。
一般百里香主要来自野生资源,人们对百里香精油的需求量与日俱增,野生资源不能满足需要,而且很快会导致野生资源的枯竭,故需要开展人工栽培。目前,百里香的人工栽培主要依靠种子育苗,但种子育苗易受病毒浸染,导致种性退化,产量和品质下降,不能适应规模化和标准化生产的需要,因此前人进行了大量百里香属的组织培养技术研究[9-10]。
以往有关百里香属组织培养试验中,主要研究了不同品种、不同外植体、培养基及生长调节剂对丛生芽的诱导和生根的影响[10-16]。赵庆臻等[14]对五脉百里香进行了组培快繁尝试,采用野生带腋芽茎段作为组培材料。李晓东等[15]以离体培养的百里香不定芽为材料,研究了培养基添加不同浓度的苯丙氨酸或茉莉酸甲酯对不定芽生长以及精油提取率等的影响。徐治朋等[16]研究了Cu2+对离体培养的红花百里香不定芽生长及挥发油的影响。虽然百里香属植物的组培快繁研究已历时多年,但由于兴安百里香(Thymus dahuricus)分布范围不广,生境寒冷等原因,关于野生兴安百里香组培技术研究较少,现有的百里香属快速繁殖方法并不适用于野生兴安百里香[17-18]。因此急需开展野生兴安百里香离体培养再生组培体系的建立与改善工作,为今后工厂化育苗和种质资源保存等工作奠定基础。
1 材料与方法
1.1 外植体筛选
2017年5月,分别选取五大连池野生兴安百里香的叶片、带芽茎段做为供试材料进行外植体诱导。将供试外植体用清水冲洗干净,用0.1%升汞浸泡4 min,无菌水冲洗3次。剪取长约1.0 cm的带芽茎段,接种于MS+6-BA 1.0 mg/L+2,4-D 0.5 mg/L+蔗糖30 g/L+日產琼脂粉6 g/L(Solarbio,A8190)的培养基中,pH值调至5.8~6.0。
选取2~5节成熟的叶片,把叶片远轴面向上接种到MS+6-BA 1.0 mg/L+2,4-D 0.5 mg/L+蔗糖30 g/L+琼脂粉6 g/L的培养基上,pH值调至5.8~6.0。
每种外植体接种10瓶,每瓶4个外植体,试验重复3次。培养30 d后调查各供试外植体的茎芽诱导情况。培养温度白天27±1 ℃,夜间22±1 ℃,光照强度2 000 Lux,光照10 h/黑暗14 h。
1.2 外植体灭菌
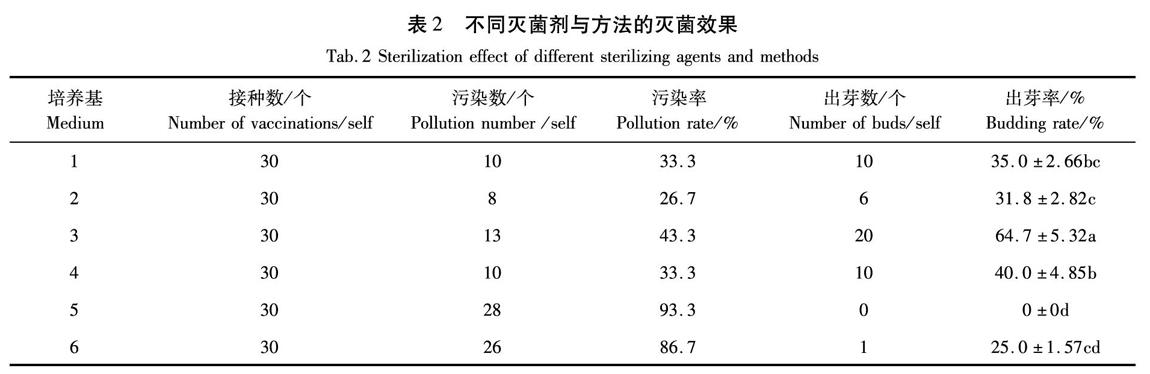
剪取长约1.0 cm的带芽茎段,用清水反复冲洗备用。灭菌处理:①75%酒精浸泡30 s,0.1%升汞(HgCl2)浸泡4 min,之后无菌水冲洗3次;②75%酒精浸泡30 s,0.1%升汞浸泡6 min,之后无菌水冲洗3次;③0.1%升汞浸泡4 min,之后无菌水冲洗3次;④0.1%升汞浸泡6 min,之后无菌水冲洗3次;⑤75%酒精浸泡30 s,5%次氯酸钠浸泡10 min,之后无菌水冲洗3次;⑥75%酒精浸泡30 s,5%次氯酸钠浸泡20 min,之后无菌水冲洗3次。每处理10个茎段,3次重复,2周后观察效果。
1.3 基本培养基的筛选
将经过灭菌的芽苗接种于以下4种基本培养基进行培养:①1/2MS:大量元素含量减半;②MS;③ WPM;④改良WPM:以Ca(NO3)2·4H2O 684 mg/L(单位下同)、KNO3 190、C10H13FeN2NaO8 73.4和盐酸硫胺素0.1代替原WPM培养基中的K2SO4、CaCl2、FeSO4和Na2EDTA。培养基中添加蔗糖30 g/L,琼脂粉6 g/L,pH值调至5.8~6.0,培养温度白天27±1 ℃,夜间22±1 ℃,光照强度2 000 Lux,光照10 h/黑暗14 h。每处理10个茎段,2次重复,待培养20 d调查芽苗数、平均生长量等指标。
1.4 试管苗初代培养
将接种于基本培养基上未染菌、生长状况良好的芽苗剪成1.0~1.5 cm的茎段接种于以MS为基本培养基,分别添加6-BA0.2、0.5、1.0、2.0 mg/L的培养基上,添加蔗糖30 g/L,琼脂粉6 g/L,pH值调至5.8~6.0,每处理10个茎段,3次重复,于接种后的20 d观察芽苗生长分化情况。培养温度白天27±1 ℃,夜间22±1 ℃,光照强度2 000 Lux,光照10 h/黑暗14 h。
1.5 试管苗增殖培养
待腋芽伸长后,将试管苗转接于添加了以下几种激素的MS培养基中:①6-BA0.5 m/L+2,4-D0.5 mg/L;②6-BA1.0 mg/L+2,4-D0.5 mg/L;③6-BA 1.5 mg/L+ 2,4-D 0.5 mg/L;④6-BA2.0 mg/L+2,4-D0.5 mg/L;⑤6-BA 1.0 mg/L+2,4-D 0.3 mg/L;⑥6-BA 1.0 mg/L+2,4-D 0.8 mg/L;⑦ 6-BA 1.0 mg/L+2,4-D 1.0 mg/L,进行增殖培养。上述培养基均加蔗糖30 g/L,琼脂粉6 g/L,pH值调至为5.8~6.0。每个处理接种10瓶,每瓶5个单芽茎段,3次重复,培养30 d后调查增殖效果。
1.6 试管苗生根培养
当继代培养中芽苗直径长至0.5 cm以上时,将生长健壮、高0.5~1 cm的幼苗转至生根培养基中,每瓶接芽苗3个,观察生根情况。培养条件同1.5。每个处理接种10瓶,每瓶3个组培苗,重复3次。30 d后统计生根和生长情况。
1.7 数据处理与统计分析
按下列方法统计褐化率、出芽率、污染率、生根率、增殖率和增殖系数,采用 SPSS12.0 软件进行方差分析及多重比较。
褐化率=(外植体褐化数/接种外植体数)×100%。
出芽率=(外植体诱导出芽数/接种外植体数)×100%。
污染率=(外植体污染数/接种外植体数)×100%。
生根率=(生根苗数/接种苗数)×100%。
增殖率=(增殖的苗数/接种苗数)×100%。
增殖系数= 增殖的苗数/接种苗数。
2 结果与分析
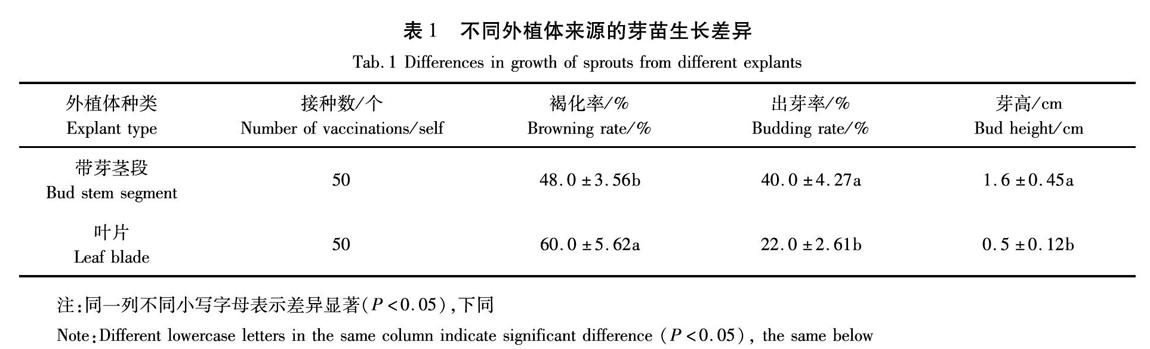
2.1 不同种类外植体对芽苗生长的影响
叶片接种20 d后,叶片切口边缘产生肉眼可见的愈伤组织或在伤口边缘处直接产生晶亮、绿色的不定芽。愈伤组织多为白色、黄绿色或淡黄色,较致密,生长缓慢。产生的愈伤组织有些能继续分化出不定芽,而有些随着培养时间的延长变褐坏死。产生的不定芽多为浅绿色或黄绿色。不定芽大多密集在伤口边缘,丛生或单生,并且可以在原有培养基上继续长出叶片。有些叶片上产生的不定芽须经过愈伤组织阶段,而有些不定芽不需经过愈伤组织阶段,直接在伤口边缘产生。
带腋芽茎段在接种后的10 d观察到茎段底部有淡绿色或黄绿色的愈伤组织产生,有部分茎段未产生愈伤组织而褐化死亡。在茎段接种25 d后诱导产生不定芽,如图1所示,随着培养时间的延长小叶片也逐渐展开。
在培养30 d后统计发现(表1),茎段的诱导率较高,为40.0%,褐化率相对稍低,为48.0%,芽高1.6 cm;叶片的不定芽出芽率为22.0%,褐化率较高,为60.0%,芽高0.5 cm。因此,带腋芽茎段为兴安百里香组培的最佳外植体。
[3]于二汝,王少铭,侯颖辉,等.5种黔引百里香的形态特征和蒸馏法提取精油的化学型比较研究[J].热带作物学报,2018,39(1):84-92
YU E R, WANG S M, HOU Y H, et al. Botanical characters and composition of essential oils from five varieties of Thyme grown in Guizhou area[J]. Chinese Journal of Tropical Crops, 2018, 39(1): 84-92.
[4]SAIDI M, GHAFOURIAN S, ZARINABAADI M, et al. In vitro antimicrobial and antioxidant activity of black thyme (Thymbra spicata L.) essential oils[J]. Roum Archives of Microbiology and Immunology, 2012, 71(2): 61-69.
[5]ZABOROWSKA Z A, PRZYGONSKI K, BILSKA A. Antioxidative effect of thyme (Thymus vulgaris) in sunflower oil[J]. Acta Sci.Pol., Technol.Aliment, 2012, 11(3): 283-291.
[6]吴爽,魏凤香,李红枝,等.柠檬百里香叶挥发油成分分析及对肝癌细胞毒性作用[J].中药材,2013,36(5):756-759.
WU S, WEI F X, LI H Z, et al. Chemical composition of essential oil from Thymus citriodorus and its toxic effect on liver cancer cells[J]. Journal of Chinese Medicinal Materials, 2013, 36 (5): 756-759.
[7]刘光发,宋海燕,罗婉如,等.百里香-丁香罗勒精油抗菌纸对草莓的防腐保鲜效果[J],包装工程,2018,39(19):91-97.
LIU G F, SONG H Y, LUO W R, et al. Effect of antimicrobial paper coated with Thymus vulgaris L. and Ocimum gratissimum L. essential oil on preservation of strawberry[J]. Packaging Engineering, 2018, 39(19): 91-97.
[8]佟晶晶,王明陽,潘佳雯,等.植物精油抗菌和抗真菌活性的研究进展[J].中国饲料,2018,29 (7):46-49.
TONG J J, WANG M Y, PAN J W, et al. Research advances in antibacterial and antifungal activity of plant essential oils[J]. China Feed, 2018, 29(7): 46-49.
[9]李晓东,王永飞,马三梅,等.东北百里香组培再生体系的建立普通百里香的组织培养和快速繁殖[J].湖北农业科学,2009,48(6): 1294-1297.
LI X D, WANG Y F, MA S M, et al. Tissue culture and rapid propagation of Thymus vulgaris[J]. Hubei Agricultural Sciences, 2009, 48(6): 1294-1297.
[10]宋阳,王冲,魏岩.兴安百里香播种繁殖研究[J].种子,2014,33(1):116-118.
SONG Y, WANG C, WEI Y. Study on characteristics of seeds and sowing of Thymus dahuricus Serg.[J]. Seed, 2014, 33(1): 116-118.
[11]徐世千,李晓东,张建国.不同方法提取组培百里香精油质量及成分的比较分析[J].植物科学学报,2013,31(6):609-615.
XU S Q, LI X D, ZHANG J G. Comparative analysis of essential oil quality and composition from tissue culture seedlings of Thymus vulgaris L using different extraction methods[J]. Plant Science Journal, 2013, 31(6): 609-615.
[12]徐治朋.红花百里香组织培养体系优化及挥发油产量的调节研究[D].重庆:西南大学, 2016.
XU Z P. Study on optimization of tissue culture system and regulation of essential oil yield of Thymus serpyllum L.[D]. Chongqing: Southwest University, 2016.
[13]王玲,杨丽鹏,张秀珍,等.东北百里香组培再生体系的建立[J].园艺学报,2011,38(6):1185-1190.
WANG L, YANG L P, ZHANG X Z, et al.The establishment of the adventitious bud regeneration system of Thymus mandschuricus[J]. Acta Horticulturae Sinica, 2011, 38(6): 1185-1190.
[14]赵庆臻,闫华超,程霜,等.地椒的组织培养及植株再生[J].植物生理学通讯, 2002, 38(4):357.
ZHAO Q Z, YAN H C, CHENG S, et al. The tissue culture and plant regeneration of ground pepper[J]. Plant Physiology Communications, 2002, 38(4):357.
[15]李晓东,徐世千,鲁朝辉,等.苯丙氨酸和茉莉酸甲酯对百里香离体培养芽生长及其精油的影响[J].香料香精化妆品,2014,42(2): 1-6.
LI X D, XU S Q, LU Z H, et al. Study on the effects of phenylalanine and methyl jasmonate on profile of essential oil from tissue culture of Thymus vulgaris L[J]. Flavour Fragrance Cosmetics, 2014, 42 (2): 1-6.
[16]徐治朋,李晓东,鲁朝晖,等.Cu2+对离体培养的红花百里香不定芽生长及挥发油的影响[J].西南大学学报(自然科学版),2016,38(5):37-44.
XU Z P, LI X D, LU Z H, et al. Effects of Cu(2+) on the growth of the adventitious buds of Thyme serpyllumin in vitro culture and their essential oil[J]. Journal of Southwest University (Natural Science Edition), 2016, 38(5): 37-44.
[17]罗彩霞,田永强,潘彦彪.百里香研究进展[J].安徽农业科学,2014,42(33):11669-11672.
LUO C X, TIAN Y Q, PAN Y B. Research progress of Thymus[J]. Journal of Anhui Agricultural Sciences, 2014, 42(33): 11669-11672.
[18]穆丹,梁英輝.佳木斯地区百里香的引种栽培及园林应用研究[J].安徽农学通报,2013,19(16):31-32.
MU D, LIANG Y H. Introduction and landscape application of Thyme in Jiamusi region[J]. Anhui Agricultural Science Bulletin, 2013, 19(16): 31-32.
[19]李艳霞,刘忠玲,刘建明,等.树莓品种“波拉纳”组培繁殖体系建立[J].森林工程,2018,34(2):26-29.
LI Y X, LIU Z L, LIU J M, et al. Establishment of tissue culture and propagation system for raspberry (Rubus idaeus) cultivar "Polana"[J]. Forest Engineering, 2018, 34(2): 26-29.
[20]李琳,杜倩,梁素钰.黑果枸杞无菌苗愈伤组织诱导体系的建立[J].林业科技,2018,43(06):1-3.
LI L, DU Q, LIANG S Y. Establishment of callus induction of non-bacterial seedling of lycium ruthenicum[J]. Forestry Science & Technology, 2018, 43(6):1-3.
[21]覃杰明,何含杰,张党权,等.6-BA和GA3对盐胁迫下红杆铁皮石斛幼苗生理生化影响[J].亚热带植物科学, 2016, 45(1):27-31.
QIN J M, HE H J, ZHANG D Q, et al. Physiological and biochemical influences of 6-BA and GA3 on red-stem dendrobium officinale under salt stress[J]. Subtropical Plant Science, 2016, 45(1): 27-31.
[22]李学东,华帅,刘长安.NAA与6-BA对黑金丝柚木组织培养的影响[J].亚热带植物科学,2017,46(4):379-382.
LI X D, HUA S, LIU C A, Effects of NAA and 6-BA on tissue culture of Tecton grandis[J]. Subtropical Plant Science, 2017, 46(4): 379-382.
[23]张虎,巫建新,许建民,等.6-BA与ZT对芫花茎段外植体组织培养的影响[J].江苏林业科技,2018,45(4):29-32.
ZHANG H, WU J X, XU J M, et al. Effects of 6-BA and ZT on the tissue culture of Daphne genkwa segment explant[J]. Journal of Jiangsu Forestry Science & Technology, 2018, 45(4): 29-32.

