逆境胁迫下植物体内活性氧代谢及调控机理研究进展
刘 聪,董腊嫒,林建中,刘选明
(湖南大学生物学院植物功能基因组学与发育调控湖南省重点实验室,中国湖南长沙410082)
植物不可避免地会遭受到各种不良环境胁迫,尤其是一些重要粮食和经济作物,每年都会因为各种不利环境因素造成巨大的经济损失[1]。为了应对多种不利环境因素(如高温、低温、干旱、高盐和病虫害等),植物进化出了一系列生理生化机制来响应各种环境胁迫。植物体内存在许多感受不同逆境信号的受体,参与各种逆境胁迫响应,并形成一个复杂的响应和调控网络以应对逆境胁迫[2]。为了更好地理解植物的抗逆性机制和提高植物的适应性,筛选和鉴定一个通用的受体或者信号分子至关重要[1]。近年来研究发现,活性氧(reactive oxygen species,ROS)急剧增加是植物面临各种逆境胁迫时的一个共同表现,表明ROS在植物逆境响应中起着十分重要的作用(图1)[3~4]。
ROS主要包括超氧阴离子(O2·-)、过氧化氢(H2O2)、羟基自由基(·OH)和单线态氧(1O2)等,一直被认为是有氧代谢带来的有毒副产物[5]。光合作用和呼吸作用等有氧代谢不可避免地会在叶绿体、线粒体和过氧化物酶体中产生ROS,细胞质膜和质外体也是植物响应各种胁迫信号后产生ROS的重要场所[6]。研究发现,ROS在植物体内具有双重功能,其角色的转变依赖于其在植物体内的浓度。低浓度时,ROS作为植物体内一类重要信号分子,参与调节植物的生长发育和逆境胁迫响应;当浓度超过细胞所能承受的限度时,ROS就变成了细胞杀手。在正常条件下,细胞内ROS会处于较低水平。当干旱、高温等胁迫发生时,植物因气孔关闭而限制了二氧化碳的摄取,使得光呼吸过程中电子传递受阻,从而产生大量单线态氧和H2O2[3]。过量积累的ROS会影响蛋白质、脂质甚至核酸的功能,从而导致细胞损伤乃至死亡[7]。
因此,植物体内存在一系列调节机制,以维持ROS动态平衡,既要维持适量的ROS调节正常的生长发育,又不能任其积累而产生毒害,以至于杀死植物[8]。近年来在ROS代谢及其调节机制研究方面取得了很大的突破,但仍然存在许多生理及分子进程需要进一步探索。尤其是逆境下ROS动态平衡调节与植物抗逆性之间的关联性及其调节机制的解析,将有助于我们改良和培育作物新品种,维持作物的稳产或高产。本文对近年来植物在逆境下ROS的代谢及调控机制研究进行了综述,并对相关研究提出了进一步的展望。
1 逆境下ROS产生及其调节机制
通常ROS被认为是有氧代谢的副产物,其产生的主要部位是线粒体和叶绿体中的电子传递链。当电子传递到氧(O2)时,就会产生ROS,而且逆境胁迫会加剧ROS积累[9]。Mittler等[2]总结了植物体内ROS产生的10种方式,包括光合作用及呼吸作用电子传递链、NADPH(nicotinamide adenine dinucleotide phosphate)氧化酶、光呼吸作用、胺氧化和细胞壁损伤过氧化物酶等。其中锚定在细胞膜上的NADPH氧化酶,也被称作呼吸爆发氧化酶(respiratory burst oxidase homologues,RBOHs),在ROS产生中起着关键作用[10]。
研究表明,植物RBOHs的结构与其ROS产生能力紧密相关[10~11]。其C端含有FAD(flavin adenine dinucleotide)和NADPH结合结构域,以及与哺乳动物NADPH相类似的6次跨膜结构域[12]。与哺乳动物不同的是,植物中RBOHs的N端包含一个钙离子(Ca2+)结合的EF-hand结构域和一个可以磷酸化修饰的位点,它们对RBOHs的ROS产生能力起着关键调节作用[13]。当RBOHs被激活以后,会产生大量的超氧阴离子(O2·-),随后O2·-在超氧化物歧化酶(superoxide dismutase,SOD)催化下形成H2O2。这类由细胞膜产生的H2O2,可以作为重要的信号分子参与细胞生长发育和逆境响应过程[14]。拟南芥RBOHs的ROS产生能力的调节机制主要为蛋白质磷酸化修饰调节、Ca2+调节和Ca2+依赖的蛋白激酶调节[13~15]。植物受到外界刺激时,细胞内Ca2+浓度会因细胞外Ca2+内流而迅速升高,升高的Ca2+会和RBOHs的Ca2+结合位点结合,从而激活其ROS产生活性[16]。在脱落酸(abscisic acid,ABA)依赖的气孔关闭过程中,RBO-HF(respiratory burst oxidase homolog protein F)的13和174号位点的丝氨酸残基被激酶OST1(open stomata 1)磷酸化,被磷酸化后的RBOHF产生ROS的能力提高,可改善拟南芥对干旱胁迫的耐受能力[17]。近期研究发现,ROBHF产生ROS的活性还受到Ca2+依赖的CBL1/9-CIPK26(calcineurin B-like 1/9-CBL-interacting protein kinase 26)复合体的直接调节[13]。在水稻中,一个类似于哺乳动物Rac的蛋白质OsRac1能够和OsRBOHB(respiratory burst oxidase homolog protein B)的EF-hand结构域结合,并可通过激活后者的ROS产生活性,调节水稻的防御反应[18]。
图1 植物中ROS与逆境之间的关系Fig.1 The relationship between ROS and stresses in plants
RBOHs并不是ROS的唯一来源,植物中还存在着其他ROS产生途径,主要是一些响应逆境胁迫的氧化酶。其中,草酸氧化酶(oxalate oxidase)参与植物根细胞对干旱胁迫响应时的ROS产生过程[19];过氧化物酶(peroxidase,PRX)在植物响应逆境胁迫后的ROS产生中扮演重要角色,如拟南芥PRX33和PRX34主要参与植物防御反应中ROS的产生[20]。在拟南芥中,酪氨酸受体激酶EFR(EF-TU RECEPTOR)在感受到外界病虫害入侵时,能通过磷酸化和去磷酸化调节体内ROS产生相关酶类的活性,促进细胞内ROS积累,从而激活体内的防御反应[21]。这些酶的不同响应方式,使得植物在不同胁迫下产生ROS的种类也不尽相同,有助于植物分辨不同类型的胁迫信号,以作出相应响应。
2 逆境下ROS清除及其调节机制
ROS在植物生长发育中扮演着十分重要的角色,正常条件下浓度较低,主要作为信号分子调节植物的生长发育;当植物受到逆境胁迫时,体内ROS会急剧积累,而高浓度ROS会直接影响细胞的正常发育[9]。为了维持细胞内ROS平衡,使之处于无害的浓度,植物进化出了一系列酶促和非酶促的ROS清除机制。参与酶促ROS清除过程的酶有超氧化物歧化酶(SOD)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)、谷胱甘肽S-转移酶(glutathione S-transferase,GST)、谷胱甘肽还原酶(glutathione reductase,GR)和过氧化物酶(PRX)。参与非酶促ROS清除过程的主要是一些抗氧化物质,包括抗坏血酸(ascorbic acid,AsA)、谷胱甘肽(glutathione,GSH)、维生素 E(α-tocopherol)和类黄酮(flavonoid)等[22]。当受到逆境胁迫时,植物可以通过一系列生理生化机制调节这些酶类的活性或者抗氧化类物质的量,从而清除植物体内过量积累的ROS,提高植物抗逆性。
2.1 磷酸化修饰对逆境下ROS清除的调控
蛋白质翻译后水平修饰是调节蛋白质功能和稳定性的主要手段,在植物的逆境快速响应中发挥重要功能。磷酸化修饰是蛋白质修饰的主要方式,通过激酶(kinase)和磷酸酶(phosphotase)对目标蛋白质的丝氨酸/苏氨酸或酪氨酸残基分别进行磷酸化和去磷酸化,从而影响目标蛋白质的构象和功能,在细胞信号转导中起着分子开关作用。在拟南芥中,当受到干旱胁迫时,Ca2+依赖蛋白激酶CPK8(calcium-dependent protein kinase 8)能够将过氧化氢酶CAT3的261号位点丝氨酸残基(Ser261)磷酸化,激活CAT3的酶活性,从而将因干旱胁迫诱导产生的过量H2O2清除,提高拟南芥耐旱性[23]。有趣的是,在人体细胞内也存在类似机制,内皮素-1(endothelin-1,ET-1)能够促进蛋白激酶 Cδ(protein kinase Cδ,PKCδ)磷酸化 CAT的167号位点丝氨酸残基(Ser167),并激活CAT的酶活性,降低内皮细胞内积累的过量H2O2,从而提高肺动脉内皮细胞的抗剪切力[24~25]。最近,我们在水稻中发现了一个正调控耐盐性的类受体胞质激酶STRK1(salt tolerance receptor-like cytoplasmic kinase 1),其过表达水稻株系在苗期和生殖生长期的耐盐性显著提高,而其RNA干扰(RNA interference,RNAi)株系则对盐胁迫更加敏感。进一步分析发现,当受到盐胁迫时,STRK1将过氧化氢酶C(CatC)的210号位点酪氨酸残基(Tyr210)磷酸化,并激活CatC的酶活性,清除因盐胁迫诱导积累的过量H2O2,以维持体内ROS平衡,从而提高水稻耐盐性[26]。近年来研究发现,虽然蛋白质的酪氨酸磷酸化修饰非常稀少,但是其在植物生长调节剂[主要为油菜素内脂(brassinosteroid,BR)]和免疫响应及信号转导方面起着非常重要的作用[27]。值得指出的是,STRK1是迄今植物中发现的唯一能将CAT的酪氨酸残基磷酸化的酪氨酸激酶。因此,我们推测在植物中也存在一条类似BR和免疫信号转导的酪氨酸级联磷酸化的盐胁迫信号转导通路。Tsang等[28]发现超氧化物歧化酶1(SOD1)的活性也受到磷酸化修饰调节,其39号位点丝氨酸残基(Ser39)被mTORC1(mammalian target of rapamycin complex 1)复合体磷酸化,磷酸化的SOD1酶活性显著提高,可以清除过量的ROS以维持体内ROS平衡。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)在细胞内的信号传导中扮演着十分重要的角色,在ROS代谢中也发挥着重要作用。在拟南芥中,MPK3和MPK6能够将ERF6(ethylene-responsive element binding factor 6)磷酸化,增加ERF6的稳定性,而ERF6可进一步促进抗氧化相关基因的表达,提高植物抵抗生物和非生物胁迫的能力[29~30]。此外,一些研究表明,植物体内磷酸酶的表达水平和功能也会受到ROS调节[31],说明磷酸酶也会参与到ROS清除代谢调节中去,但其具体调节机制有待进一步研究,而且也是将来研究的一个重要方向。
2.2 其他翻译后修饰参与ROS的清除调节
泛素化修饰是体内蛋白质翻译后修饰的一种重要手段,它对蛋白质的定位、调节和降解都起着重要作用[32]。Cao等[33]发现人的CAT可以被泛素化修饰,而且该过程还受磷酸化调节。当CAT的231号和386号位点酪氨酸残基被激酶复合体c-Abl/Arg磷酸化后,可以促进CAT的泛素化途径降解,导致胞内H2O2含量升高,加速细胞凋亡。在非酶促ROS清除机制中,抗坏血酸作为一种重要的抗氧化物质,其合成关键酶鸟苷-甘露糖焦磷酸化酶(GDP-Man pyrophosphorylase 1,GMP1)的稳定性也受到泛素化调节。Wang等[34]发现拟南芥的光形态建成因子CSN5B(COP9 signalosome subunit 5B)能够和VTC1(vitamin C defective 1)互作,促进VTC1的泛素化降解,减少抗坏血酸合成,使植株的ROS清除能力降低,表现出对盐胁迫更为敏感。除此之外,其他蛋白质修饰方式也参与了ROS的清除调节,如SUMO化、氧化修饰、棕榈酰化等也能影响相关蛋白质的酶活性或者定位,从而调节体内ROS动态平衡[35~36]。同样,我们在研究STRK1通过磷酸化CatC而参与H2O2动态平衡及耐盐胁迫调控的分子机制时发现,STRK1通过N端5、10和14号位点的半胱氨酸残基棕榈酰化修饰而定位于细胞质膜,其过表达株系表现出较强的耐盐性;当把N端5、10和14号位点的半胱氨酸突变为丙氨酸时,突变的STRK1无法被棕榈酰化而定位于细胞质中,其过表达株系的强耐盐性消失[26]。该结果表明,STRK1通过磷酸化CatC参与H2O2动态平衡的调控过程也受到棕榈酰化修饰的调控。有意思的是,除了磷酸化、泛素化和棕榈酰化等蛋白质水平的修饰外,Li等[37]发现在拟南芥中还存在着一种含环指结构域的蛋白质NCA1(no catalase activity 1),其可类似分子伴侣蛋白一样与CAT2结合,并通过构象改变增加CAT2的稳定性和酶活性,从而提高植株的逆境胁迫耐受能力。在水稻中,人们也发现了类似的调控方式,在逆境胁迫下,乙醇酸氧化酶(glycolate oxidase,GOX)会与CAT分离,降低CAT的活性,促进体内H2O2的积累,从而激活体内的防御反应[38]。这种类似于分子伴侣的蛋白质通过改变目标蛋白构象来参与胁迫响应的方式,为植物耐逆性分子机制研究提供了一种新思路。
2.3 转录因子影响ROS清除基因的表达
转录因子在植物逆境响应中扮演着十分重要的角色,通过对ROS相关数据进行分析发现,拟南芥中有1 500多个转录因子对单线态氧、H2O2、羟基自由基等ROS有响应[39]。ROS主要通过提高转录因子表达量、增加转录因子稳定性、增强转录因子结合DNA能力等方面调节转录因子的功能,进一步调节逆境响应相关基因表达,改善植物抗逆性[40]。例如:水稻中转录因子OsNAC2(NAC domain containing protein 2)能够结合到ROS清除基因OsCOX11(cytochrome c oxidase 11)的启动子上并促进其转录,大量表达的OsCOX11能够清除逆境下积累的ROS,提高水稻的盐胁迫耐受能力[41]。Zhao等[42]发现高温能够诱导过氧化氢酶基因表达,清除高温下过量积累的ROS,提高水稻对高温胁迫的耐受能力。此外,近期研究发现,Osa-miR398b能够直接调节SOD基因的转录水平以调节水稻体内ROS动态平衡,改善水稻对病虫害的抗性[43]。拟南芥ARR2(response regulator 2)在受到胁迫时,可以直接调节PRX33和PRX34表达水平,以提高植物抵抗病原菌入侵的能力[44]。在逆境胁迫下,植物会通过调节体内甲基转移酶的活性来改变植物基因组DNA甲基化程度,而DNA甲基化程度又能够影响相关基因的转录表达,最终影响植物的抗逆性[45]。
综上所述,植物在受到逆境胁迫时,可以通过调节体内一系列抗氧化蛋白质的活性和表达水平,来清除逆境胁迫下产生的大量ROS,保护植物免受氧化伤害,从而提高植物抗逆性(图2)。近年来,尽管逆境下ROS的产生、清除及其相关调节机制得到一定程度的了解,但是其更为精细的调节机制和调控网络还有待进一步解析。
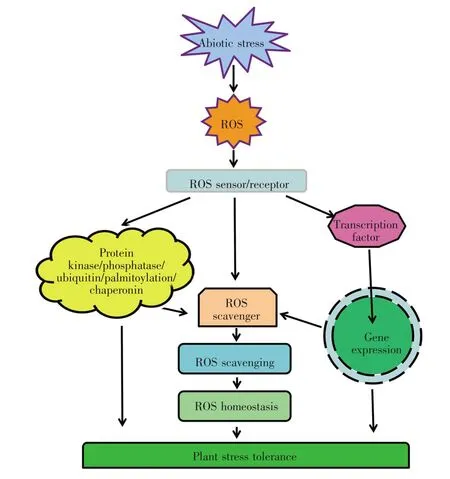
图2 植物逆境胁迫中ROS动态平衡的调节Fig.2 Regulation of ROS homeostasis in plants under stresses
3 结语与展望
ROS既是有氧代谢的有毒副产物,又是细胞内十分重要的信号分子,适当浓度的ROS是植物生长发育所必需的;但是,在逆境胁迫下,植物体内的ROS会大量积累,影响细胞内正常的生理生化进程,甚至杀死细胞。同时,ROS也作为一个胁迫信号激活体内抗氧化防御系统,调节抗氧化酶类的表达水平和酶活性,或者改变抗氧化物质的量,从而消除过量积累ROS的不利影响,保护植物并提高植物的抗逆性。对逆境胁迫下ROS调节机制的解析,可以有助于我们理解植物抵抗逆境胁迫的分子机制,从而用以改善甚至改良植物尤其是作物的抗逆性,同时为分子育种提供新的耐逆性分子标记,为作物新品种培育提供理论依据。

