第27 届国际生物学奥林匹克竞赛试题实验3·生物化学与微生物学
范六民 戴俊彪 张 立 陶若婷 张雁云
(1 北京大学生命科学学院 北京 100871 2 清华大学生命科学学院 北京 100084 3 北京师范大学生命科学学院 北京 100875 4 北京十一学校 北京 110000)
总分:100 分;时间:90 min。
本次考试包括下列3 个实验
实验1:蛋白的表达、纯化和鉴定(40 分)
实验2:咖啡提取物的抗氧化活性(30 分)
实验3:乳酸发酵(30 分)
请注意以下内容:
·请把答案填写在答题卡上。
·请检查所有的材料和设备, 确定你已经收到所有列出的材料和设备。
·实验过程中,请正确使用仪器设备。任何溅洒的试剂和损坏的仪器都无法再次获得。
·实验1 中的凝胶电泳不得在最后30 min内完成,建议你首先开展实验1。
·在实验2 中, 请注意获取分光光度计上的读数,否则无法回答该问题。
材料和设备
设备和用于3 个实验的材料:

名称 数量P1000 微量移液器(100~1 000 滋L) 1件P200 微量移液器(20~200 滋L) 1件P20 微量移液器(2~200 滋L) 1件用于P1 000 微量移液器的枪头 1盒用于P20 和P200 微量移液器的枪头 1盒去离子水(dH2O) 1瓶微量试管(EP 管)架 1件用于液体废物存放的圆形塑料容器(废液) 1件用于固体废物存放的方形塑料容器(固体废物) 1件计时器 1件手套 1副卫生纸 1盒胶1管学生条码标签 5件红牌 1件绿牌 1件计算器 1件记号笔 1件防护眼镜 1件
用于实验1:
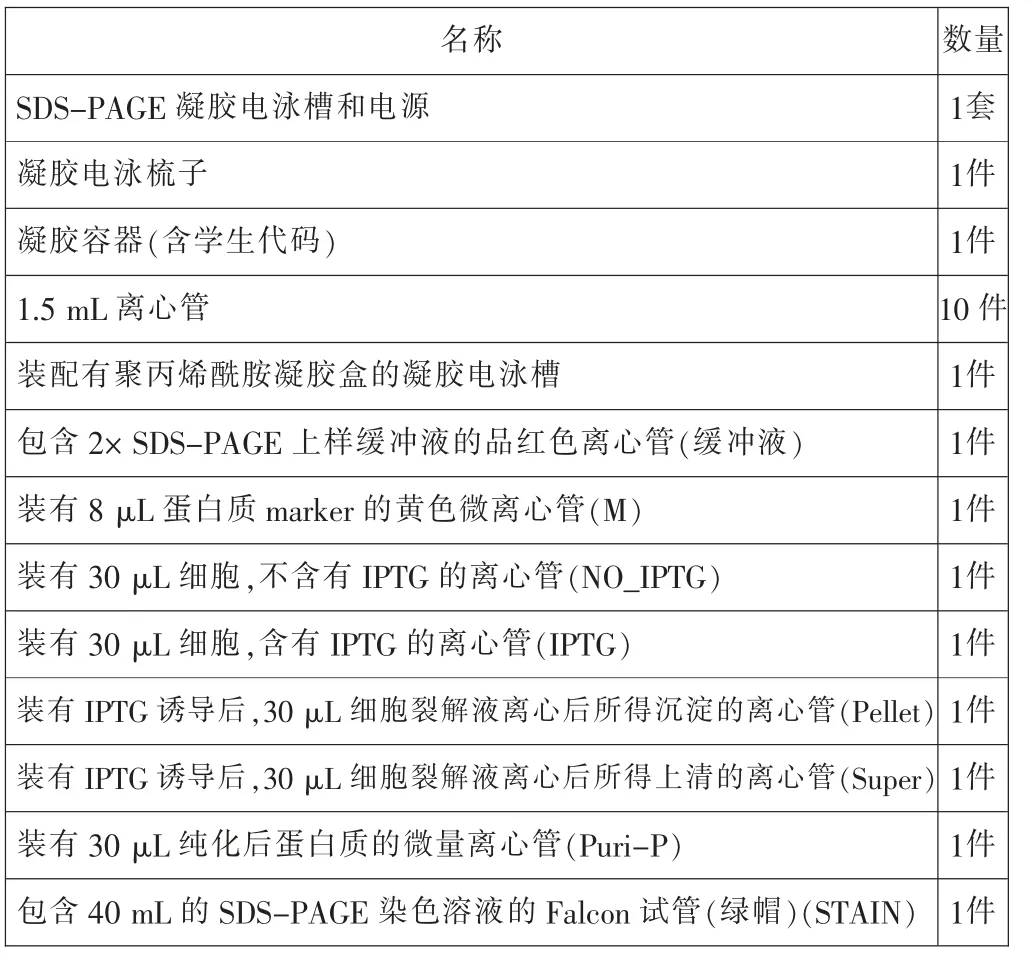
名称 数量SDS-PAGE 凝胶电泳槽和电源 1套凝胶电泳梳子 1件凝胶容器(含学生代码) 1件1.5 mL 离心管 10 件装配有聚丙烯酰胺凝胶盒的凝胶电泳槽 1件包含2× SDS-PAGE 上样缓冲液的品红色离心管(缓冲液) 1件装有8 滋L 蛋白质marker 的黄色微离心管(M) 1件装有30 滋L 细胞,不含有IPTG 的离心管(NO_IPTG) 1件装有30 滋L 细胞,含有IPTG 的离心管(IPTG) 1件装有IPTG 诱导后,30 滋L 细胞裂解液离心后所得沉淀的离心管(Pellet) 1件装有IPTG 诱导后,30 滋L 细胞裂解液离心后所得上清的离心管(Super) 1件装有30 滋L 纯化后蛋白质的微量离心管(Puri-P) 1件包含40 mL 的SDS-PAGE 染色溶液的Falcon 试管(绿帽)(STAIN) 1件
用于实验2:

名称 数量带有学生代码的96 孔板(请勿触碰板的底部) 1件包含300 滋L,1 mg/mL 抗坏血酸溶液的蓝色离心管(AA) 1件包含300 滋L,5 mg/mL 咖啡提取物的蓝色离心管(CC) 1件包含15 mL,0.2 mnol/L DPPH 溶液的棕色瓶(DPPH) 1件
用于实验3:

?
实验1 蛋白质的表达、纯化和分析(40 分)
介绍:H 和B 蛋白质是气单胞菌(Aeromonas hydrophilas)的2 个重要蛋白。为了研究它们,科学家希望在大肠杆菌中共同表达它们。因此,B 基因和H 基因分别被克隆到表达载体P1 的多克隆位点1(MCS-1)和多克隆位点2(图1.1)。 所得到的载体P1-b-h 被转化到大肠杆菌中,利用IPTG 诱导蛋白表达。然后通过亲和层析,利用镍柱纯化带有6xHis 标签的蛋白质。 最后通过SDS-PAGE,针对蛋白质分子量的大小, 对纯化后所获得的蛋白进行分析评价。 注意:H 的分子量比B 小。

图1.1 表达载体的P1 的总览图
带有P1-b-h 壳的大肠杆菌单菌落在50 mL的LB 培养基中,37℃培养至OD600为0.6。 为了分析重组蛋白的表达和纯化, 科学家已收集以下这几个细胞和蛋白样品:
·NO-IPTG:1 mL 培养液被转移到一个培养管中,在20℃生长16 h(OD600=2.4)后离心。 弃去上清液后将细胞沉淀重新悬浮于50 μL H20 中,加入50 μL 2× SDS-PAGE 上样缓冲液混合,得到100 μL 样品。
在剩余的49 mL 培养液中,添加IPTG。在20℃培养16 h,诱导蛋白表达。
·IPTG:取1 mL IPTG 诱导后的菌液(OD600=1.4)离心。 弃去上清液,将细胞沉淀重新悬浮于50 μL H20 中,然后加入50 μL 2× SDS-PAGE 上样缓冲液混合,得到100 μL 样品。
将剩余48 mL 培养液离心,弃去上清液并将细胞沉淀重悬于2 mL 缓冲液中;将细胞悬浮液裂解,并随后离心分离。 上清液和沉淀均需要收集。
·Pellet(沉淀):将IPTG 诱导后细胞裂解液离心所得的沉淀物重新悬浮于2 mL 缓冲液中,然后加入2 mL 2× SDS-PAGE 上样缓冲液 (沉淀储存液)混合。
·Super(上清):将10 μL,IPTG 诱导后的细胞裂解物中得到的上清液10 μL 2× SDS-PAGE上样缓冲液混合。
·Puri-P(纯化后的蛋白):剩余上清液加入到用于蛋白质纯化的镍柱。 纯化后的蛋白质用2 mL 洗脱缓冲液进行洗脱。取10 μL 洗脱所得的蛋白质与10 μL 2× SDS-PAGE 上样缓冲液混合。
将所有用于SDS-PAGE 分析的样品在100℃煮沸5 min。
设计SDS-PAGE 实验,分析蛋白的表达。
用于SDS-PAGE 分析的总蛋白标准终浓度必须相当于5×l06个细胞/μL。 首先,计算每个样品中的细胞浓度。 OD600值为1 相当于知8×108个细胞/mL。 请考虑操作过程中各样品的稀释度。
问题1.1 (6 分)
计算并在下表中填写样品的体积(μL)。 用一位小数。

管1 管2 管3 管4 管5 管6样品 蛋白marker NO-IPTG IPTG Pellet SuerPuri-P储液(μL) 5 14.9 14.9 15 H2O(μL) 5 12.5 12.5 12.5 2× SDS-PAGE 缓冲液 10 12.6 12.6 12.5总体积(μL) 20 40 40 40 40 40
实验步骤
·根据上面的表格, 准备在提供空离心管所有SDS-PAGE 样品。 通过上下吹打4~5 次混匀各样品。
完成此步骤后,请举起绿卡。助手将引导你去上样区,并帮助将你的学生代码粘贴到电泳槽上。
·将每个样品点样20 μL 到SDS-PAGE 胶上,必须按管1~6 的顺序上样。 为上样,请使用P20移液器和枪头吸取20 μL 样品, 并小心地将枪头置于加样孔的顶部(1.2)。

图1.2 在SDS 凝胶样品装载
·实验助理将运行SDS-PAGE 20 min。 他会告知你设置定时器20 min。
在SDS-PAGE 进行过程中你可以做另一项实验。 20 min 后, 请举起绿卡, 通知助理将SDSPAGE 凝胶返还给你。
·如图所示(图1.3),将塑料盒中的SDS-PAGE凝胶用凝胶梳子打开,将凝胶放到胶容器中。

图1.3 从凝胶盒中取出SDS-PAGE 凝胶操作示意图
步骤1)将梳子插入凝胶盒各个槽口,转动梳子把凝胶盒撬动。从顶部的槽口开始,沿着盒的每一侧向下移动。
步骤2)当两侧打开后,将梳子放置在斜边底角板之间的45 度角,用力扭转。
步骤3)轻轻将2 个盒分开。
·在凝胶容器摇加入40 mL 的染色溶液(STAIN),放置在摇床上转动染色10 min。
·将凝胶容器中的染色溶液倒入废液桶,使用去离子水清洗凝胶3 次。
完成上述操作后,举起绿卡,请助理帮助拍取凝胶照片。
问题1.2 SDS-PAGE 结果(10 分)
得到SDS-PAGE 凝胶照片后, 将其粘贴在答题卡指定的地方。
问题1.3 (4 分)
基于图1.4A 提供的资料,将至少5 个标记蛋白,根据它们的分子量和相对迁移的Rf 值,在答题卡规定的图形文件上取点作图 (Rf=蛋白质迁移距离/染料前端迁移距离)。

图1.4 蛋白marker(A)和方格纸(B)
问题1.4 (4 分)
利用问题1.3 中的图标及SDS-PAGE 胶图,分别估算蛋白H 和B 的分子量。
问题1.5 (4 分)
基于SDS-PAGE 结果, 判断下列陈述的对和错。 在答题卡上用“√”表明正误。
A. H 蛋白在含有IPTG 的LB 培养基中是过表达的
B. B 蛋白在镍柱结合缓冲液中是完全可溶的
C. H 和B 蛋白相互作用
D. 大部分的重组蛋白被结合到了镍柱上
问题1.6 (4 分)
根据P1 表达载体(图1.5)的详细酶切图谱,判断下列陈述的对错。 在答题卡上用“√”表明正误。
以下陈述正确的打“√”,错误的打“×”。
A. Sal I 和Bam HI 可以用于将b 基因插入到MCS-1
B.为了能同时进行表达,基因h 和b 应以相同的转录取向进行克隆
C.为了能同时进行表达,基因h 和B 要位于同一开放阅读框中
D.为了维持质粒在细菌中的稳定存在,必须在培养基中添加氨苄青霉(ampicillin)
为了表征H 和B 蛋白的寡聚状态,准备如下3 个蛋白样品:1)H 蛋白;2)从上述实验中得到的H 和B 蛋白;3)B 蛋白。 样 品1 和样品2 是透明的,但样品3 中大部分蛋白质发生沉淀。 将样品1和样品2 分别通过凝胶过滤柱。 所获得的蛋白分离谱如图1.6A 所示。不同大小参照分子在凝胶过滤柱上的分离如图1.6B 所示。

图1.5 P1 表达载体详细的限制性图谱

图1.6 H 和B 蛋白的凝胶过滤分析
问题1.7 (4 分)
计算样品1 和样品2 中, 蛋白所对应凝胶过滤峰的相对大小,填写在下表中。
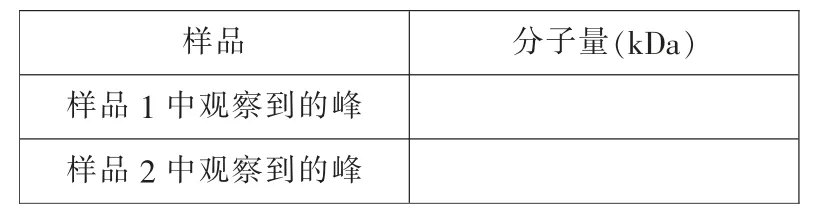
样品 分子量(kDa)样品1 中观察到的峰样品2 中观察到的峰
问题1.8 (4 分)
判断下列陈述的正确与错误。 在答题卡上用“√”表明正或误。
A. H 蛋白以单体的形式存在
B. H 和B 可能以异源二聚体形式存在
C. H 蛋白有助于B 蛋白的稳定存在
D. 在非变性凝胶过滤柱分析中,一个蛋白质的保留时间和它们的分子量大小成正比
实验2 咖啡提取物的抗氧化活性(30 分)
介绍:生物氧化产生活性氧自由基,可造成细胞严重损坏。抗氧化剂是能清除自由基,从而抑制氧化反应的分子。 抗氧化剂包括还原剂如硫醇化合物,抗坏血酸及酚醛等。咖啡通过烘焙咖啡豆制备,是抗氧化剂的一个潜在来源。
在2,2-diphenyl-l-picrylhydrazyl(DPPH)清除实验中,DPPH 的量被不断减小, 从而失去其紫色。SC50值(清除能力)通常用于抗氧化活性的评估。 此值表示清除50%的DPPH 自由基所需样品的浓度。
DPPH 吸收率可以在517 nm 波长处测定。 假设空白的吸光度可忽略不计。 对照组(无清除剂,Ac)和样品(As)的吸光度将用于计算不同浓度样本的清除率(SC%):
SC(%)=(Ac-As)×l00/Ac
根据一系列样品中不同浓度和相应的清除百分比的对数,可以做图并从中计算获得SC50值。
本实验将研究一个越南咖啡品种(Coffea canephora)的抗氧化活性。 咖啡豆粉混合物(1 g)在80℃下,悬浮于去离子水中30 min,然后过滤。 加入去离子水,将萃取液的总体积定量为200 mL。
实验步骤和问题:

图2.1 96 孔微量培养板
上面的96 孔微量培养板可用于开展系列稀释实验。 微孔板上孔的位置由一个代表行的字母(A~H)和一个代表列的数字(1~12)表示。
·使用微量移液器制备4 个抗坏血酸溶液(AA1-AA4, 分别位于A1-A4 孔中) 和4 个咖啡萃取液溶液(CC1-CC4,分别位于A6-A9 孔中)。每个溶液都是2 倍稀释。 抗坏血酸和咖啡提取液最低浓度分别是0.025 mg/mL 和0.625 mg/mL。每个孔中的溶液在稀释前都是200 mL。
注意:如果在加样过程中不慎发生错误,可以将抗坏血酸溶液和咖啡萃取液溶液分别放置到孔H1-H4(AA1-AA4)和H6-H9(CC1-CC4)。
问题2.1 (4 分)
将你准备抗坏血酸和咖啡提取物的稀释计算填入下表中。

稀释液 AA1 AA2 AA3 AA4 CC1 CC2 CC3 CC4用于稀释溶液的体积(滋L)H2O(滋L)的体积浓度(mg/mL) 0.025 0.625
·从行A 各个孔内的抗坏血酸溶液和咖啡提取物溶液中分别移取20 滋L, 放置到行B、C 和D的相应孔内。如果在此步骤中不慎发生错误,可在行E、F 和G 中重复上述操作。
·在孔B11、C11 和D11 中各加入20 滋L 水。
·在步骤2 和3 中准备的孔内,各加入180 滋L的DPPH 溶液。
·将盖子盖好96 孔板,在室温下孵育10 min。请设置定时器计时。
完成此步骤后,请举起绿卡。请助理帮助你用酶标仪测定吸光度,并返回你打印好的输出数据。
问题2.2 (5 分)
计算抗坏血酸和咖啡萃取物浓度的对数值(log10),并填入答题卡上的表格内(所有数字四舍五入至2 位小数)。 你可根据下列步骤,使用计算器计算对数值:
·按ON 键,打开计算器。
·按4 个键:“SHIFT”键、“CLR”键、“2”键、“=”键返回到计算模式。
·按“log”键。
·输入数字。
·按“=”键。
计算每个稀释的平均吸光度、 每个样品的清除率并填入下表。

溶液 对照AA1 AA2 AA3 AA4 CC1 CC2 CC3 CC4 Log10 浓度(mg/mL)平均吸光度SC%
问题2.3 (5 分)

Log10 浓度(mg/mL)
使用计算值, 在答题卡上给出的网格线中绘制清除率对应抗坏血酸浓度的对数(log10)的线性曲线。
问题2.4 (5 分)
计算抗坏血酸和咖啡提取物的SC50值,并填入答题卡上表格中(你可以利用问题2.3 中的格子对咖啡萃取液作一条线性曲线,但该曲线并不算分)。

抗坏血酸 咖啡萃取物SC50
问题2.5 (3 分)
使用相同的方法, 某2 个咖啡品种提取物的SC50的值如下:

咖啡提取物 SC50 X 3.8 mg/mL Y 2.6 mg/mL
比较包括本实验中咖啡豆(Z)的抗氧化活性,依据从强到弱的顺序, 把不同类型的咖啡豆填入下表的空格处。

>>
问题2.6 (4 分)
假设你在实验中发现不同稀释度的咖啡提取物和DPPH 混合物的吸光度非常接近, 差异可忽略不计。 请判断下列陈述是正确还是错误,用“√”表明。
A.稀释后的咖啡提取物的抗氧化活性可以忽略不计
B.为了更准确地测定抗氧化活性,需要利用更高浓度的样品进行另外的实验
C.咖啡提取物中存在的抗氧化酶的活性导致了上述结果
D.如果孔中存在NADH 污染,其结果将类似于上述假设
问题2.7 (4 分)
一个学生使用和你一样的方法(方法A)测定了一个样品的抗氧化活性。与此同时,他又使用了另一不同方法(方法A*)进行测量。他所得的结果如下:

方法A 方法A*SC50(mg/mL) 1.95 3.9
下列哪些变化可能导致更高的SC50值? 请判断下列陈述是正确还是错误,用“√”表明。
A.该学生在方法A*中可能使用了0.1 mm 的DPPH
B.该学生在方法A*中可能使用了10 μL 的样品
C.加入DPPH 后,该学生将96 孔板孵育的时间可能比方法A 中的短
D.该学生可能使用了对抗氧剂更好的溶剂
实验3 乳酸发酵(30 分)
介绍:近日,科学家分离出越南传统发酵芥菜同型酸乳酸杆菌菌株(Lactobacillus sp. VN156)。在该实验中, 乳酸杆菌VN156 在MRS 培养基中生长。 培养基的初始pH 为5.6。 在培养过程中的不同时间点取样, 测定细菌在600 nm 的光密度(OD)(图3.1)。 样品A0、A2、A3 和A5 是所收集菌液的上清液,将用于分析乳酸的浓度。

图3.1 乳酸杆菌VN156 的生长曲线
问题3.1 (3 分)
假设图3.1 表示生长的真实过程。 计算乳酸杆菌VN156 在指数生长期的增代时间(h),将数值填入答题卡中。
问题3.2 (3 分)
如果将1 mL,培养9 h 后的菌液稀释到新鲜的MRS 培养基中,计算培养6 h 后的细菌细胞数量,记录在答题卡中。
pH 计的校准。
使用便携式pH 计(图3.2)测量pH 值。
图3.2 便携式pH 计
步骤1)按照图3.3 中以下步骤校准pH 计。
·拨动ON/OFF 按钮,打开pH 计。
·取下保护盖,用清水冲洗电极尖,轻轻地用纸巾擦干。
·将电极头部浸入pH 值7.01 的缓冲溶液中。 确保电极末端完全浸没在溶液中(约2 cm 的末端在溶液中)。 等待读数稳定。
·用螺丝刀, 轻轻旋转pH7 微调螺丝, 直到屏幕上显示pH 值为7.01。
·用水冲洗pH 电极,轻轻地用纸巾擦干。
·将电极头部浸入pH4.01 的缓冲溶液中。等待读数稳定。
·用螺丝刀,轻轻旋转pH4/10 微调螺丝,直到屏幕上显示pH 值为4.01。
·校准完成。
·注意:如果你关闭pH 计,再次打开使用前应重新校准。
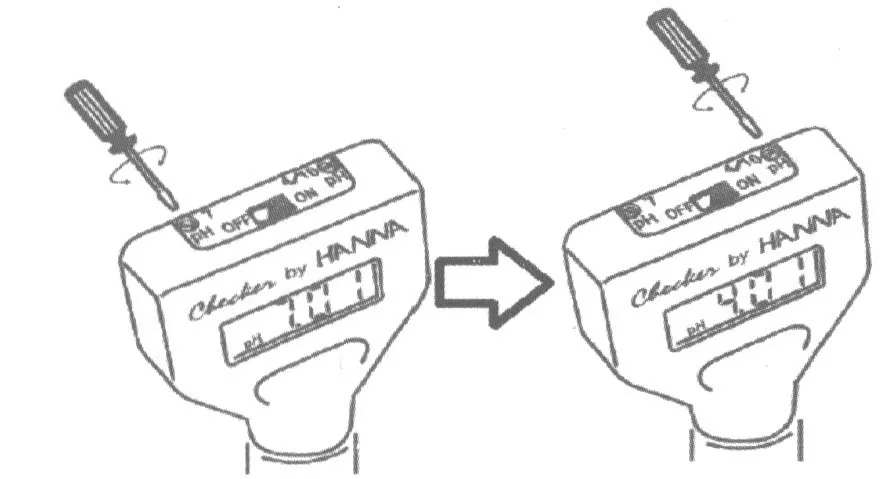
图3.3 校准pH 计
乳酸滴定:滴定是一种分析技术,可对溶解在溶液中的特定物质(分析物)进行定量测定。 它基于添加到溶液中、浓度已知的分析物和试剂(滴定剂)之间完全化学反应。 在这一部分实验中,将通过滴定方法,用0.1 mol/L 的氢氧化钠确定样品中的乳酸浓度,如图3.4 所示。

图3.4 滴定装置
问题3.3 (2 分)
根据问题3.2 的结果计算所需样品(mL)和水(mL)的体积,并填入下表中。
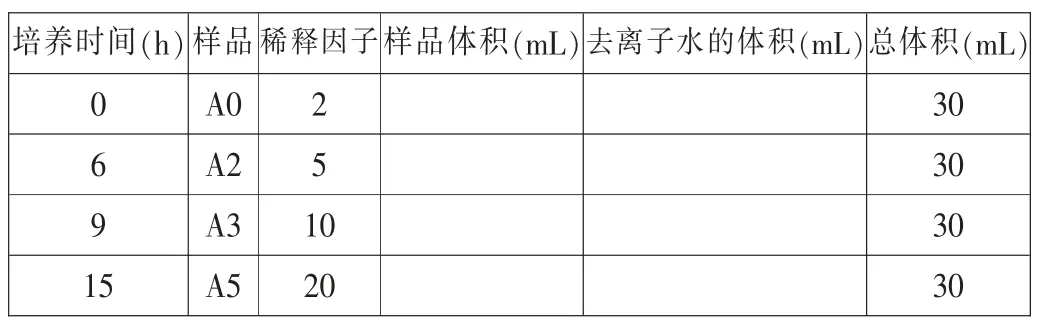
培养时间(h)样品稀释因子样品体积(mL)去离子水的体积(mL)总体积(mL)0 A0 2 30 6 A2 5 30 9 A3 10 30 15 A5 20 30
·根据你的计算,在100 mL 的烧杯中对每个样品配制稀释液。每个样品准备2 个重复样品。请使用25 mL 的量筒移取去离子水,使用微量移液器和10 mL 的量筒中移取样品。
·将一个磁性搅拌棒小心地放入稀释的样品溶液中。 夹紧pH 计,让电极末端处于溶液中(约2 cm 的末端浸没在溶液中), 同时保证在搅拌的过程中搅拌子不会碰到pH 电极。 开始进行缓慢搅拌并记录0.1 mol/L NaOH 溶液的起始体积。
·小心拧动滴定管的活塞,让NaOH 溶液从管中缓慢滴入烧杯里的样品中。 当pH 样品变为中性(6.95~7.05)时,停止加入NaOH。 记录0.1 mol/L NaOH 溶液的剩余终体积。
·每次滴定完成后, 小心地从溶液中取出pH电极,用清水冲洗。用钳子取出搅拌子并用水冲洗。
·针对每个样本,重复步骤2~5。
问题3.4 (9 分)
记录用于每个样品滴定的0.1 mol/L 氢氧化钠的体积,记录在下表中。

?
问题3.5 (10 分)
计算滴定每个样品,30 mL 储备所需0.1 mol/L NaOH 的平均体积。 计算每个样品中乳酸菌浓度。在下表中记录所有数据。

培养时间(h) 样品 滴定30 mL 储备样品用0.1 mol/L NaOH 的体积(mL)乳酸产量(g/L)0 A0 6 A2 9 A3 15 A5
问题3.6 (3 分)
基于图3.1,假设OD600=1 对应于细胞浓度2×108个细胞/mL。 细菌细胞的数量增加2×108个细胞/mL, 乳酸的浓度将增加1g/L。 如果培养11 h后的乳酸浓度为6 g/L,计算细菌细胞的数量(细胞/mL),并记录在答题卡中。

