间接竞争ELISA检测食品中的邻苯二甲酸二丁酯
尚淑娜 - 生 威 王璐璐 - 赵秋霞 - 王 硕 o
(1. 食品营养与安全国家重点实验室〔天津科技大学〕,天津 300457;2. 天津科技大学食品工程与生物技术学院,天津 300457)
邻苯二甲酸酯(PAEs)类塑化剂主要添加在塑料中,用来提高其柔软度及延展性[1-2],产量大、种类多,广泛存在于食品容器、玩具、乙烯基涂料、油漆和香水中[3]。邻苯二甲酸酯类塑化剂与塑料基质不以化学键结合,随着时间、温度和pH值等的影响,它会从塑料制品中不断迁移到环境或食品中,进而进入人体[4]。
邻苯二甲酸酯类塑化剂稳定性高,具有生物富集作用和雌激素效应,会干扰机体内正常的激素水平,可能会引起生殖系统异常致畸、致癌等。此外,邻苯二甲酸酯类塑化剂不易降解,会对环境造成污染,已成为全球普遍的污染物之一[5-7]。邻苯二甲酸二丁酯(DBP)是邻苯二甲酸酯类塑化剂中应用最广泛的一种,最容易从塑料包装膜中向被包装食品迁移,具有肝脏毒性和生殖毒性,会引发动物肝脏病变和精子畸变率增高[8-9]。中国2016年发布的GB 9685—2016《食品安全国家标准 食品接触材料及制品用添加剂使用标准》,要求邻苯二甲酸二丁酯生产的材料或制品不得用于接触脂肪性、乙醇含量高于20%的食品以及婴幼儿食品,最大残留量和特定迁移限量为0.3 mg/kg。GB 6675.1—2014中规定儿童玩具和儿童护理产品中邻苯二甲酸二丁酯(DBP)、邻苯二甲酸丁基苄酯(BBP)和邻苯二甲酸(2-乙基)己酯(DEHP)物质含量的总和不得超过0.1%。
对于邻苯二甲酸酯的检测,目前主要采用气相色谱法[10-12]、气相色谱—质谱法[13-14]、液相色谱法[15-16]、液相色谱—质谱法[17]等。这些仪器检测方法前处理过程较为繁琐,且仪器昂贵、耗时长、操作过程复杂,不适于样品的现场分析和大量样品的检测。相比较仪器方法而言,免疫分析方法具有灵敏度高、特异性好、成本低和易操作等特点。本研究拟以邻苯二甲酸二丁酯(DBP)为研究对象,以4-氨基邻苯二甲酸为原料,通过酯化反应合成半抗原4-氨基邻苯二甲酸二丁酯(DBAP),利用重氮化法合成免疫原,得到抗邻苯二甲酸二丁酯的抗体,进而建立间接竞争ELISA方法,用于检测食品中的邻苯二甲酸二丁酯。
1 材料和方法
1.1 材料与仪器
1.1.1 材料与试剂
4-氨基邻苯二甲酸:纯度95%,萨恩化学技术(上海)有限公司;
正丁醇、N,N-二甲基甲酰胺(DMF)、脱脂乳粉、乙酸乙酯、石油醚、甲醇:分析纯,国药集团化学试剂有限公司;
钥孔血蓝蛋白(KLH)、牛血清白蛋白(BSA)、弗氏完全佐剂、弗氏不完全佐剂:美国Sigma公司;
雄性新西兰大白兔:3月龄,体重1.5 kg,北京兴隆实验动物养殖场。
1.1.2 主要仪器设备
超纯水系统:Milli-Q Integral型,美国MILLIPORE公司;
洗板机:MTS 2/4 digital型,美国BIO-RAD公司;
酶标仪:F200 PRO型,美国Thermo公司;
蛋白纯化仪:731-8300型,美国BIO-RAD公司;
分析天平:BL610型,赛多利斯仪器(北京)系统有限公司;
紫外分光光度计:Evolution 300型,美国Varian公司;
气质联用仪:4000MS型,美国Varian公司。
1.2 试验方法
1.2.1 4-氨基邻苯二甲酸二丁酯(DBAP)的合成与鉴定
(1) 将4.5 g 4-氨基邻苯二甲酸加入到15 mL正丁醇中,超声20 min,在搅拌条件下缓慢加入浓硫酸至液体呈透明,120 ℃回流反应6~7 h。
(2) 减压蒸馏除去未反应的正丁醇和水2~3 h,反应完成后趁热倒入冰水中,用乙酸乙酯萃取水层,并用10%的Na2CO3调节pH至碱性,用分液漏斗分离,重复萃取,合并萃取液,旋蒸去除乙酸乙酯,得浅黄色固体。
(3) 将得到的浅黄色固体用硅胶板进行纯化。展开剂为体积比1∶3的乙酸乙酯—石油醚混合液,将所需要的条带刮下后加入乙酸乙酯浸泡、涡旋振荡,离心后,取有机相过0.22 μm有机膜,重复几遍后,合并所得到的有机相,旋蒸,最终得到淡黄色的固体,然后进行质谱鉴定。
1.2.2 人工抗原的合成与鉴定 取1.17 mg 4-氨基邻苯二甲酸二丁酯(DBAP)溶解于100 μL的DMF,加入到1 mL 0.1 mol/L预冷盐酸中,置冰浴中搅拌;逐滴加入1 mol/L 的NaNO2溶液(5~10 μL)至淀粉碘化钾试纸变成深紫色,继续避光搅拌30 min,加入尿素,使试纸不再显色;将20 mg KLH用2 mL碳酸钠缓冲液(pH=9.5)溶解,缓慢加入到上述重氮盐中,加入1 mol/L的氢氧化钠溶液,使溶液pH值维持在9.0~9.5,溶液逐渐变为橙红色。在4 ℃下避光搅拌反应3 h,PBS透析3 d,得到免疫抗原(DBAP-KLH)。同样按上述方法制得包被抗原(DBAP-BSA)。
用紫外分光光度法观察DBAP-KLH/BSA,DBAP和载体蛋白 KLH/BSA的特征吸收峰的变化情况,鉴定人工抗原是否成功偶联。
1.2.3 抗体制备与纯化 选取体重约1.5 kg的新西兰大白兔(3个月),采用皮下多点注射方式制备抗体。将等量的免疫原和弗氏完全佐剂乳化后进行初次免疫,在之后的加强免疫中使用弗氏不完全佐剂代替弗氏完全佐剂。每次免疫后7~8 d,耳静脉采血进行抗血清效价及特异性测定,在最后一次免疫后的8~10 d取全血,8 000 r/min 离心后分装冻存在-20 ℃冰箱,使用Protein A-Sepharose 4B柱对兔抗血清进行纯化,制得多克隆抗体。
1.2.4 间接竞争ELISA方法检测步骤 将DBAP-BSA包被抗原用磷酸盐缓冲液(PBS)稀释至一定浓度后,96孔酶标板每只孔中加入100 μL,4 ℃过夜(12~14 h)或37 ℃放置3 h,洗板3次,在滤纸上拍干;每孔加入200 μL 封闭液,37 ℃放置1 h,洗板3次,拍干;加入50 μL DBP标准溶液或者待测样品和50 μL一定稀释倍数的抗体,37 ℃孵育1 h,洗板4次,拍干;加入100 μL/孔酶标二抗(HRP-羊抗兔IgG),37 ℃ 孵育30 min,洗板5次,拍干;每孔加入100 μL的底物显色液,37 ℃孵育10~20 min,加入终止液50 μL。用酶标仪测定其在450 nm 下的吸光度值。
1.2.5 间接竞争ELISA方法条件优化
(1) 包被量及抗体稀释倍数的优化:选取0.01,0.05,0.10,0.50 μg/孔的包被量和不同的抗体稀释倍数组合进行间接竞争ELISA方法的建立,计算不同包被量下的抗体稀释倍数分别对应的IC50值。选取OD450值在1左右并且IC50值最小的组合作为最优的条件,进行后续试验。
(2) 封闭液的优化:选取0.50%脱脂乳粉、1.00%脱脂乳粉、0.50% OVA和1.00% OVA作为封闭液进行间接竞争ELISA方法的建立,分别计算IC50值,确定OD450在1左右且IC50值最小的作为最适封闭液。
(3) 邻苯二甲酸二丁酯多克隆抗体间接竞争ELISA标准曲线的建立:在最佳条件下,将邻苯二甲酸二丁酯标准品从5 000 μg/L开始,以3倍梯度稀释10个浓度梯度,进行间接竞争ELISA测定,以邻苯二甲酸二丁酯标准溶液浓度为横坐标,抑制率为纵坐标,用Origin 9.1绘制标准曲线进行拟合,并计算IC50和IC15的值。
1.2.6 特异性测定 选取邻苯二甲酸二甲酯、邻苯二甲酸二乙酯、邻苯二甲酸二丙酯、邻苯二甲酸二异丁酯等18种邻苯二甲酸二丁酯的结构类似物进行交叉反应的测定,以评估邻苯二甲酸二丁酯抗体的特异性,交叉反应率(CR)越小,则说明抗体对该目标物的特异性越高,CR按式(1)计算:
(1)
式中:
CR——交叉反应率,%;
IC50(DBP)——抑制率为50%时所对应的DBP的浓度,μg/L;
IC50(结构类似物)——抑制率为50%时所对应的DBP结构类似物的浓度,μg/L。
1.2.7 样品处理
(1) 白酒:取2 mL白酒样品,用PBS稀释3倍后用于检测。
(2) 牛奶:取2 mL牛奶样品,加入3%的三氯乙酸,沉降牛奶中的蛋白质,6 000 r/min离心10 min,取上清液,加入1 mol/L的NaOH调节pH值至中性,用PBS稀释2倍后用于检测。
(3) 食用油:称取1.0 g食用油样品,加入5 mL乙腈,涡旋1 min,4 000 r/min离心2 min,收集上清液,重复提取1遍,将2次收集的上清液混合,旋蒸至干,加入2 mL 甲醇混合后在-20 ℃下冷冻2 h,4 000 r/min离心2 min,取上清液浓缩至近干,加入2 mL含5%甲醇的PBS样本稀释液复溶[18]。
1.2.8 添加回收率的测定 在选取的样品中分别添加0,10,20,50,100 μg/L浓度的DBP标准溶液,每个浓度做3个平行,按1.2.7中方法进行样品的处理,进行间接竞争ELISA的测定,计算回收率。
1.2.9 气相色谱—质谱法仪器方法验证 参考GB 5009.271—2016,选用GC-MS(气相色谱—质谱法)对本试验建立的方法进行验证,确定方法的准确性。
2 结果与分析
2.1 4-氨基邻苯二甲酸二丁酯的合成与鉴定
合成的半抗原DBAP的分子量为293,由图1可以看出其负离子(MS-1)为292.23,与其分子量相符,可以证明半抗原DBAP合成成功。
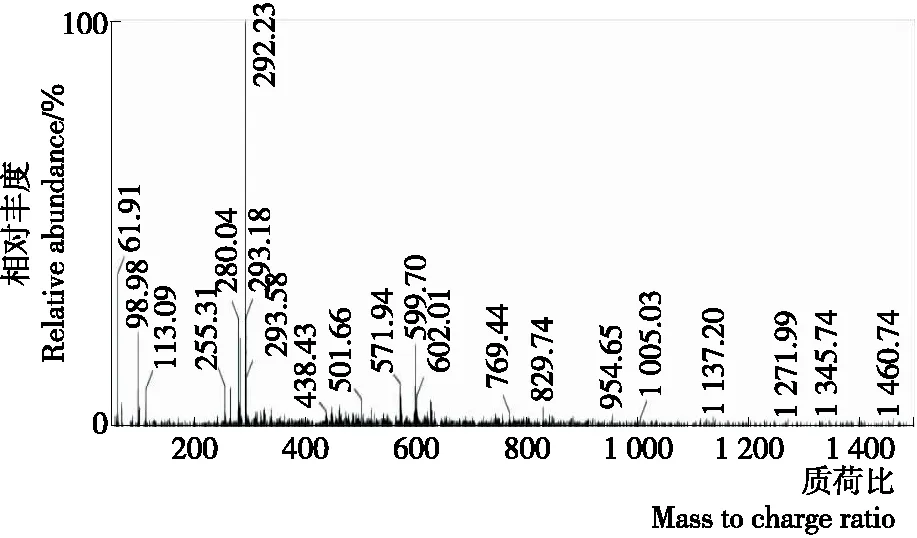
图1 半抗原DBAP的表征质谱图
2.2 人工抗原的紫外鉴定
用紫外分光光度计对半抗原、载体蛋白和偶联物进行测定,结果如图2所示。由图2可以看出:KLH与BSA蛋白在紫外下的吸收波长为280 nm,半抗原DBAP在285 nm左右有特征吸收峰,半抗原与蛋白质偶联物DBAP-BSA和DBAP-KLH的特征吸收峰与KLH和BSA蛋白相比发生了明显的改变,说明人工免疫抗原与包被抗原制备成功。

图2 DBP、KLH/BSA、DBAP-KLH/BSA紫外可见光谱
2.3 间接竞争ELISA方法条件优化
2.3.1 包被量及抗体稀释倍数的优化 由表1可以看出:包被量一定时,随着抗体稀释倍数增加,OD450值降低,IC50值呈下降趋势;比较不同包被量的IC50值和OD450值,当包被量为0.05 μg/孔,抗体稀释倍数为5 000时,IC50值较低,且其OD450值在1左右。因此选择包被量为0.05 μg/孔,抗体稀释倍数为5 000作为最优条件进行试验。
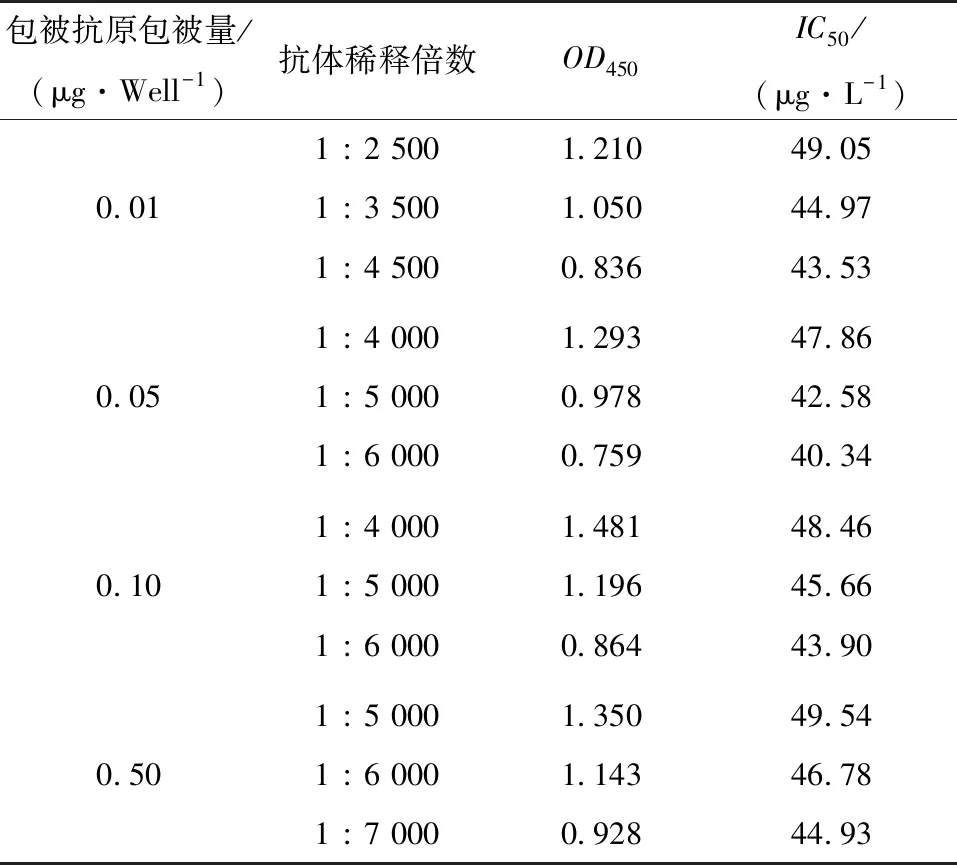
表1 包被量及抗体稀释倍数的优化
2.3.2 封闭液的优化 由图3可知:封闭液的种类会对OD450和IC50值产生影响。当选用0.50%的脱脂乳粉作为封闭液时,所得到的IC50值最低,并且OD450值在1左右,故选用0.50%的脱脂乳粉作为封闭液进行试验。

图3 封闭液的优化
2.3.3 邻苯二甲酸二丁酯多克隆抗体间接竞争ELISA标准曲线的建立 根据优化的条件,选用0.05 μg/孔的包被量,5 000倍的抗体稀释倍数,0.50%的脱脂乳粉作为封闭液,2万倍的二抗稀释倍数,DBP标准品从5 000 μg/L 开始进行3倍梯度稀释,显色15 min左右,建立间接竞争ELISA方法,得出目标物DBP的标准曲线如图4所示。由图4可知:方法的灵敏度(IC50)和检测限(IC15)分别是(40.68±0.35) μg/L和(1.98±0.15) μg/L。
2.4 特异性测定
用间接竞争ELISA方法对邻苯二甲酸二丁酯的结构类似物进行特异性检测,结果如表2所示。
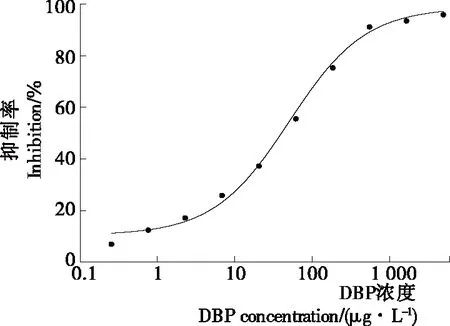
图4 DBP间接竞争ELISA标准曲线

测试集编号主成分回归R2RMSE偏最小二乘回归R2RMSE10.888 20.149 60.911 10.139 720.893 10.145 50.906 10.141 330.896 10.148 80.901 40.141 7
由表2可以看出:所制备的抗体与DPRP、DIBP和BBP有较低的交叉反应,交叉率都低于10%。可能是因为它们的结构较为相似,与其他结构类似物都无交叉反应。因此,邻苯二甲酸二丁酯的结构类似物对本方法的建立无影响,所获得的邻苯二甲酸二丁酯抗体特异性较好。
2.5 样品的测定
在白酒、牛奶、食用油样品中,分别添加0,10,20,50,100 μg/L浓度的邻苯二甲酸二丁酯标准溶液,每个浓度做3个平行,处理后进行间接竞争ELISA的测定,结果如表3所示。由表3可以得知:添加回收率在84.57%~102.40%。同时,采用气相色谱—质谱法(GC-MS)对间接竞争ELISA方法进行验证,线性方程为:y=31 355x+184 546,R2=0.999 8,添加回收率在85.14%~96.83%。将两种方法进行相关性分析,结果见图5。由图5可知:两种方法具有良好的相关性(R2=0.990 8),证明本试验所建立的间接竞争ELISA方法较为准确,可以对白酒、牛奶、食用油中的邻苯二甲酸二丁酯进行检测。
表3 ELISA和GC-MS添加回收结果
Table 3 The recovery results of ELISA and GC-MS (n=3)
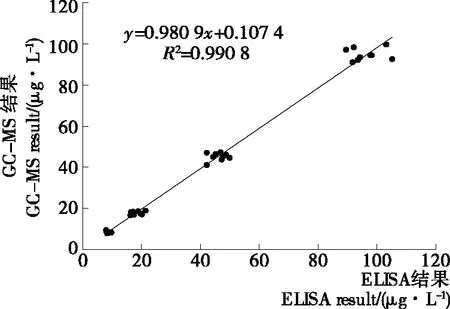
图5 ELISA和GC-MS检测结果相关性
3 结论
本试验直接将4-氨基邻苯二甲酸作为合成原料,通过酯化反应合成半抗原4-氨基邻苯二甲酸二丁酯,与之前文献[19-20]报道的合成步骤相比,无需经过4-硝基邻苯二甲酸二丁酯的硝基还原,整个合成过程更简单。试验建立的间接竞争ELISA方法的IC50值为40.68 μg/L,最低检测限IC15为1.98 μg/L,对邻苯二甲酸二丁酯具有较好的特异性。样品中邻苯二甲酸二丁酯的检测结果与GC-MS测定结果有较好的一致性(R2=0.990 8),证明该方法具有很好的准确性,可以用于食品中邻苯二甲酸二丁酯的检测。本研究方法的灵敏度还不够高,今后可以借助新型荧光标记材料建立新方法提高检测灵敏度。

