直肠癌病理标本大体肿瘤周边微小癌灶距离的测定*
鲍绪杰 朱苏雨 陈晓艳 刘科 周菊梅 吴峥 刘媛媛
局部进展期直肠癌标准治疗方式为术前新辅助放疗和化疗后再择期行全直肠系膜切除术(total mesorectal excision,TME)。有研究提出对于新辅助放化疗达到临床完全缓解(clinical complete regression,cCR)的患者可“等待和观察”,仅对其中“再生长”患者行挽救性手术治疗,其疗效和标准治疗相当,且能免除部分患者的手术并保留肛门功能从而提高生存质量[1-2]。因此,如何提高cCR率成为近期直肠癌新辅助治疗临床研究热点。有荟萃分析表明,cCR率与直肠癌局部放疗剂量呈线性关系[3]。但高剂量放疗常受限于肿瘤周边正常组织的放疗并发症。因此,如何精确确定大体肿瘤周边微小癌灶距离(clinical target volume,CTV)是放疗成功的关键。即明确CTV 在原发大体肿瘤体积(gross tumor volume,GTV)基础上外扩距离。手术病理标本为测量和检验此距离的“金标准”,尚缺乏直肠癌影像和病理标本的病例对照研究。因而目前直肠癌放疗中CTV的外扩范围尚缺乏统一共识,通常是四周外扩1.5~2 cm、上下两端各外扩2~3 cm,这可能导致大量正常器官接受不必要的高剂量放射。
为尝试解决上述问题,本研究测量直肠癌病理标本大体肿瘤外周微小癌灶距离,并将直肠癌术前影像与术后病理标本一一对应,计算手术标本“在体-离体”和病理标本处理过程退缩因子,经退缩因子校正后得出“在体”微小癌灶延伸距离(microcarcinoma extension measuredin vivo,MEinvivo),从而为直肠癌后程高剂量放疗GTV外扩成CTV提供科学依据。
1 材料与方法
1.1 临床资料
分析2016年10月至2017年4月在湖南省肿瘤医院行TME手术的28例直肠癌患者。纳入标准:1)根据MRI临床分期≥T3;2)术前未接受放疗、化疗和手术等治疗;3)术前肠镜提示为直肠单发肿瘤,排除多生发中心癌;4)术后病理诊断为腺癌。排除标准:1)有远处转移和多重癌;2)有MRI禁忌证或严重疾病无法耐受手术者。
1.2 方法
1.2.1 术前影像获取 患者取仰卧位,均行术前盆腔增强序列MRI。MRI 图像上以T2WI 肠壁增厚,直肠壁黏膜、黏膜下层及肌层信号带异常作为GTV 勾画标准。由两位消化道肿瘤影像诊断医师对肿瘤进行判定,当存在较大差异时,相互协商或请第三位医师进行确认。
1.2.2 病理标本处理过程 大体标本:28例患者均行TME手术,术后即时标本沿肿瘤主体对侧纵向剖开,随后将肿瘤切成均厚5 mm组织薄片,隔片取材,每片均由肠腔内向外取直肠系膜全层,向上下两端延伸包括肉眼肿瘤边缘外至少2 cm正常肠组织。在无外力影响下,结合肿瘤与周边正常组织解剖关系,将所得组织薄片尽可能复原与活体空间位置相当,以大头针固定于泡沫板。考虑临床实际,直肠癌侧方及上下方向微小癌灶测量方式有别,故沿大体肿瘤边缘垂直于直肠系膜将其分为大体肿瘤侧方、下方和上方(basis of measurement,BM)(图1)。另取肿瘤带直肠系膜筋膜组织一片,在肿瘤横断面中点打一手术线结作为标准点Ax,在系膜筋膜四角及标准点下方各打一手术线结作为参考点Bx(1,2,3,4,5),以相同方式固定(图2)。最后,将整块泡沫板倒置于10%福尔马林固定液24 h,脱水、浸蜡、包埋制成蜡块。
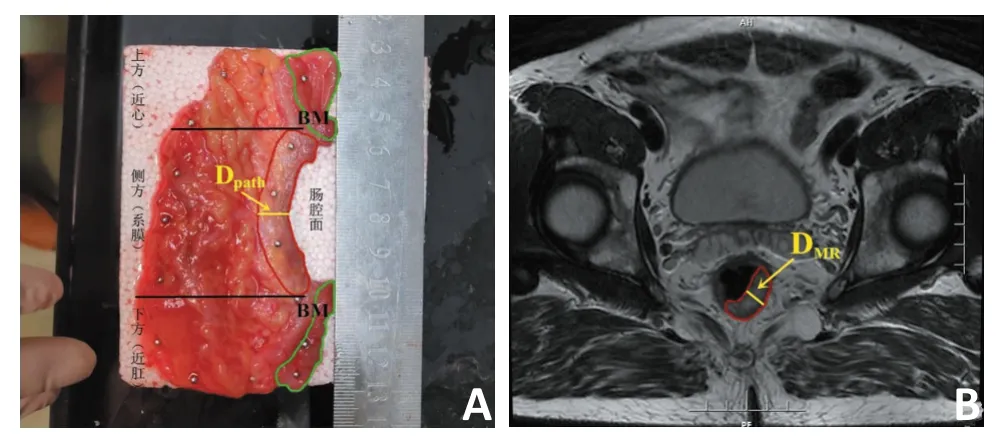
图1 肿瘤“离体”和“在体”厚度测量与R1的计算
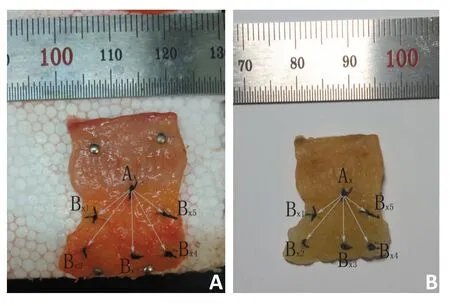
图2 R2的测量与计算
病理标本:所得蜡块连续切片(厚度为4 μm),所有切片均予伊红和美蓝染色,由高年资病理科医师在不借鉴任何资料的情况下,首先在低倍镜下总览整个切片,勾画出原发大体肿瘤边缘,若原发灶边缘呈小毛刺状浸润,则贴近毛刺根部勾画,同时在病理切片上勾画出最远微小癌灶,其定义为显微低倍镜下大体肿瘤边缘外癌细胞和癌巢外延距离,微小癌灶包括肿瘤出芽(<5个癌细胞团)、肠周癌结节、淋巴管侵犯形成的癌结节、血管侵犯形成的癌结节和神经鞘侵犯形成的癌结节。直肠癌大体肿瘤下方和上方实测微小癌灶延伸距离为最远微小癌灶距BM最近直线距离(microcarcinoma extension measured inferiorly/microcarcinoma extension measured superiorly,MEmi/MEms);直肠癌侧方实测微小癌灶延伸距离为最远微小癌灶距原发大体肿瘤边缘最近直线距离(microcarcinoma extension measured laterally,MEml)(图3A)。
1.2.3 肿瘤组织退缩因子计算 直肠癌行TME手术及术后标本制成病理切片过程存在肿瘤变形和退缩,其退缩因子分为两步计算:在体肿瘤经由手术离体后,因缺乏周围盆腔筋膜的牵拉发生第一次退缩,将此定义为“在体-离体”退缩因子(R1);离体肿瘤在制成病理标本过程中由于组织脱水发生第二次退缩,称为病理退缩因子(R2)。
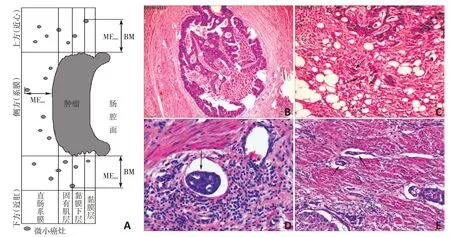
图3 微小癌灶距离测量示意图及微小癌灶类型
R1的测算:取直肠癌即时标本最中间组织片(图1A),红色区域为大体肿瘤,绿色区域为正常肠黏膜,肿瘤中点垂直于直肠系膜的黄色实线代表离体肿瘤厚度,标记为Dpath。获取患者所有肿瘤出现层面的MRI T2WI影像(层厚3 mm,层距1 mm),选取最中间层面(图1B),其中红色区域代表大体肿瘤,肿瘤中点垂直于直肠系膜的黄色实线代表肿瘤在体厚度,标记为DMR。据此R1采用如下公式计算:R1=Dpath/DMR。
R2的测算(图2):通过即刻术后标本及组织蜡块上Ax与Bx(1,2,3,4,5)各点间相对位置的改变计算R2,其公式为:

MEinvivo计算:通过逐例计算R1、R2、MEmi、MEms、MEml,则MEinvivo=MEmi/(R1×R2)或MEms/(R1×R2)或MEml/(R1×R2)。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析。统计28例患者大体肿瘤侧方、下方、上方MEinvivo及95%频数值。
2 结果
2.1 病理特征
研究共纳入28例患者,临床病理特征见表1。其中男性17 例(60.7%),女性11 例(39.3%),平均年龄61.9(41~80)岁。肿瘤分布以中低位直肠癌为主(19例),肿瘤分化以中分化为主(24 例),有肠旁淋巴结转移者13例(46.4%)。
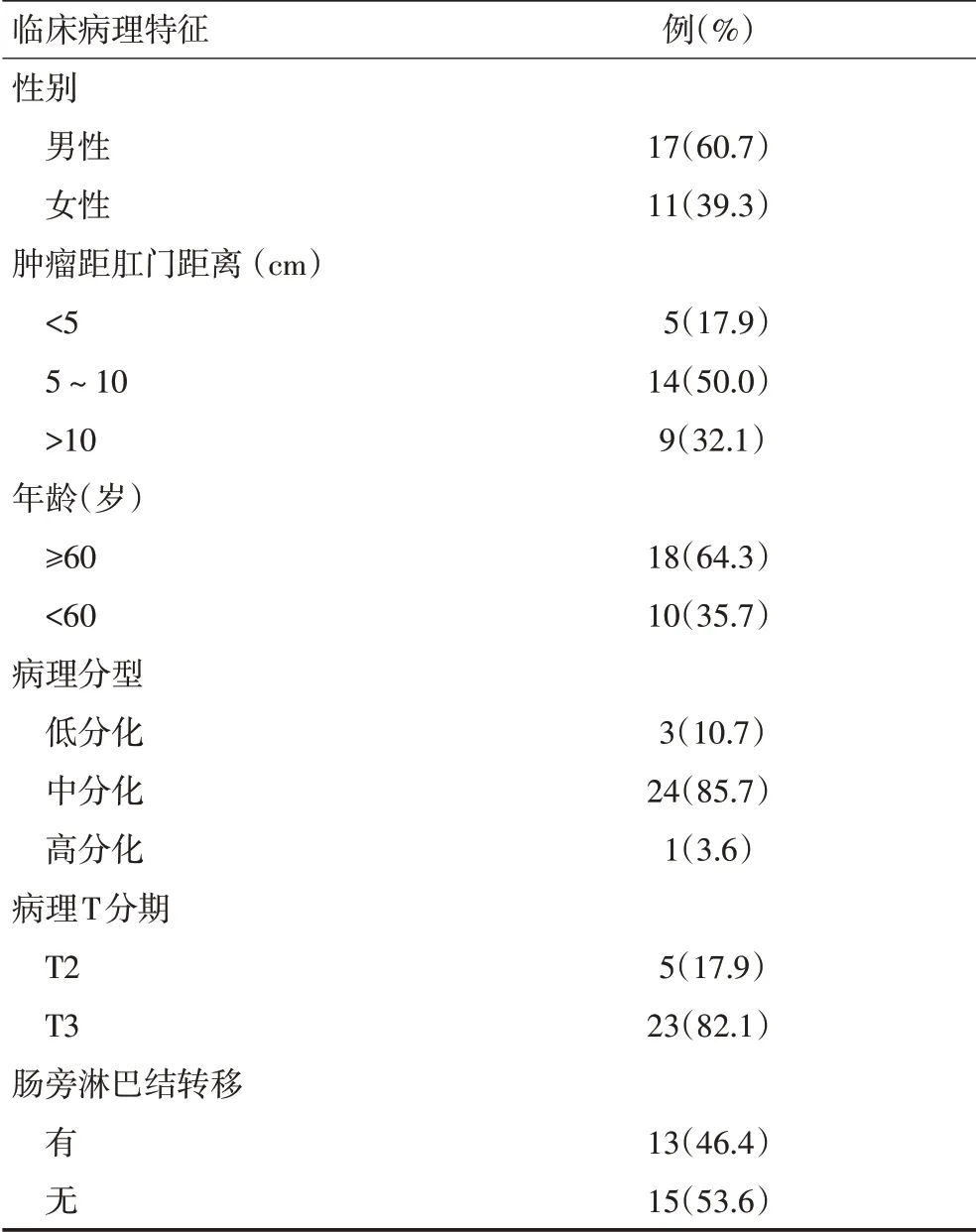
表1 28例直肠癌患者临床病理资料
2.2 微小癌灶类型统计及MEin vivo
28例直肠癌患者中,在大体肿瘤侧方、下方主上方可观察到微小癌灶者分别为17 例(60.7%)、3 例(10.7%)和0。微小癌灶最常见的类型为淋巴管性癌结节12例(42.9%)、肿瘤出芽9例(32.1%)、肠周癌结节5例(17.9%)、血管性癌结节2例(7.1%)、神经源性癌结节0 例(图3B~E)。经两种退缩因子校正后,MEinvivo在大体肿瘤下方者有3 例,分别为23.24 mm、11.32 mm 和28.06 mm;MEinvivo在大体肿瘤侧方者有17例,其最大值为12.03 mm,最小值为3.13 mm,平均值为7.50 mm(表2)。根据频数表法,28 例患者侧方微小癌灶侵袭范围95%频数值在10 mm内(表3)。
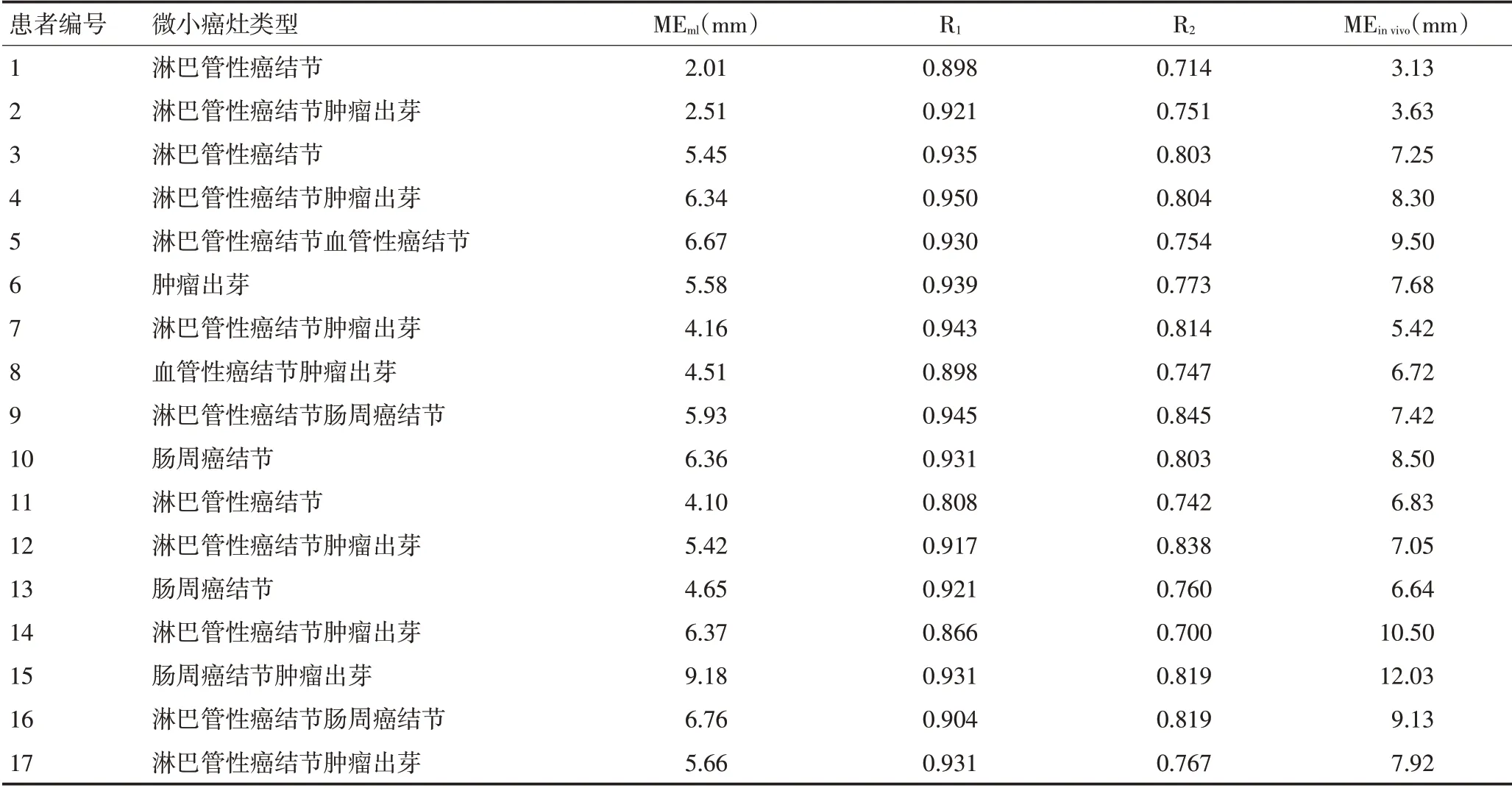
表2 17例患者大体肿瘤侧方微小癌灶类型、距离、退缩因子及MEin vivo
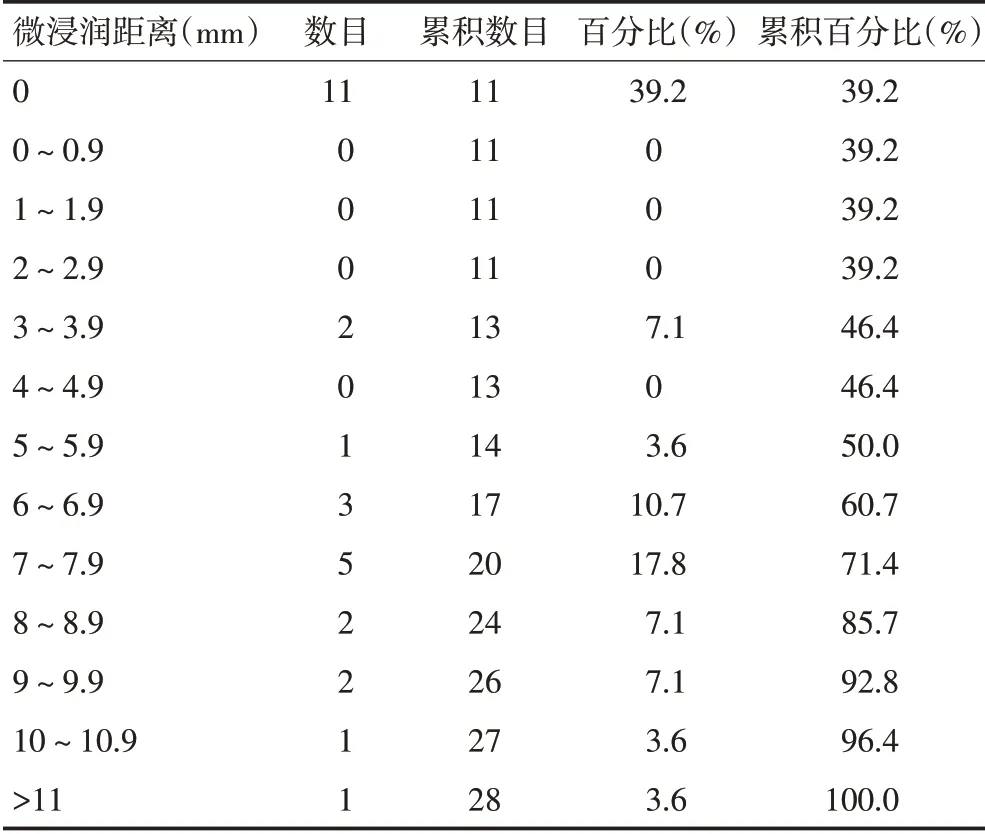
表3 28例患者大体肿瘤侧方MEin vivo频数值
3 讨论
局部晚期直肠癌标准治疗模式推荐为术前联合放化疗加TME[4]。出于患者生存质量和功能保全的考虑,经新辅助治疗达cCR后行“等待和观察”有望成为其治疗新策略。此策略由Habr-Gama等[5]于2004年首次报道265例低位直肠癌患者行新辅助同步放疗和化疗,71例(27%)达cCR,行“等待和观察”,其5年总生存期(overall survival,OS)和无病生存期(disease free survival,DFS)优于未达cCR选择手术的患者。近期一项涉及15个国家47家独立研究机构的“等待和观察”数据显示,880例达cCR的直肠癌患者采用“等待和观察”策略,其5年OS为85%,5年DFS为94%[1]。据此可见,经新辅助治疗达cCR后行“等待和观察”与传统手术患者的疗效相当,而无造口生存期显著延长,这成为中低位进展期直肠癌的治疗新选择,其优势在于避免了手术和手术相关的并发症,并维持了较好的疗效和较高的生存质量;其不足之处为cCR率(27%~78%)因治疗强度导致不同研究报道差异较大[5-8]。因此,如何获得稳定且高效的cCR率成为近期研究热点。Appelt等[8]采用高剂量放疗(直肠病灶60 Gy/30次,淋巴结预防区域50 Gy/30次,腔内照射推量5 Gy),同步口服卡培他滨化疗,入组51例低位直肠癌患者(T2~3N0~1M0),其中40例(78%)达cCR,行“等待和观察”,1年局部复发率为15.5%,均成功行外科手术解救治疗。一项关于直肠癌放疗强度与cCR率的量效研究[9]发现,放疗反应率在放疗剂量达60 Gy后呈指数增长,当放疗剂量达92 Gy时,约50%患者可达cCR,认为提高局部放疗剂量可以提升直肠癌cCR率。但较大范围照射靶区接受高剂量放疗有可能影响手术并增加手术并发症,对低位直肠癌也可能影响肛门括约肌复合体的功能,从而影响患者治疗后的生存质量。因此,如何精确确定直肠癌原发大体肿瘤及其亚临床病变范围显得尤为关键。病理标本为检测此范围准确性的“金标准”,但既往关于直肠癌大体肿瘤周边微小癌灶分布情况的研究,其方法学均存在不足:大部分研究仅考虑直肠癌上方和下方的微小癌灶,忽略了微小癌灶分布密度最高的直肠癌侧方,使得最终测量结果存在遗漏[10-11];另外部分研究[12-13]直接将固定后病理标本中微小癌灶与大体肿瘤之间距离定义为微小癌灶距离,忽视了手术切除和病理标本处理过程中直肠肿瘤组织退缩。本次研究结果表明,直肠癌手术标本R1平均值为0.913,R2平均值为0.803,忽视上述两部分退缩显然不恰当。因此,在充分考虑上述不足的基础上,本研究建议如下改进:1)沿肠管长轴方向将大体肿瘤连同完整直肠系膜切成均厚5 mm组织薄片,使每片薄片同时含有肿瘤组织与直肠系膜,以保证可同时测量大体肿瘤侧方、下方和上方微小癌灶距离;2)首次应用MRI影像和即刻术后标本计算R1及“线结标记法”计算R2,将术前影像与术后病理标本一一对应,从而更精确测量和计算MEinvivo,为直肠癌术前高剂量放疗精确勾画CTV边径提供科学数据参考。
本研究微小癌灶检出率为60.7%(17/28),高于继往研究结果(17%~43%)[14-16],这与标本收集时,取材的倾向性有关,本研究初期入组42例,在后续病理切片制作时,排除14例肠管壁肌层连续者(即病理分期≤pT2),最终入组28例(包含5例pT2,但直肠肌层连续性中断病例)。在提高微小癌灶检出率的同时也提升最终结果的临床意义。参照既往研究分类[15-17],本研究中所定义的微小癌灶包括肿瘤出芽(32.1%)、肠周癌结节(17.9%)、淋巴管性癌结节(42.9%)、血管性癌结节(7.1%)和神经源性癌结节(0),本次标本中并未发现神经源性癌结节,这与标本数量有限有关。
经各自退缩因子校正后,3例患者大体肿瘤下方MEinvivo分别为23.24 mm、11.32 mm 和28.06 mm,由于在体最远距离为28 mm。因此,CTV边径在上下两端外放时,30 mm 的距离已足够覆盖靶区,这与Ono等[15]的结果一致。17例患者大体肿瘤侧方MEinvivo平均为7.50 mm,64.7%(11/17)的病例距离分布在6~10 mm 之间,若>10 mm,其微小癌灶密度急剧下降。根据28例直肠癌患者侧方微小癌灶距离频数分布情况,可知侧方微小癌灶侵袭范围95%频数值在10 mm内,说明直肠癌后程高剂量放疗靶区在前后左右方向GTV 外扩CTV 时边径仅需10 mm。大部分放疗科医师在此方向外扩值为15~20 mm,通常包括整个直肠系膜区,结合本研究结果,这种外扩边径在直肠癌后程局部推量放疗时显得过大。此外,受限于入组病例例数,本研究暂无法行肿瘤的病理分级及临床分期与其外侵范围相关性分析,且既往文献尚缺乏相关报道,后续扩充样本量以明确外侵范围与两者间关系。最后,本研究在测量直肠标本“在体-离体”退缩上仍存在不足:由于MRI 扫描层厚及层间距的原因,影像与病理标本上所测肿瘤层面存在一定误差,导致最终所测微浸润距离存在细微偏差,如果在肿瘤中心及四周植入金属标记物,在体影像和离体组织中,其相对距离的改变将能更为精准的测量“在体-离体”组织的退缩因子。
综上所述,本研究从病理标本测量报道28 例直肠癌患者侧方微小癌灶侵袭范围95%频数值在10 mm 内。建议直肠癌后程高剂量放疗靶区在前后左右方向GTV外扩成CTV时边径为10 mm。

