HIFU消融MR T2WI不同信号子宫肌瘤的临床疗效及安全性分析
刘玉婷,谢晓绘,官孝萍,申恒春*
(1.西南医科大学附属医院妇产科,四川 泸州 646000;2.内江市第一人民医院妇产科,四川 内江 641000)
子宫肌瘤是常见妇科良性肿瘤之一,目前治疗方式主要包括子宫切除术、肌瘤剜除术、药物治疗、子宫动脉栓塞术及HIFU消融,后者因其创伤小、住院时间短、术后恢复快等优势而受到青睐[1-4]。MRI软组织分辨力高,有利于测量子宫肌瘤大小,根据不同信号,可分析肌瘤内组织成分,增强扫描还可显示其血供情况[5]。本研究比较HIFU治疗MR T2WI不同信号子宫肌瘤的效果。
1 资料与方法
1.1 一般资料 收集2016年8月—2017年8月首诊于我院拟接受HIFU治疗的156例子宫肌瘤患者,年龄27~51岁,平均(41.8±5.0)岁;术前均接受MR检查,共检出子宫肌瘤210个,肌瘤体积0.52~447.42 cm3,中位体积39.78 cm3。经至少2名高年资影像诊断医师参照Zhao等[6]分类方法,结合本组病例实际情况,将子宫肌瘤分为低信号组(74例115个肌瘤,图1A)、等信号组(11例15个肌瘤)、高信号组(36例39个肌瘤,图2A)及混杂信号组(35例41个肌瘤;即1个肌瘤内部同时存在2种及以上MRI信号)。
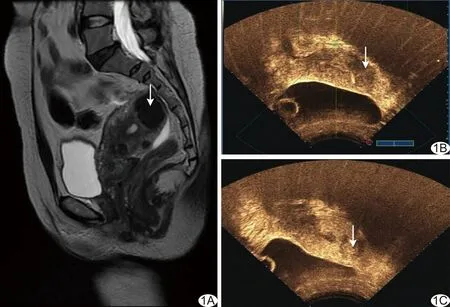
图1 子宫肌瘤患者,40岁,孕2产1 A、B.HIFU消融前MR T2WI显示肌瘤呈低信号(A),CEUS可见肌瘤周围明显强化,肌瘤内部稍强化(B); C.HIFU消融后即刻CEUS可见肌瘤周围强化减弱,肌瘤内部出现无灌注区 (箭示子宫肌瘤)
1.2 仪器与方法 采用Esaote MyLab 70超声诊断仪、海扶JC200型超声治疗系统。嘱患者俯卧,将探头置于其耻骨上方2~3 cm处,行CEUS检查观察病灶位置、大小及血供情况(图1B、2B)。确定治疗声通道安全后开始消融,参数:频率0.96 MHz,焦距151 mm,功率350~400 W,以层间距5 mm逐层对病灶进行消融,当超声显示病灶灰度较前变化明显、CDFI血流信号消失时,行CEUS观察病灶血供情况(图1C、2C),如血供明显减少甚至消失,则终止HIFU治疗,否则继续消融。
记录术中消融治疗参数,包括声源功率(W)、辐照时间(s)、治疗剂量(J)及治疗强度,其中治疗强度=辐照时间(s)/治疗总时间(h)。
1.3 疗效评估 采用Esaote MyLab 70超声诊断仪,于HIFU消融后即刻行CEUS检查(图1C、2C),造影剂为SonoVue(Bracco公司)。测算消融后即刻肌瘤体积及无灌注区体积(肌瘤中无造影剂充盈的部分,即肌瘤凝固性坏死区[7]),体积(mm3)=长径(mm)×左右径(mm)×前后径(mm)×0.5233。计算能效因子(即消融单位体积病灶所需超声能量)及消融率,能效因子(J/mm3)=η×声源功率(W)×辐照时间(s)/无灌注区体积(mm3),其中η反映HIFU对超声能量汇聚的能力,取η=0.7;消融率(%)=肌瘤体积(mm3)/无灌注区体积(mm3)×100%。

图2 子宫肌瘤患者,34岁,孕2产2 A、B.HIFU消融前MR T2WI显示肌瘤呈高信号(A),CEUS示肌瘤内部明显强化,可见粗大血管影(B); C.HIFU消融后即刻CEUS可见强化范围明显减小,肌瘤内部出现无灌注区 (箭示子宫肌瘤)
分别于术后3个月及6个月随访复查经阴道超声,测算肌瘤体积,并与术前对照,计算肌瘤缩小率,肌瘤缩小率(%)=(术前肌瘤体积-随访复查肌瘤体积)/术前肌瘤体积×100%。于术后12个月对患者妊娠及肌瘤再干预(包括接受子宫肌瘤剜除术或子宫切除术、再次接受HIFU治疗)情况进行随访。
1.4 安全性评价 HIFU消融术中持续监测患者生命体征,观察是否出现治疗相关不良反应,包括放射痛、皮肤烫伤、治疗区疼痛、腹股沟痛及臀部褶皱痛等。对术后不良反应常规随访1周,必要时可延长时间;观察有无发热、下腹部疼痛、骶尾部疼痛及阴道排液。
1.5 统计学分析 采用SPSS 23.0统计分析软件。计量资料符合正态分布以±s表示,非正态分布则以中位数(上下四分位数)表示;计数资料以百分率表示。术前肌瘤体积及治疗剂量均采用Kruskal-Wallis检验,两两比较采用Dunn检验。各组间术中声源功率、辐照时间、治疗强度、能效因子、术后消融率及肌瘤缩小率的比较采用单因素方差分析,如方差齐则采用LSD法进行两两比较,方差不齐则采用Games-Howell检验进行两两比较。各组间术中及术后不良反应发生率比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 肌瘤体积及消融治疗参数比较 4组间HIFU消融术前肌瘤体积(χ2=14.720,P=0.002)、术中辐照时间(F=10.422,P<0.001)及治疗剂量(χ2=30.973,P<0.001)差异均有统计学意义,而术中声源功率及治疗强度差异均无统计学意义(P均>0.05),见表1。两两比较,低信号组术前肌瘤体积较高信号组(P=0.032)及混杂信号组(P=0.029)明显减小;高信号组术中辐照时间明显长于低信号组(P<0.001)及混杂信号组(P=0.006),治疗剂量明显大于低信号组(P<0.001)、等信号组(P=0.023)及混杂信号组(P=0.013)。其余组间两两比较差异均无统计学意义(P均>0.05)。

表1 各组子宫肌瘤患者HIFU消融术前肌瘤体积及术中消融治疗参数比较
表4 各组子宫肌瘤患者HIFU消融术中不良反应发生率[%(例),±s]

表4 各组子宫肌瘤患者HIFU消融术中不良反应发生率[%(例),±s]
组别放射痛皮肤烫伤治疗区疼痛腹股沟痛臀部褶皱痛低信号组(n=74)9.46(7/74)62.16(46/74)75.68(56/74)16.22(12/74)2.70(2/74)等信号组(n=11)045.45(5/11)72.73(8/11)9.09(1/11)0高信号组(n=36)19.44(7/36)52.78(19/36)86.11(31/36)13.89(5/36)8.33(3/36)混杂信号组(n=35)11.43(4/35)37.14(13/35)71.43(25/35)00χ2值3.9536.2792.4816.4114.635P值0.2670.0990.4790.0930.201
2.2 疗效相关指标比较 4组间能效因子(F=3.953,P=0.009)及消融率(F=4.313,P=0.006)差异均有统计学意义,见表2。两两比较,高信号组能效因子明显高于低信号组(P=0.016)、等信号组(P=0.012)及混杂信号组(P=0.002),消融率明显低于低信号组(P=0.003)、等信号组(P=0.006)及混杂信号组(P=0.003)。其余组间两两比较差异均无统计学意义(P均>0.05)。
表2 各组子宫肌瘤患者HIFU能效因子及消融率比较(±s)
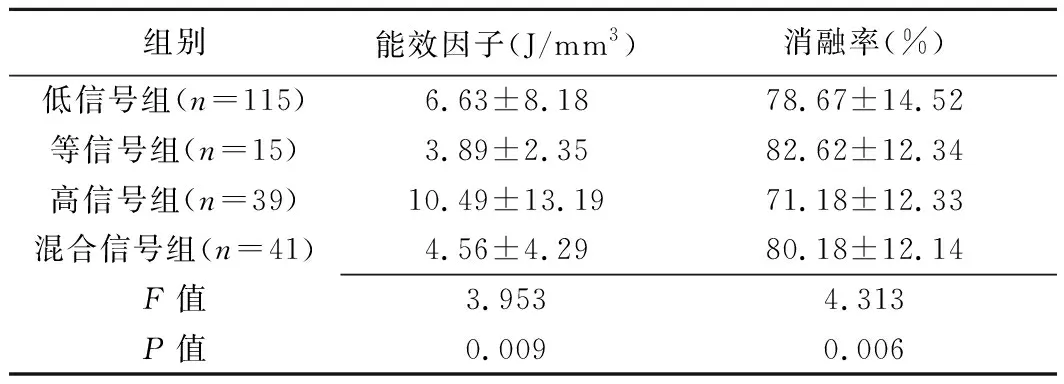
表2 各组子宫肌瘤患者HIFU能效因子及消融率比较(±s)
组别能效因子(J/mm3)消融率(%)低信号组(n=115)6.63±8.1878.67±14.52等信号组(n=15)3.89±2.3582.62±12.34高信号组(n=39)10.49±13.1971.18±12.33混合信号组(n=41)4.56±4.2980.18±12.14F值3.9534.313P值0.0090.006
低信号组、高信号组、混杂信号组中,术后3个月分别失访3例(3个肌瘤)、1例(2个肌瘤)、3例(3个肌瘤),术后6个月为5例(8个肌瘤)、2例(3个肌瘤)、5例(7个肌瘤);等信号组术后3个月及6个月均无失访者。4组3个月及6个月肌瘤缩小率差异均有统计学意义,见表3。高信号组术后3个月肌瘤缩小率明显低于低信号组(P=0.038)及混杂信号组(P=0.018),术后6个月肌瘤缩小率明显低于低信号组(P<0.001)、等信号组(P=0.013)及混杂信号组(P=0.050)。其余组间两两比较差异均无统计学意义(P均>0.05)。
随访至术后12个月,低信号组9例(14个肌瘤)、等信号组2例(2个肌瘤)、高信号组6例(8个肌瘤)、混杂信号组6例(8个肌瘤)失访。4组患者妊娠率分别为7.69%(5/65)、0、3.33%(1/30)及3.45%(1/29);肌瘤再次干预率分别为9.23%(6/65)、0、16.67%(5/30)及10.34%(3/29)。
2.3 安全性比较 所有患者术中生命体征平稳,4组间术中各不良反应发生率差异均无统计学意义(P均>0.05),见表4。
术后患者均未出现发热;低信号组、混杂信号组中各2例出现阴道排液,等信号及高信号组中无阴道排液者,4组间差异无统计学意义(χ2=2.245,P=0.523)。低信号组、等信号组、高信号组及混杂信号组术后下腹部疼痛发生率分别为44.59%(33/74)、81.82%(9/11)、63.89%(23/36)、57.14%(20/35),骶尾部疼痛发生率分别为27.03%(20/74)、18.18%(2/11)、30.56%(11/36)、22.86%(8/35);4组间差异均无统计学意义(χ2=7.616、0.945,P=0.055、0.815)。所有术后不良反应未经特殊处理,症状均于术后2周内自行缓解。
表3 各组子宫肌瘤患者HIFU消融术后3个月及6个月肌瘤缩小率比较(%,±s)
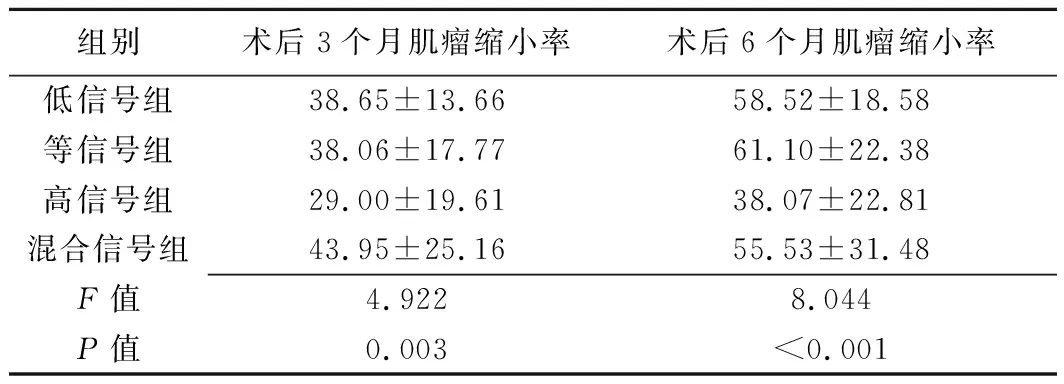
表3 各组子宫肌瘤患者HIFU消融术后3个月及6个月肌瘤缩小率比较(%,±s)
组别术后3个月肌瘤缩小率术后6个月肌瘤缩小率低信号组38.65±13.6658.52±18.58等信号组38.06±17.7761.10±22.38高信号组29.00±19.6138.07±22.81混合信号组43.95±25.1655.53±31.48F值4.9228.044P值0.003<0.001
注:除外失访病例后,低信号组、等信号组、高信号组及混合信号组术后3个月子宫肌瘤病灶分别为112、15、37、38个,术后6个月分别为107、15、36、34个
术中及术后均未发生肠道损伤、下肢感觉运动异常等严重不良反应。
3 讨论
HIFU治疗子宫肌瘤的原理是将低能量超声穿透正常组织聚焦于靶区内,使焦点温度瞬间升高至60℃~100℃,导致肌瘤组织发生蛋白变性及凝固性坏死;同时破坏肌瘤组织内的血管,阻断其血供,致使肌瘤组织发生缺血性坏死;后期肌瘤逐渐被溶解吸收,发生纤维化[4,8]。HIFU治疗子宫肌瘤特异性较强,且对肌瘤以外组织影响较小。
冉剑波等[9]报道,MR T2WI呈高信号肌瘤中平滑肌细胞丰富,肌瘤胶原纤维细小而平滑肌纤维丰富。HIFU消融过程中,靶组织胶原纤维含量越低,其声衰减、声速值越小,越不利于组织吸收能量并将其转化为热能。MR T2WI高信号子宫肌瘤大多血供丰富,HIFU消融对于直径>2 mm滋养血管的闭塞能力有限,且丰富的血液流动也可带走较多热能,不利于能量沉积[8]。本研究发现高信号组辐照时间最长,治疗剂量最大,但消融率最低,能效因子最大,与Jacobs等[10-12]的结果相符。另有学者[13-14]认为MR T2WI高信号肌瘤HIFU治疗效果不可一概而论,均匀轻度高信号肌瘤HIFU治疗困难、效果较差,而不均匀高信号肌瘤的治疗效果与低信号及等信号肌瘤相似。本研究将混杂信号肌瘤单独列为1组,结果显示混杂信号组HIFU消融治疗参数及疗效相关指标均与低信号、等信号组差异无统计学意义(P均>0.05),与既往研究[14-15]结果相符合。Zhao等[15]认为HIFU治疗MR T2WI高信号子宫肌瘤后再干预率高于等信号及低信号肌瘤。本研究结果也显示高信号组再干预率最高,为16.67%(5/30)。
本研究的主要不足之处在于HIFU消融术后随访时间有限,对患者治疗后再次干预率及妊娠率、分娩等情况尚需进一步深入研究。
HIFU消融不同MR T2WI信号子宫肌瘤均较为安全、有效;相对于低信号、等信号及混杂信号肌瘤,高信号肌瘤消融难度更大,效果更差,治疗后再次干预率高。

