辣木叶蛋白质酶解产物的制备及其抗菌活性研究
康丹丹,李照莹,董浩澜,周 伟,李积华,彭芍丹,郭长青
(1.华中农业大学食品科技学院,湖北武汉 430070;2.中国热带农业科学院农产品加工研究所,农业农村部热带作物产品加工重点实验室,广东湛江 524001;3.南昌大学食品学院,江西南昌 330000;4.海南省果蔬贮藏与加工重点实验室,广东湛江 524001;5.河南金辣木生物科技有限公司,河南鹤壁 458000)
在食品加工、运输及贮存过程中,添加食品防腐剂可有效防止食品腐败变质、保障食品质量安全[1]。目前,我国食品行业中使用的防腐剂大多数是人工合成的。然而,在长期使用过程中,合成防腐剂的致畸、致癌等副作用逐渐凸显,人们更加关注天然防腐剂的研发[2]。其中,抗菌肽具有抗细菌、真菌以及病毒等多种生物活性且不易产生抗药性,有望成为抗生素及化学防腐剂的理想替代品,应用于化妆品、食品、医药等行业[3]。
辣木(MoringaoleiferaLam.),为热带落叶乔木,原产于印度北部,我国台湾、云南及广东等地均有种植,其花、叶及种子等部位均含有丰富的营养成分,是优质食品原料[4-5]。2012年11月,我国卫生部批准辣木叶为新资源食品[6]。目前,研究发现辣木叶具有抗炎抑菌、抗病毒、抗氧化、降血糖、抗肿瘤等多种生物活性[7-9]。Jayawardana等[10]将不同量的辣木叶粉末加入到香肠中,储藏一段时间后研究其菌落生长情况,发现大肠杆菌被完全抑菌,而金黄色葡萄球菌菌落数小于102CFU/g,推测其抗菌活性可能与其中的小分子蛋白及多肽有关,但未深入研究。此外,研究表明辣木叶中富含蛋白质,含量在27%~37%,与大豆相当[11],但是,辣木叶蛋白体外消化率低且多作为动物饲料使用,造成资源的极大浪费[12]。酶法酶解蛋白,可将其水解成具有特异抗菌活性的小分子肽,并易于被人体消化吸收[13]。
因此,本研究以辣木叶为原料,提取辣木叶中蛋白质并评估其抗菌活性,并以酶解产物抑菌活性为指标,比较单酶酶法及复合酶酶解效果,选择最优酶解酶,分析酶解产物的抑菌谱及最小抑菌浓度,为实现辣木叶蛋白价值最大化提供有益思路,并为辣木叶抗菌肽的制备和应用提供理论基础。
1 材料与方法
1.1 材料与仪器
辣木叶 河南金辣木生物科技有限公司;碱性蛋白酶(酶活力200 U/mg)、木瓜蛋白酶(酶活力80万 U/g)、胰蛋白酶(酶活力250 N.F.U/mg)、中性蛋白酶(酶活力60000 U/g)、胃蛋白酶(酶活力250 U/mg) 北京索莱宝科技有限公司;菠萝蛋白酶 实验室自制[14](酶活力 6.94×106U/g,制备方法:菠萝汁离心(4000 r/min,15 min)后取上清液,加0.01%(w:w)EDTA和0.005%(w:w)L-半胱氨酸,搅拌均匀,以此进行微滤、超滤,收集浓缩液并冻干,得菠萝蛋白酶粉末);营养肉汤培养基 海博生物技术有限公司;营养琼脂培养基 北京陆桥技术有限责任公司;盐酸、氢氧化钠、无水乙醇、碳酸氢钠 国产分析纯,广东光华科技股份有限公司;测试菌株包括3株革兰氏阳性菌:金黄色葡萄球菌(StaphylococcusaureusCICC 25923)、化脓性链球菌(StreptococcusCICC 19616)、单增李斯特氏菌(ListeriamonocytogenesCICC 21574)、3株革兰氏阴性菌:大肠杆菌(EscherichiacoliCICC(B)44103)、铜绿假单胞菌(PseudomonasaeruginosaCICC 27853)、鼠伤寒沙门氏菌(SalmonellatyphimuriumCICC 14028) 以上菌株均购于中国工业微生物菌种保藏管理中心。
万能高速粉碎机 上海菲力博食品有限公司;HG-50全自动高压蒸汽灭菌锅 日本Hirayama公司;ZHJH-C1115B超净工作台 上海智城分析仪器制造公司;梅特勒FE20-Five Easy PlusTMpH计 美国Mettler Toledo公司;UV-1780型紫外可见分光光度计 津岛仪器(苏州)有限公司;3-30K型低温高速离心机 德国Sigma公司;Alpha1-2冻干机 北京博劢行仪器有限公司;KjeltecTM8400自动凯氏定氮仪 福斯华(北京)科贸有限公司;MJX-288型霉菌培养箱 宁波市科技园区新江南仪器有限公司;XW-80A漩涡混合器 上海青浦沪西仪器厂;LA8080氨基酸自动分析仪 日立高新技术公司。
1.2 实验方法
1.2.1 辣木叶蛋白质的制备 选取无斑点、无虫蛀的辣木叶,经过粉碎机粉碎5 min,观察无明显颗粒后过60目筛,得辣木叶粉末。
参考Paula等[15]的辣木叶蛋白质提取方法并适当修改:取一定量的辣木叶粉末,按1∶100 (g/mL)的比例加入蒸馏水,调节pH为9.0,40 ℃水浴40 min,8000 r/min离心15 min,取上清液,调节pH为4~4.5后5000 r/min离心10 min,所得沉淀水洗2次,透析冻干,得辣木叶蛋白,于4 ℃下保存备用。
1.2.2 辣木叶蛋白提取率测定 采用凯氏定氮法先测定辣木叶中粗蛋白含量:准确称取2.000 g供试辣木叶粉(精确到0.001 g),平行测定3份,算出平均值,同时吸取空白消化液做空白。同时采用凯氏定氮法测定辣木叶蛋白粉末中的蛋白质含量(g/100 mL或g/100 g),蛋白质提取率计算公式:
提取率(%)=提取的蛋白粉末中蛋白含量×100/辣木叶干粉中粗蛋白含量
1.2.3 辣木叶蛋白氨基酸组分测定 参考Kaushik等[16]的方法略作修改:样品处理:采用盐酸水解法对蛋白样品进行处理:称取0.0200 g辣木叶样品于水解管中,加入8 mL 6 mol/L HCl,真空封管并于110 ℃的烘箱内水解24 h;冷却,将水解液定容至25 mL,滤纸过滤;取滤液1 mL于烧杯中,40 ℃真空干燥25 min后加入1 mL 0.02 mol/L HCl,静置1 h,倒入1.5 mL离心管内,10000 r/min离心10 min,取1 mL经0.22 μm滤膜过滤后转移至Agilent专用样品瓶内;上机分析。
氨基酸自动分析仪分析检测条件为:(4.6×250) mm 5 μm ODS分析柱;柱温40 ℃;反应温度97 ℃;缓冲液流速为0.225 mL/min;茚三酮流速为0.30 mL/min。
1.2.4 辣木叶蛋白抑菌活性评价
1.2.4.1 辣木叶蛋白溶液配制 冷冻干燥所得辣木叶蛋白,用灭菌水(121 ℃,高压蒸汽灭菌20 min)溶解,配制成30 mg/mL的蛋白溶液,用0.22 μm无菌微孔滤膜过滤除菌,备用。
1.2.4.2 菌种培养 细菌培养使用营养肉汤培养基。将实验用菌株接种到装有培养基的试管内,37 ℃培养24 h。取活化好的菌种,分别溶于100 mL的无菌生理盐水中,充分震荡10 min。调整浊度,用麦氏比浊管制成含菌数108CFU/mL的菌悬液,再逐级稀释至106CFU/mL,备用。
1.2.4.3 抑菌圈大小 采用滤纸片-琼脂扩散法[17]测定提取物抑菌活性。取熔化的营养肉汤-琼脂培养基大约20 mL倒入无菌培养皿中,水平放置,凝固后,在培养皿底部标记滤纸片(直径6 mm)的摆放位置及菌种等。取100 μL菌液均匀涂布于相应固体培养基上,待菌液完全渗入后,于不同的标记位置上放置对应的滤纸片,重复3次。37 ℃恒温培养18~24 h,采用十字交叉法测定抑菌圈直径大小。并选择30 mg/mL卡那霉素作为阳性对照,灭菌水为阴性对照。
抑菌圈实验测定标准:抑菌圈大于20 mm,极敏;15~20 mm,高敏;10~15 mm,中敏;7~10 mm,低敏;小于7 mm,不敏感。
1.2.5 辣木叶蛋白抑菌酶解产物的制备
1.2.5.1 单酶酶解 选用碱性蛋白酶、木瓜蛋白酶、胰蛋白酶、中性蛋白酶、胃蛋白酶、菠萝蛋白酶6种酶,分别在其最适pH及温度条件下对辣木叶蛋白进行水解,酶解条件如表1。将辣木叶蛋白粉末配制成2%的溶液10 mL,调至适宜的温度和pH,分别加入5000 U/g的蛋白酶,低速水浴震荡2 h,沸水浴中维持灭酶15 min,将灭活后的酶解液降至室温,5000 r/min离心15 min,取上清液,得粗酶解液,低温保存作为进一步实验样品备用。

表1 辣木叶蛋白酶解条件Table 1 Enzymatic hydrolysis conditions of Moringa oleifera leaves protein
1.2.5.2 复合酶酶解 选择3种复合酶(胰蛋白酶+胃蛋白酶、胰蛋白酶+中性蛋白酶、胃蛋白酶+木瓜蛋白酶),复合酶所包含的两种酶添加量分别为5000 U/g,在最适温度及pH条件下前酶先酶解2 h后灭酶,加另一种酶酶解2 h后酶解结束,沸水浴中维持灭酶15 min,将灭活后的酶解液降至室温,5000 r/min离心15 min,取上清液,得粗酶解液,4 ℃低温保存备用。使用1.2.5.1及1.2.5.2所得酶解液,选择大肠杆菌、金黄色葡萄球菌作为指示菌进行抑菌圈实验。
1.2.6 酶解产物的抑菌谱研究 选择最优酶酶解所得的酶解冻干产物(温度:-40 ℃,真空度:1.37 Pa)分别对金黄色葡萄球菌、大肠杆菌和鼠伤寒沙门氏菌等6种菌种做抑菌圈实验。采用琼脂平板扩散法测定[17]抑菌活性。选择30 mg/mL卡那霉素及氨苄青霉素作为阳性对照,灭菌水为阴性对照。
1.2.7 最小抑菌浓度(MIC)的测定 参考Kobbi等[18]的实验方法并略作修改:采用肉汤稀释法(二倍稀释法)[19]测定抑菌肽的MIC。将胃蛋白酶和胰蛋白酶复合酶酶解冻干产物溶于灭菌水,配制成不同浓度(100、50、25、12.5、6.25、3.125、1.5625、0.7812、0.3906、0.1953 mg/mL)。在各试管中依次加入8.9 mL营养肉汤培养基、0.1 mL菌悬液、1 mL不同浓度酶解液,最终酶解冻干产物浓度为10、5、2.5、1.25、0.625、0.3125、0.1562、0.0781、0.0391、0.0195 mg/mL,以营养肉汤培养基作为空白对照,阳性对照为菌浓度为106CFU/mL的菌液120 μL。相同条件下培养24 h,在630 nm波长处测定吸光度值,以OD630增量<0.05的最小浓度为MIC。
1.3 数据处理
实验重复3次,实验结果用平均值±标准差表示,用Origin 8数据处理软件进行数据处理和分析。
2 结果与分析
2.1 辣木叶蛋白质提取率的测定及氨基酸的组成分析
通过凯氏定氮法测得的辣木蛋白提取率为32.67%±0.45%,对比熊瑶[20]测定的辣木叶蛋白提取率36.75%相差不大,辣木叶蛋白质氨基酸的组成及含量见表1。
表1显示,辣木叶含有16种氨基酸,总量为64.50 g/100 g,其中,天冬氨酸、谷氨酸、亮氨酸这3种氨基酸的含量较高,含量分别为6.99%、7.70%、6.26%,第一限制性氨基酸为半胱氨酸+甲硫氨酸,含量为2.38%。辣木叶蛋白质7种必需氨基酸的总量为25.33%,占氨基酸总量的39.27%,酪氨酸、异亮氨酸等7种疏水性氨基酸的含量约为27.68%,占氨基酸总量的43.91%,2种亲水性氨基酸含量约为10.55%,碱性氨基酸含量为10.06%。本研究结果与吕晓亚等[21]的研究结果相近。
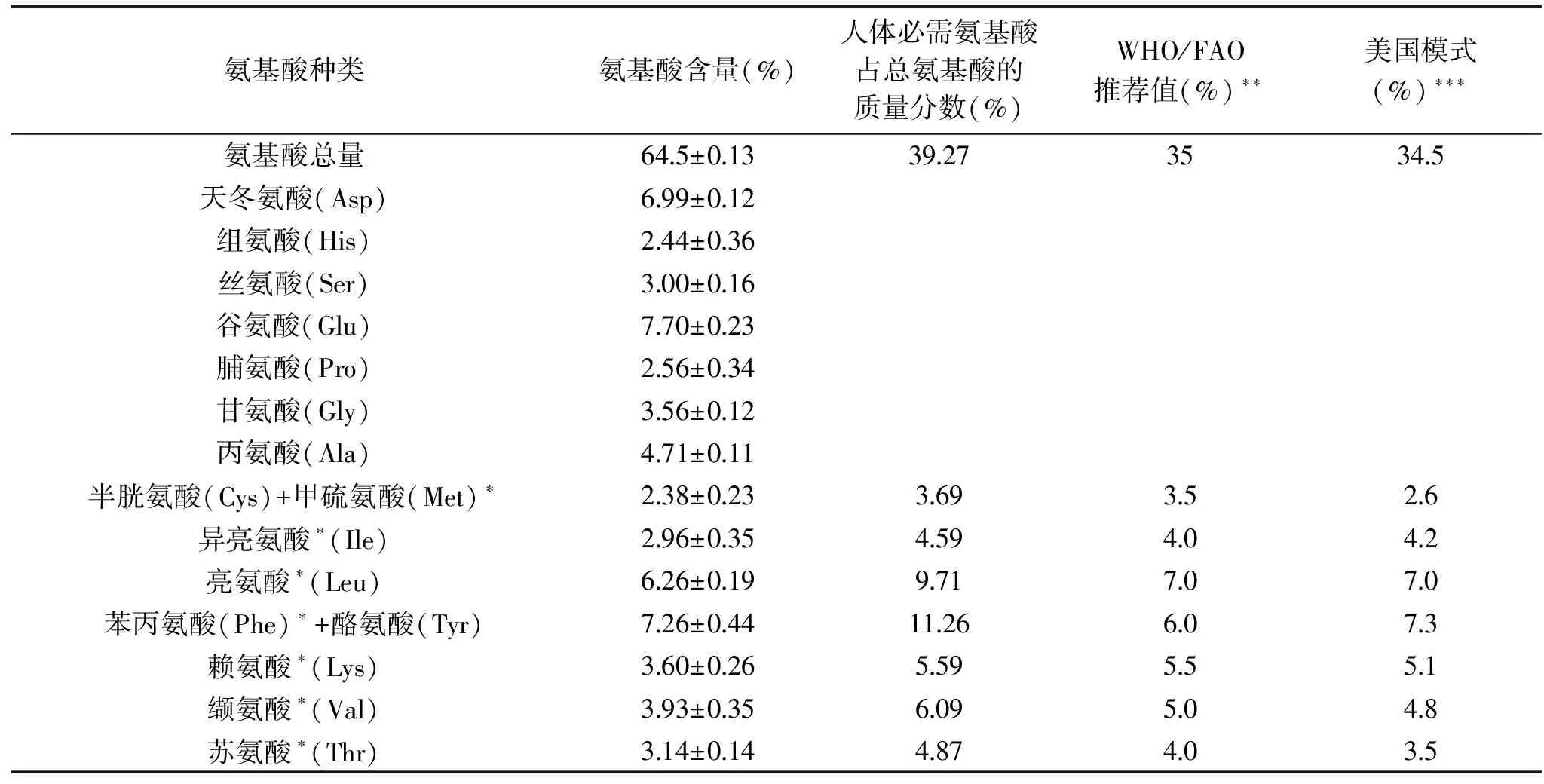
表1 辣木叶蛋白氨基酸组成Table 1 Amino acid composition of Moringa oleifera leaves protein
辣木叶蛋白中必需氨基酸之间的比例适宜,含量均高于WHO/FAO标准模式及美国模式,与人体需求较为接近,营养价值高,必需氨基酸占氨基酸总量的比例(39.27%)高于WHO/FAO推荐值(35.0%)及美国模式(34.5%),是一种优质蛋白资源。
2.2 辣木叶蛋白抑菌圈实验
辣木叶蛋白抑菌圈实验结果如表2,显示辣木叶蛋白对大肠杆菌无抗菌活性,对金黄色葡萄球菌具有抗菌活性,抑菌圈大小为(7.67±0.24) mm,属低敏程度,这可能是因为大肠杆菌与金黄色葡萄球菌相比,具有外壁层,其主要由脂多糖及脂蛋白组成,脂多糖可以有效阻碍植物抑菌蛋白类大分子物质进入[22],从而有效保护大肠杆菌。金黄色葡萄球菌细胞壁肽聚糖含量高,辣木叶存在的天然抗菌剂可抑制肽聚糖四肽侧链与甘氨酸5联桥之间的联结,而干扰肽聚糖的合成,从而抑菌金黄色葡萄球菌[23]。

表2 辣木叶蛋白抑菌圈实验Table 2 Inhibition zone experiment of Moringa oleifera leaves protein
2.3 辣木叶蛋白质酶解物的抑菌活性
2.3.1 单酶酶解结果 从表3的结果可知,6种酶的酶解产物对大肠杆菌均无抑菌性,对金黄色葡萄球菌则都显示抗菌活性,根据抗菌肽抑菌机理,可能是与细菌细胞壁的差异有关,金黄色葡萄球菌细胞壁含较多带有负电性的肽聚糖,并且为网状结构,酶解产生的阳离子型抗菌肽更易与其结合,使细胞壁结构变性并通过,然后通过静电作用与细胞膜相互作用,改变膜构象或形成离子通道,使内容物泄露来致死靶细胞[24]。此外,与辣木叶蛋白抑菌实验结果比较,6种酶的酶解产物对金黄色葡萄球菌表现出的抑菌活性都较蛋白强,且采用胰蛋白酶水解之后的酶解产物抗菌活性最强,抑菌圈大小(10.67±0.94) mm,属高敏程度,这可能与胰蛋白酶酶切位点有关,胰蛋白酶以碱性氨基酸如赖氨酸、精氨酸等氨基酸所在位置作为酶切位点,一定程度上,满足了抗菌肽对一级和二级的结构要求[25]。

表3 单酶酶解抑菌圈实验结果Table 3 Inhibition zone experiment results of of single enzymes enzymatic
2.2.2 复合酶酶解结果 由表4分析结果可知,复合酶酶解产物均只对金黄色葡萄球菌显示抗菌活性,其中,胃蛋白酶和胰蛋白酶分步酶解得到的酶解产物抗菌活性最强,抑菌圈大小为(10.83±0.62) mm,相较于单酶酶解的抑菌圈大小有提升,这可能与胰蛋白酶和胃蛋白酶的专一性酶切特性有关,由于胃蛋白酶切割位点为疏水性氨基酸,因此,切割片段两端多为疏水性氨基酸;而酶解产物中疏水性残基片段越多,越易与细胞膜上的疏水区域结合[26],再通过某种特殊的抗菌方式实现其抗菌作用。

表4 复合酶酶解抑菌圈实验结果Table 4 Inhibition zone experiment results of complex enzyme enzymatic

表6 MIC实验结果Table 6 Results of MIC experiment
胰蛋白酶则可断裂精氨酸形成的肽键,富含精氨酸的肽具有的阳离子性和氢键特性有利于与细菌细胞膜上的阴离子组分结合,进而通过改变菌膜通透性或形成离子通道达到抑菌效果[27]。
2.4 酶解产物的抑菌谱研究
复合酶解所得酶解液的抑菌圈实验结果如表5,可知,辣木叶蛋白经胃蛋白酶结合胰蛋白酶复合酶酶解制备的酶解产物对金黄色葡萄球菌、单增李斯特菌及化脓性链球菌这3株革兰氏阳性菌均产生了抑菌作用,抑菌圈大小分别为(10.96±0.47)、(9.33±0.47)、(11.70±0.94) mm。且酶解产物对化脓性链球菌的抑菌效果与阳性对照氨苄青霉素相差较小,抑菌圈大小仅差2.44 mm。

表5 酶解产物的抑菌谱Table 5 Antibacterial spectrum of enzymatic hydrolysis products
2.5 最小抑菌浓度结果
针对复合酶解产物具有的抑制革兰氏阳性菌作用,测定其最小抑菌浓度(MIC),值越小表明活性越强,可见酶解产物对化脓性链球菌的MIC最小,为2.5 mg/mL,抑菌效果最明显。对单增李斯特菌的MIC最大,为10 mg/mL,而金黄色葡萄球菌居中,为5 mg/mL。对比孙宜君[28]分离纯化出螺旋藻抗菌肽纯品对金黄色葡萄球菌最低抑制浓度为16 mg/mL。本实验中粗酶解产物具有较好的抑菌活性,且化脓性链球菌与金黄色葡萄球菌为存在于人体表面的细菌,针对辣木叶对化脓性链球菌的抑菌效果可进一步优化并扩大其应用范围。
3 结论
本研究以辣木叶为原料,提取辣木叶蛋白,提取率为32.67%±0.45%,氨基酸分析结果表明辣木叶蛋白氨基酸含量高,必须氨基酸种类齐全,且占氨基酸总量的比例高于大豆及花生,是一种优质蛋白质。蛋白粗提取对大肠杆菌无活性,对金黄色葡萄球菌显示抗菌活性,抑菌圈实验结果(7.67±0.24) mm。单酶酶解和复合酶酶解效果比较发现胃蛋白酶+胰蛋白酶酶解效果最优。酶解产物抑菌谱研究发现复合酶酶解产物对革兰氏阳性菌金黄色葡萄球菌、单增李斯特菌及化脓性链球菌显示抑菌活性,且对化脓性链球菌显示最强抑菌活性。以上结果表明,复合酶酶解制备的辣木叶蛋白酶解产物具有较好的抗菌活性,可开发成一种新型植物抗菌肽。但是酶解产物的抗菌机理,以及其中多肽的氨基酸序列等尚不明确,需要进一步纯化处理并探究其多肽组成和抗菌机制。为其实际应用提供更加全面的理论研究基础。

