亮氨酸拉链型脂肽对脂质体温敏性调节的分子模拟
许谢君,肖兴庆,徐首红,刘洪来,*
1华东理工大学化学与分子工程学院,化学工程国家重点实验室,上海 200237
2 Chemical and Biomolecular Engineering, North Carolina State University, Raleigh, NC 27695-7905, USA.
1 引言
癌症已逐渐成为人类健康的头号大敌,目前的癌症治疗手段仍以化学治疗方法为主—使用抗癌药物直接作用于癌细胞进而杀死癌细胞1,2。由于大部分抗癌药物有很强的毒性,杀死癌细胞的同时存在着破坏正常细胞和健康的内脏组织的可能。应用拥有靶向性的药物载体将药物准确输送至癌细胞周围再释放,可以大大降低上述副作用。
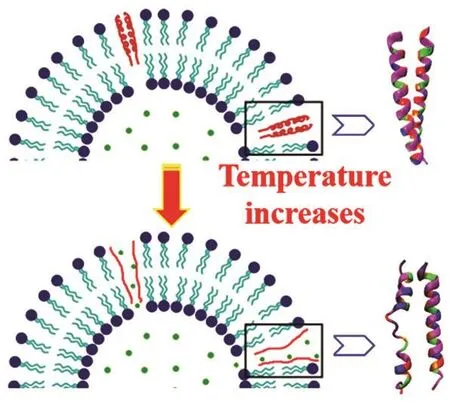
脂质体因其特有的良好生物相容性而逐渐受到重视而被做为药物载体。但传统脂质体的靶向性不足,通过各个途径进入人体血液循环后,无法被输运至特定的癌变部位,导致药效大大不如预期甚至危害到人体的健康器官和组织。近年来,对传统脂质体进行修饰和改造以提高其靶向性的研究受到广泛关注,目前已经有许多新型脂质体3,4被开发和使用。另一方面,脂质体被准确输运至癌细胞周围的同时还需要脂质体能快速释放出抗癌药物,这就要求脂质体须在正常组织环境下保持稳定,而在癌细胞周围丧失稳定性进而将其负载的抗癌药物释放出来以杀死癌细胞。由于癌变组织所在位置常常会出现pH、温度等方面的异常,因此pH或温度敏感的脂质体的开发成为药物载体研究的重要方向。Hyperthermia疗法5是一种针对局部病灶进行加热进而杀死特定位置癌细胞的放射治疗方法,利用局部升温这一特点,温敏性的脂质体就可以携带抗癌药物到达高温病灶部位,借由局部高温破坏脂质体的稳定性在病灶处释放出抗癌药物来准确地杀死癌细胞。Al-Ahmady等人6首次将亮氨酸拉链的结构[VSSLESK-VSSLESKVSKLESK-KSKLESK-VSKLESK-VSSLESK]引入脂质体,得到了一种新型的温敏脂质体(图1),这种新型的温敏脂质体可以配合hyperthermia疗法使用。
亮氨酸拉链7,8是一种独特的七元重复单元结构(abcdefg)n(图2),其中亮氨酸总是出现在七元重复单元的d的位置上,所以称之为亮氨酸拉链结构。它通过疏水作用形成多聚体的立体结构,当温度升高至特定温度时,会解离成无序的肽单体,利用这一特性Al-Ahmady等6对传统温敏脂质体进行了改良得到了热敏性更佳的新型温敏脂质体。
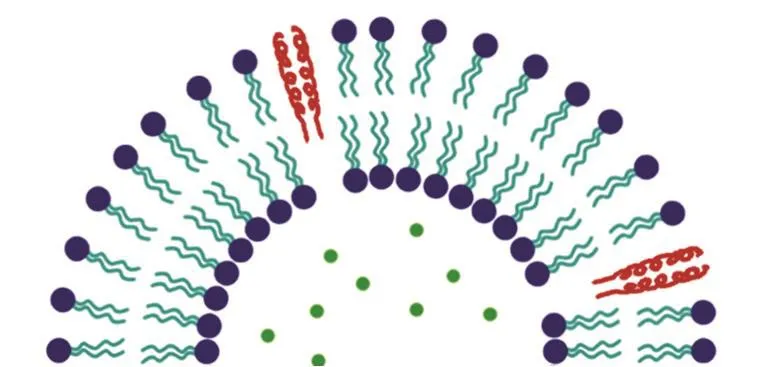
图1 包含亮氨酸拉链型脂肽的温敏性脂质体Fig. 1 Thermosensitive liposome with leucine zipperstructured lipopeptides.
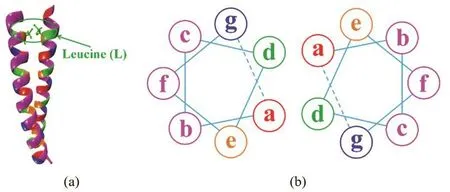
图2 亮氨酸拉链型脂肽结构Fig. 2 Leucine zipper-structured lipopeptides.(a) double helix structure of leucine zipper; (b) overhead view of a leucine zipper, where site d is predominantly occupied by the leucine residue.

表1 亮氨酸拉链型脂肽及其序列Table 1 Sequences of leucine zipper-structured lipopeptides.
我们课题组对这种嵌入了亮氨酸拉链的温敏脂质体做了进一步的改良9-11,我们设计了新的氨基酸残基序列[VAQLEVK-VAQLESK-VSKLESKVSSLESK],并在N端进行修饰加入了不同的功能性头基,以期改善脂肽温敏性进而得到更适宜的温敏脂质体。我们主要以烷烃类头基作为修饰,实验发现随着烷烃头基碳链的增长脂肽转变温度也随之升高,说明烷烃头基碳链的加长会提高脂肽的热稳定性10。为了探索不同修饰基团对脂肽温敏性的影响以设计更适宜的温敏脂肽,从分子角度解释温敏性脂肽的特性,为开发更好的温敏脂质体提供参考,我们用分子动力学模拟进行了探索性的研究。在前期工作中12,我们使用隐式溶剂模型的副本交换分子动力学(replica exchange molecular dynamics,REMD)模拟方法研究了2种不同头基的亮氨酸拉链结构脂肽单体(ALA,C5CO),并采用二面角主成分分析法(dihedral principal component analysis,dPCA)结合DSSP程序得到这两种亮氨酸拉链型脂肽的转变温度分别为324.8 K以及319.1 K,其中C5CO链的转变温度319.1 K与实验测定的该链的转变温度321.1 K相当接近,证明了这种模拟方法对于亮氨酸拉链型脂肽研究的可行性9。为了进一步探索N端修饰对于脂肽温敏性的影响,我们又设计了另外2种不同头基修饰的亮氨酸拉链脂肽,并进行REMD模拟,以期判断头基与脂肽温敏性的相关影响关系。在原有研究的基础上,本文还构建了嵌入温敏性脂肽二聚体的DPPC脂质体,使用分子动力学模拟的方法研究温敏性脂肽对于脂质体相转变温度的影响。
2 模拟方法
2.1 亮氨酸拉链结构脂肽
我们在原有的亮氨酸拉链肽链序列[VAQLEVK-VAQLESK-VSKLESK-VSSLESK]的N端修饰两种不同功能性头基,获得了两种新型亮氨酸拉链型脂肽,分别命名为C3CO以及POCH脂肽,其结构如表1所示。
C3CO脂肽的设计主要是用于与C5CO脂肽进行比较,以探索N端烷烃头基长度对于脂肽转变温度的影响并印证实验规律的正确性10;POCH脂肽使用的是磷脂DPPC的头基,引入这一头基主要是为了考察磷脂头基与烷烃头基对于脂肽温敏性作用的差异性,以此寻找更多可行的功能性基团。因为所使用的亮氨酸序列都是带有一价正电荷,所以在模拟时我们加入了对应数量的反离子Cl-使得整个体系保持电中性。
2.2 亮氨酸拉链型脂肽的模拟方法
2.2.1 量子力学计算
在亮氨酸拉链序列的N端修饰了一个CH3―(CH2)2―CO―疏水基团,在标准Amber力场里并没有包含此疏水基团的电荷(文中电荷单位皆为Gromacs基本电荷单位电子电荷e),所以需要使用Gaussian 09W软件进行量化计算以得到该基团的原子电荷。由于在C3CO脂肽中,CH3―(CH2)2―CO―的疏水基团直接连接着缬氨酸残基(V),所以在量化计算时也将CH3―(CH2)2―CO―的疏水基团与缬氨酸残基(V)直接连接,如图3。
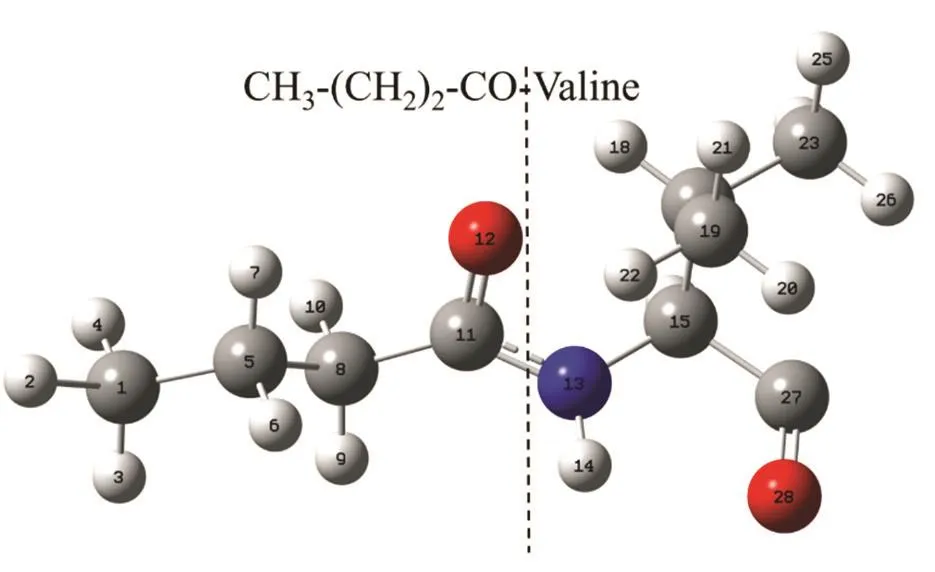
图3 连接着缬氨酸的疏水性基团CH3―(CH2)2―CO―Fig. 3 The hydrophobic group CH3(CH2)2―CO―capped by the valine residue.The total charge of the molecule is +e.
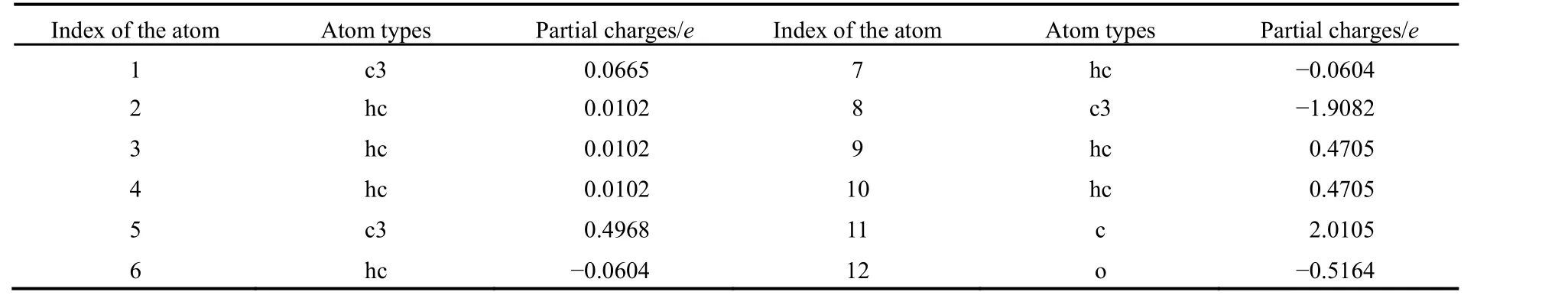
表2 疏水性基团CH3―(CH2)2―CO―的电荷Table 2 Partial charges of the hydrophobic group CH3―(CH2)2―CO― in the C5CO peptide.
因为b3lyp/6-31g(d)是利用电子密度取代波函数作为描述体系能量的变量,所优化得到的分子构型更接近于其在真实水溶液中的构型,所以我们先使用b3lyp/6-31g(d)基组对分子结构进行优化。然后再在HF/6-31g(d)下计算得到了分子的表面静电势,HF/6-31g(d)方法计算分子表面静电势是其在真空状态下的静电势,进而拟合出其在真空状态下的点电荷。在随后的全原子分子模拟过程中,无论是利用隐式水模型还是显式水模型,水对电荷相互作用的影响都已经考虑进去。最后通过两步法(RESP)13-15得到了各原子的电荷,见表2,具体细节可以参考我们的前期工作12。
2.2.2 交换分子动力学模拟
使用Gromacs 4.5.5程序包16,17在Amber force field 14SB力场18下进行所有的隐式溶剂模型REMD模拟,GBSA方法使用Onufriev-Bashford-Case模型19处理溶剂效应。共轭梯度法被应用于初始结构的能量优化,接着将优化好的C3CO和POCH单链结构在16个不同温度下(285、295、300、305、310、315、320、325、330、335、360、380、410以及460 K)进行100 ns的REMD模拟。V-rescale和Berendsen weak coupling算法分别被用于温度和压力的平衡,具体细节可以参考先前的工作12。
2.3 质体模拟研究
2.3.1 质体建模
在亮氨酸拉链结构单链的研究基础上,本文还着重研究了脂肽对于脂质体相转变温度的影响。为了能够更显著的观察亮氨酸拉链型脂肽对于脂质体相转变温度的影响,我们选择了转变温度最高的ALA脂肽(324.8 K)以及转变温度最低的C3CO脂肽(312.1 K)进行模拟。将脂肽多聚体嵌入同一种脂质体DPPC中,搭建了一个包含脂肽、水以及DPPC的大分子生物体系。由于脂质体所含分子数过多,如果模拟一个完整的脂质体将耗费过多的计算时间,而实际上通过模拟脂质体的一部分就可以得到关于脂质体稳定性的准确信息,故本文使用PACKMOL软件20,21仅搭建了脂质体的一部分结构进行模拟分析。
首先使用SWISS model软件22-24生成了2个脂肽(ALA,C3CO)的二聚体结构,用PACKMOL软件建立DPPC脂质体结构并嵌入二聚体。模拟系统为一个7.2 nm × 7.2 nm × 10 nm的盒子,在0 ≤Z≤ 2.5 nm以及7.5 nm ≤Z≤ 10 nm的空间中分别加入2738个水分子总共5496个水分子,在2 nm ≤Z≤ 5 nm以及5 nm ≤Z≤ 8 nm的空间中分别加入60个排列整齐的DPPC分子形成一个简单的双分子层结构,在双分子层中心位置插入一个由SWISS model构建的脂肽二聚体结构,由此得到了2个含有不同亮氨酸拉链型脂肽的DPPC双分子层结构以及1个不包含脂肽的DPPC双分子层结构作为分子动力学模拟的初始结构,见图4。体系中添加了对应数量的反离子Cl-,使得体系呈电中性。
2.3.2 肽的脂质体的模拟方法
本文使用Amber 15软件包进行脂质体的模拟分析。综合考虑肽链ALA以及C3CO的转变温度,我们选择了它们的转变温度(324.8和312.1 K)附近的四个温度310、315、320以及325 K作为模拟温度,在每个温度下均进行50 ns的分子动力学模拟。
Amber force field 14SB力场18被用于脂肽二聚体,Amber force field lipid 14力场25被用于DPPC脂质体,而水分子则是使用TIP3Pmodel26。模拟的详细流程如下:(1)先进行5000步的最陡下降法和共轭梯度法对脂肽和脂质体进行能量优化,接着再对整个系统进行5000步的能量优化;(2)将系统温度从0 K开始缓慢提升,先以10 K/1000步的速度上升到300 K,接着以5 K/1000步的速度上升到模拟温度;(3)在NPT系综下运行5 ns使系统维持在标准大气压下即101.325 kPa;(4)最后运行50 ns的分子动力学模拟。

图4 含有亮氨酸拉链结构的DPPC双分子层的初始结构Fig. 4 Initial structures of the lipopeptide dimers complexed with lipid DPPC bilayer and water.(a) blank, (b) ALA, (c) C3CO.
3 结果与讨论
3.1 脂肽模拟分析
在100 ns的C3CO和POCH单链的REMD模拟后,我们选择最后30 ns的轨迹文件进行分析,计算了两条链在各个温度下势能的变化并且选择了325 K为初始副本温度的这一副本绘制了它的温度随模拟的进行的温度交换曲线(图5)。从图5可以看到,最后30 ns中各相邻温度的势能有着充分的重叠,相邻温度也有着充分的交换,说明了最后30 ns的轨迹是可以用于分析和讨论的。
我们选择最后30 ns的轨迹文件进行二面角(φ和ψ)主成分分析(dPCA)27,28进一步得到自由能面图(图6)。以φ为例,从图6中可以看到,无论是C3CO还是POCH脂肽,其自由能面图的深色区域都是随着温度的升高而扩大,这说明了脂肽结构的稳定性会随着温度的升高而降低,意味着亮氨酸拉链型脂肽存在着温度敏感性,这与实验现象相一致9。
自由能面图中的最深色区域就是相对自由能最低的区域,从中可以得到该温度下的单链特征结构。每个单链有16个模拟温度,每个温度选择两种二面角进行主成分分析,每个二面角自由能面图中取3个特征结构,因此对于每一种单链,选择了96个点进行分析。
在得到了96个特征结构后,我们使用DSSP方法29结合最小二乘法确定C3CO以及POCH脂肽的转变温度,见图7。可以看到C3CO的转变温度为312.1 K而POCH的转变温度为319.4 K,之前的工作中12得到的C5CO脂肽的转变温度为319.1 K,由此可知疏水头基中烷烃碳链的增长会提高脂肽的转变温度,即提高脂肽的热稳定性,这一规律与实验所述规律保持一致10;而POCH脂肽的转变温度319.4 K和C5CO脂肽的转变温度319.1 K相当接近,其中C5CO脂肽已经在实验中9得到认可,说明POCH脂肽对于该新型温敏脂质体也具有开发潜质。
3.2 脂质体模拟分析
结合SWISS model和PACKMOL两个软件搭建了含有2种不同亮氨酸拉链型脂肽(ALA与C3CO)以及1个不包含脂肽的DPPC药物载体的初始结构,利用AMBER 15软件在脂肽的转变温度附近(310、315、320、325 K)进行50 ns的分子动力学模拟。
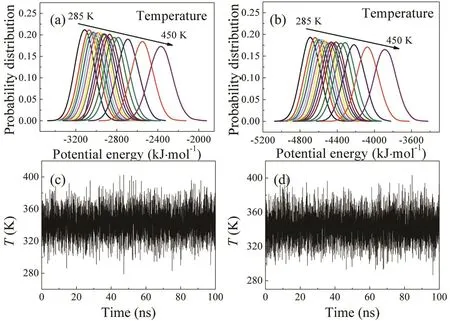
图5 亮氨酸拉链的势能概率分布图((a) C3CO,(b) POCH)以及亮氨酸拉链在325 K副本下副本交换图((c) C3CO,(d) POCH)Fig. 5 The probability distributions of the potential energy of the replicas ((a) C3CO, (b) POCH) and time series of temperature exchanges at 325 K ((c) C3CO, (d) POCH).
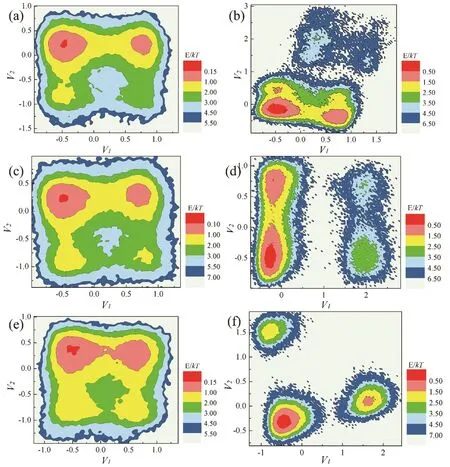
图6 (a,b) 285 K,(c,d) 325 K以及(e,f) 380 K温度下,C3CO、POCH脂肽的自由能面图(φ)Fig. 6 Free energy landscape (φ) along the first two principal components (V1, V2) for the C3CO lipopeptide at(a) 285 K, (c) 325 K and (e) 380 K, and for the POCH lipopeptide at (b) 285 K, (d) 325 K and (f) 380 K.
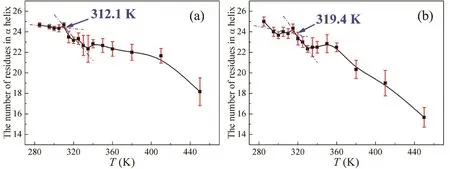
图7 温度对于(a) C3CO,(b) POCH脂肽的α螺旋结构的影响Fig. 7 The effect of temperature on the α-helical conformation of the (a) C3CO and (b) POCH lipopeptides.The least square method is used to determine the temperature-dependence conformation transition. Calculation errors are estimated by the standard errors of the mean.
通过50 ns的分子动力学模拟,得到了模拟过程中RMSD随时间的变化曲线,图8。从图中可以看到,3种不同结构的RMSD分别在4个不同温度下逐渐趋于稳定,这说明这16个50 ns的模拟结果是稳定可靠的。因此我们选择了最为平衡的最后5 ns轨迹进行分析,研究不同脂肽对于脂质体DPPC的影响。
脂分子面积指的是单个磷脂分子所占空间的面积(不包含Z方向),是磷脂分子的主要特征之一,可由下式计算得到:
图8 脂肽二聚体在50 ns分子模拟中在310,315,320以及325 K的RMSD曲线Fig. 8 The RMSD profiles of the lipopeptide dimers in the 50 ns conventional MD simulations at 310, 315, 320 and 325 K.(a) blank, (b) ALA, (c) C3CO.
Slipid= (X × Y)·nlipids(1)其中Slipid代表脂分子面积,X代表盒子在X方向的总长度,Y代表盒子在Y方向的总长度,nlipids代表每层所含有的磷脂分子总数(在本实验中,n = 60)。
电子密度分布表示了脂质体单位体积内所含电子数目的多少。电子密度分布经常与实验所得的结果进行比较以此来判断模拟的正确性,而本文利用这一分布来观察脂质体的稳定性。
以脂质体中心面Z = 0为基点,就可以得到距离Z = 0这一平面不同位置处单位体积脂质体的电子密度。
ρe= ne/(X × Y × Zi) (2)其中ρe代表电子密度,ne代表在所选择空间中总的电子数,X代表盒子在X方向的总长度,Y代表盒子在Y方向的总长度,Zi代表所选择空间距离双分子层结构中心面Z = 0的Z方向的长度。
脂分子面积是对磷脂分子纵向切割后的分析,而电子密度分布则是对磷脂分子横向切割后的分析,综合两者可以观察脂质体整体的变化。
图9的a、b、c三个子图是包含不同亮氨酸拉链型脂肽的DPPC脂质体的脂分子面积随温度的变化曲线。可以看到,在选择的310-325 K温度区间内,所有脂质体的脂分子面积都是随着温度的升高而变大,这说明随着温度的升高单个磷脂分子所占据的空间增大,也就意味着随着温度的升高,磷脂双分子层在逐渐解聚。

图9 310,315,320和325 K时DPPC脂质体的脂分子面积以及电子密度随温度的变化曲线Fig. 9 The area per lipid for DPPC bilayers and electron-density profile for DPPC bilayers at 310, 315, 320 and 325 K.(a, d) blank, (b, e) ALA, (c, f) C3CO.
再通过最小二乘法得到了各个含有不同脂肽的脂质体双分子层的相转变温度,结果显示不包含脂肽的DPPC相转变温度为315.1 K,包含ALA脂肽的DPPC相转变温度为319.9 K,包含C3CO脂肽的DPPC相转变温度为314.4 K。结合ALA脂肽的转变温度324.8 K以及C3CO脂肽的转变温度312.1 K可以说明这种全新改良的亮氨酸拉链型脂肽的加入对于DPPC脂质体的相转变温度有显著的影响。当脂肽的转变温度高于脂质体原本的相转变温度315.1 K时,脂肽的加入会使得DPPC的相转变温度升高;反之,如果所加入的脂肽转变温度低于脂质体原本的相转变温度,那么脂质体的相转变温度会降低。
由图9的d、e、f可以看到,随着温度的升高,在相同距离处的磷脂双分子层的电子密度都在降低,这反映了对于脂质体的横向空间其体积在不断扩大,也说明了随着温度的升高磷脂双分子层会发生解聚。
从每个磷脂双分子层随温度变化而产生的电子密度变化曲线中可以看出脂质体的结构突变点的温度范围:无脂肽为310-315 K,含有ALA脂肽为320-325 K,含有C3CO脂肽为310-315 K,这与图9(a)、(b)、(c)中的各个DPPC脂质体的相转变温度315.1、319.9、314.4 K相一致。
4 结论
本文采用分子动力学模拟的方法,对亮氨酸拉链型脂肽以及嵌入该脂肽的新型温敏脂质体进行了模拟研究。通过隐式水模型REMD模拟得到了C3CO和POCH两条新型亮氨酸拉链型脂肽的转变温度分别为312.1和319.4 K,结合前期工作12得到的C5CO脂肽转变温度319.1 K,发现随着疏水头基烷烃碳链的增长脂肽的转变温度也会随之升高,这一规律与实验10所得规律相吻合。通过比较嵌入2种不同亮氨酸拉链型脂肽(ALA,C3CO)的DPPC磷脂双分子层与未嵌入脂肽的DPPC磷脂双分子层的模拟结果,综合脂分子面积以及电子密度分布随温度的变化,证明这种新型的温敏亮氨酸拉链型脂肽二聚体的加入确实会影响DPPC脂质体的相转变温度,且相转变温度的大小是由脂肽转变温度的高低决定的。这就说明我们只需调整脂肽的修饰头基的结构,改变其转变温度就能控制磷脂的相转变温度,进而得到效果更佳的新型温敏脂质体。这一发现有利于该类药物载体的优化设计,也为设计和改良新型的温敏性脂质体药物载体提供了更大的可能。

