日本红枫‘青龙’组织培养与快速繁殖
孙红英,辛全伟,林兴生,罗海凌,林 辉,马志慧,严少娟,c,兰思仁
(福建农林大学 a.林学院;b.国家菌草工程技术研究中心;c.资源与环境学院,福建 福州 350002)
日本红枫青龙羽毛枫Acer palmatum‘seiryu’是1965年由荷兰鹿特丹Trompenburg 树木园的J.R.Pn Hoey Smith 培育的新品种,在欧美大量运用。该品种于1984年得到英国皇家园艺协会“提名荣誉”奖,被欧美园艺界公论为近几十年来杰出的新品种。青龙羽毛枫为落叶小乔木,高可达8 m,此品种虽然有着秀丽的叶形,属于羽毛枫类,但茎杆直立、不下垂。叶色春季嫩绿,夏季亮绿,秋季转为鲜艳的红铜色,夏季偶有焦叶现象,叶掌深裂几达基部,为7~11 深裂,裂片狭长又有羽状细裂,具细叶齿。生长势强,速度快,树姿优美,无论是孤植、群植还是作为行道树种植,能以“红袖善舞翠云间”的火热魅力,让人们陶醉其中,怡然自得,是优秀的园林观叶植物新品种。若以常绿树或白色墙体为背景,景观尤为美丽。
青龙繁殖较为困难,扦插成活率低。目前,青龙繁殖以嫁接为主,但由于砧木与接穗的亲和关系,嫁接成活率不理想[1]。本实验通过植物组培快繁技术,建立起青龙组培快繁体系,成活率达到90%以上,为工厂化育苗提供技术支撑。
1 材料与方法
1.1 实验材料
实验材料取自福清市马洋亭下花木种植农民专业合作社,选取健壮、无病虫害、当年半木质化的枝条。将枝条切除叶片和叶柄后,在自来水下冲洗干净,然后在超净工作台上用无菌滤纸吸干表面的水分,用75%酒精消毒40 s,无菌水冲洗3 遍,接着用0.1% HgCl2溶液消毒10 min,无菌水冲5 遍,用无菌滤纸吸干水分,待用。
1.2 培养条件
培养基为木本专用培养基WPM,pH 值调整至5.8,添加琼脂6.5 g/L,蔗糖30 g/L。光照时间12 h/d,光照强度50~70 mol/m2s,培养温度25~28 ℃,环境湿度60%~70%。
1.3 实验方法
1.3.1 青龙启动培养
采用以下6 种培养基进行启动培养:1)WPM+ 0.01 mg/L TDZ;2)WPM + 0.03 mg/L TDZ;3)WPM+0.05 mg/L TDZ;4)WPM+0.07 mg/L TDZ;5)WPM+0.09 mg/L TDZ。以上各培养基均添加30 g/L 蔗糖和6.5 g/L 琼脂,pH 值5.8。每瓶接种1个外植体,每个处理30瓶,重复3次。30 d后,观察腋芽的生长情况,统计启动率。
1.3.2 青龙的继代培养
采用L9(34) 正交试验设计,TDZ 为3 个水平:0.04、0.06、0.08 mg/L。生长素IBA 3 个浓度梯度为:0.1、0.3、0.5 mg/L。蔗糖分别为:10、20、30 g/L。接种30 d 后统计增殖系数(表1)。
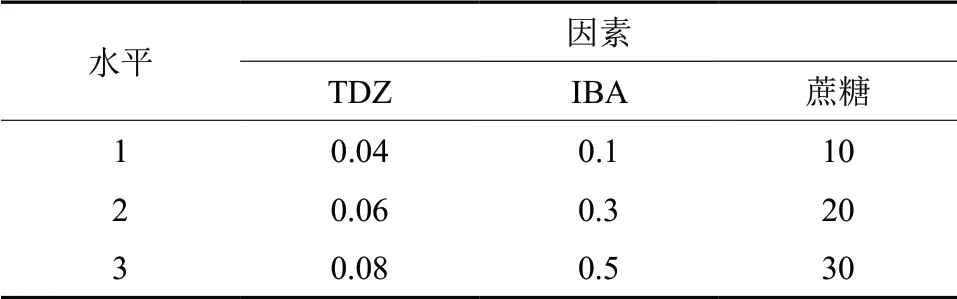
表1 不同培养基对青龙增殖系数的影响Table1 Effect of medium types on the proliferation of Acer palmatum ‘seiryu’
1.3.3 生根培养
将株高2~3 cm,带有4 片以上叶片的无根壮苗,转接到以1/2 WPM 为基本培养基,分别添加0.1、0.2、0.3、0.4 和0.5 mg/LNAA 的生根培养基上。每种培养基接种22 瓶,每瓶4 株,重复3 次,进行生根培养。30 d 记录根数,根长,生根株数,最后计算平均根数,平均根长,平均生根率。
1.3.4 炼苗移栽
将组培室培养30 d 后的生根苗放到自然环境条件下,放置3~5 d。拧开组培瓶瓶盖,放置2 d,定时进行叶片喷水保湿,保证叶片伸展无卷叶焦叶,促使组培苗适应自然环境条件。将组培苗从瓶中取出,在清水中洗掉培养基,放到5%的高锰酸钾溶液中消毒5 min,最后,用自来水清洗干净,移栽到珍珠岩∶蛭石∶泥炭土体积比为1 ∶1 ∶1的基质中,定时喷淋,30 d 后统计移栽成活率。移栽成活率 = 存活苗数/移栽苗数 × 100%。
1.4 数据处理与分析
启动率=茎段萌芽数/接种后无菌茎段总数×100%;增殖系数=诱导后不定芽总数/原接种茎段总数;平均根数=总生根根数/生根株数×100%;平均根长=总生根根长/生根根数×100%;生根率=生根个数/接种个数×100%。
试验数据采用SPSS 16.0 和Excel 2003 软件进行统计分析。
2 结果与分析
2.1 启动培养
以青龙茎段为外植体,接种于添加TDZ 的WPM 培养基中(表2),7 d 左右腋芽开始萌发,叶柄脱落,随后,腋芽茎段伸长。从表2中可以得出,TDZ 浓 度 在0.01~0.05 mg/L 时,随 着TDZ 浓度的升高,启动率逐渐升高;TDZ 浓度在0.05~0.09 mg/L 时,TDZ 浓度的升高,启动率逐渐降低。最终筛选出青龙最佳启动率培养基为:WPM + 0.05 mg/L TDZ + 30 g/L 蔗糖 + 6.5 g/L 琼脂,启动率为96.1%,其芽生长快,叶片较绿,茎段较粗,基部愈伤组织小。
2.2 增殖培养
将经过启动培养的腋芽切下,接种到表3中的培养基中进行增殖培养。从表3中得出,培养基中添加物对青龙增殖有不同影响。TDZ 对青龙的增殖影响较大,其次,生长素IBA,但外源添加物蔗糖对青龙增殖影响不显著。3 种物质对青龙增殖作用顺序为:TDZ >IBA >蔗糖。TDZ 在青龙的继代培养中,作用最大,其R值为1.53。TDZ 的3 个浓度梯度0.04、0.06 和0.08 mg/L,其K值分别是2.30、3.83 和3.03,可见,青龙的增殖系数并不是随着TDZ 浓度的增加而增加。不同处理组合都有不同程度的增殖,其增殖系数最大的是5 号培养基,增殖系数为4.8。青龙增殖最佳培养基为:WPM+0.06 mg/L TDZ+0.3 mg/L IBA+琼脂6.5 g/L+ 蔗糖30 g/L。

表3 不同植物生长物质对青龙增殖的影响Table3 Effects of different plant growth regulators on the proliferation of Acer palmatum ‘seiryu’
从表4方差分析中看出,在青龙继代过程中,TDZ 对增殖系数影响最大,其F值56.713,在0.05 水平达到显著;其次为生长素IBA,其F值为22.250,在0.05 水平达到显著。其蔗糖,F值为7.107,在0.05 水平不显著。此结果与极差分析结果一致。
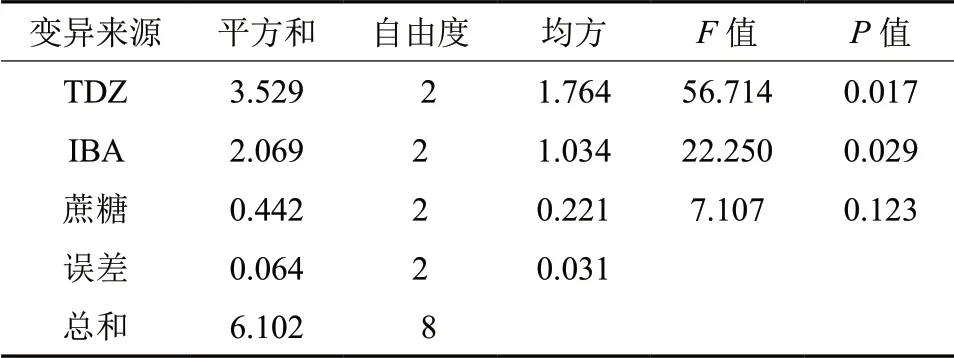
表4 不同植物生长物质对青龙增殖影响的方差分析Table4 Variance analysis of plant growth regulators on the proliferation of Acer palmatum ‘seiryu’
2.3 生根培养
将继代培养一周期(30 d),高度1~3 cm的单株接种到添加不同浓度NAA 的生根培养基中。15 d 左右根基部凸起,根原基形成,20 d 从根原基上长出嫩根,30 d 根长至3 cm 左右。从表5中可以看出,NAA 浓度在0.1~0.3 mg/L,随着NAA 浓度的升高,平均根长逐渐升高,平均根数逐渐增加。NAA 浓度在0.3~0.5 mg/L,平均根长、平均根数和生根率逐渐下降,而NAA 浓度0.3 mg/L 时,生根较快,根系较粗,生根时间短,生根率较高。最终,筛选出青龙生根培养基为1/2 WPM + 0.3 mg/L NAA+6.5 g/L琼脂 + 30 g/L蔗糖,其生根率达96.7%。

表5 不同浓度NAA对青龙生根的影响Table5 Effects of different concentrations of NAA on rooting of Acer palmatum ‘seiryu’
2.4 炼苗移栽
移栽30 d 后,青龙组培苗的成活率达到90%以上。移栽50 d,青龙组培苗叶片舒展变大,叶片深绿色,顶芽有新叶长出。
3 结论与讨论
基本培养基是植物组织培养的重要基质,由于各种植物的遗传背景、生物学特性不同,因而对营养成分的需求也不同,选择合适的培养基对于组织培养至关重要[2-3]。本实验以木本培养基WPM 为基本培养基,添加各种植物激素,促进腋芽诱导、丛生芽诱导、生根诱导,均达到较好的效果,这与谈凯等研究日本红枫愈伤组织诱导分化的研究相一致[4]。
TDZ 作为一种高效的细胞分裂素,在启动培养和继代培养中的作用已在包括元宝枫等槭属植物组培中得到证明[5]。在青龙启动培养过程中,使用0.01 mg/L TDZ 启动率低,仅为55%;使用0.05 mg/L TDZ 启动率较高,为96.1%;当TDZ 使用浓度为0.09 mg/L 时,启动率为63%。低浓度的TDZ 促进生长,高浓度抑制生长,这与植物激素的双重性一致。TDZ 使用浓度为0.09 mg/L 时,因浓度较高,青龙组培苗出现玻璃化现象,导致有效苗数减少,进而降低了腋芽的启动率。最终优选出启动培养的培养基为WPM + 0.05 mg/L TDZ + 30 g/L 蔗糖 + 6.5 g/L 琼脂,启动率为96.1%。
在丛生芽诱导过程中随着TDZ 浓度的不断增高,芽体出现了一定的愈伤化甚至是玻璃体化现象[6-7]。有研究显示,低浓度的TDZ 可以诱导芽的分化,高浓度的TDZ 则会诱导愈伤组织的形成抑制芽的分化[8]。TDZ 浓度增加到一定程度时则会使玻璃体化发生率提高[9]。由此可见,TDZ 的使用的临界浓度是控制分化方向的关键。在青龙增殖过程中,TDZ 和IBA 组合使用,达到了较好的增殖效果,这与王强等研究鳄嘴花的组织培养和快速繁殖的研究结果相一致[10]。最终优选增殖培养基为:WPM + 0.06 mg/L TDZ + 0.3 mg/L IBA + 6.5 g/L 琼脂 + 30 g/L 蔗糖。
生长调节物质是培养基中的关键物质,其种类与组合对培养物的器官发育起主要诱导作用,生长调节物质为外源非营养性的化学物质,通常可在植物体内传导至作用部位,以很低的浓度就能促进或抑制其生命过程的某些环节,使之向人类的需求发展。茎芽生根是植物实现组培快繁的关键环节和瓶颈问题,在组培苗生根过程,添加的激素和浓度是影响组培苗生根的重要因素[11]。在组织培养生根过程中,当细胞分裂素的浓度高于生长素或只用细胞分裂素时有利于不定芽的诱导,当只用一定浓度的生长素或者配合使用低浓度的细胞分裂素时有利于不定根的诱导[12-13]。在青龙诱导生根过程中,单独使用生长素NAA 达到了较好的效果,最终筛选出最佳生根培养基:1/2 WPM+0.3 mg/L NAA+6.5 g/L 琼脂+30 g/L 蔗糖,其生根率达96.7%。
目前,对日本红枫组培有少许报道,但针对日本红枫青龙品种的组培研究至今未见报道。本研究从获得青龙无菌外植体、启动培养、继代培养、生根诱导及炼苗移栽,成功建立了青龙组培快繁体系,为青龙工厂化育苗奠定理论基础和技术支持。
本研究以青龙茎段为外植体,诱导丛生芽,建立组培快繁体系,但未对青龙的叶片、叶柄、种子等材料进行相关组培的研究,下一步可以以不同外植体材料诱导愈伤组织、再生植株、体细胞等途径,建立完善的青龙组培体系,为转基因、遗传育种、多倍体诱导奠定理论基础。

