矮牡丹染色体核型分析
王凯琪,王珺华,王 凯,常 裕,孙志宏,2,齐向英*
(1.延安大学生命科学学院;2.陕西省区域生物资源保育与利用工程技术研究中心,陕西延安716000)
牡丹(PaeoniasuffruticosaAndr.)属于毛茛科芍药属[1],花形较大、花色美丽。自我国唐朝以来就有 “花中之王”的称号,是我国原产的特色花卉。自古以来,人们就钟爱牡丹。我国分布的牡丹种类主要有紫斑牡丹(PaeoniaRockii),黄牡丹(Paeoniadelavayivar.lutea)和矮牡丹(Paeoniasuffruticosavar.spontaneareha)[2]。矮牡丹(Paeoniasuffruticosavar.spontaneareha)属于毛茛科芍药属,为牡丹的一个变种,是国家三级濒危保护物种。
延安市万花山从1976年开始建立了延安牡丹保护区。该区内以花色分类保存了延安矮牡丹的“延州白”、“延州粉”、“白玉仙”等14个不同品种;保存了“双塔粉荷”等21个紫斑牡丹品种[3]。万花山区矮牡丹与紫斑牡丹的主要区别为矮牡丹叶背面和叶轴均生短柔毛,二回羽状复叶,顶生小叶宽卵圆形或近圆形,长4~6 cm,宽3.5~4.5 cm,3裂至中部,裂片再浅裂。
延安地区分布的矮牡丹适应了黄土高原的贫瘠土壤,既能在树木林缘生长,也能在山地、塬地、坡地生长。由于其生长年限很长,往往和同期栽培其他牡丹品种相比较植株矮小,生长缓慢。矮牡丹也是全国各地移栽后唯一对牡丹白粉病有较强抗性的品种。近年来,山东、河南、山西等省和陕西的西安、绥德、子长、宝鸡、眉县等地区均从延安引种矮牡丹进行引种栽培。

图1 延安地区野生“延州白”矮牡丹图
2010年起延安大学和西北农林科技大学合作开始研究延安矮牡丹的快速繁殖和在牡丹新品种培育中的应用。2012年延安大学用矮牡丹叶片诱导愈伤组织培养成功[4]。为了进一步确定矮牡丹叶片诱导系的稳定性,本研究选择了以延安地区野生的“延州白”矮牡丹系作为材料(如图1所示),确定其核型的各项信息。
核型分析有利于揭示物种遗传进化的过程机制,本文通过对矮牡丹的幼嫩叶片染色体数目及核型的研究[5-7],为矮牡丹在育种中的运用提供细胞学和遗传学依据,旨在对于这一珍稀种质资源的保存和利用做进一步的了解。
1 材料和方法
1.1 实验材料
供试材料于2017年3月8号、2018年3月8号以及2019年3月8号在延安万花山的东坡牡丹园采取,选择生长正常的幼嫩叶片。
1.2 药品与仪器
药品:0.1%的秋水仙碱溶液,卡诺氏固定液V冰醋酸:V95%乙醇=1∶3),1 mol/L的HCl溶液,45%的冰醋酸,0.075 mol/L的KCl溶液,改良的苯酚品红溶液。
仪器:电热恒温水浴锅,Olympus BX51全自动显微照相系统。
1.3 实验方法
取材:在早晨8点前配置好0.1%的秋水仙碱溶液,带到取材地点,用剪刀直接剪取矮牡丹茎上的萌动芽。
预处理:投入0.1%的秋水仙碱溶液中,带回实验室。秋水仙碱连续处理4 h,以便积累较多的有丝分裂中期的细胞数。
固定:秋水仙碱处理结束后直接投入配置好的卡诺氏固定液中固定12 h,杀死组织有效的固定分裂相。从固定液中取出后用蒸馏水泡洗3次,每次3~5 min,然后转入75%乙醇溶液中,在4℃冰箱中保存备用。
解离:将保存的材料从75%乙醇中取出,用蒸馏水连续泡洗3次,每次3 min。将配置好的1 mol/L HCl加入到指管中,放入水浴锅,当水浴锅温度显示60 ℃时,用温度计测量指管中的温度,根据指管中的温度调节水浴锅的温度,使指管内的温度达到并稳定维持在60 ℃。将清洗好的材料用解剖刀沿横茎切开,投入到温度恒定的HCl溶液中,解离5 min。在解离的过程中,如果材料表面有气泡冒出,立即停止解离,并将材料迅速转入1 mol/L HCl常温溶液中。
低渗:将解离完成的材料放入蒸馏水中连续泡洗5次,每次3 min。主要目的是清洗掉多余的HCl溶液,然后投入配置好的0.075 mol/L KCl溶液中,常温下保持30 min。
染色:将低渗完成的材料整体投入改良苯酚品红溶液中染色30 min[8],取出材料,将材料在载玻片上分割成肉眼可以观察到的大小。
压片:采用压片法,将材料移动到载玻片中央,在材料上滴一滴45%的冰醋酸。从材料一侧将盖玻片缓慢放到材料上,保证冰醋酸溶液在盖玻片和载玻片之间无气泡产生。将吸水纸覆盖在盖玻片上面,在材料位置用带橡皮的铅笔橡皮端敲击或者用大拇指用力从材料位置压下,保证盖玻片不移动。
选片与拍照:挑选出分散良好、染色清晰的片子,并将其放在OlympusBX51全自动显微镜下进行观察,寻找染色相对较为清晰、分散却不重叠的分裂中期细胞进行拍照,得到各组照片。
染色体数目统计:只有对植物细胞中含有的染色体数目进行统计分析后我们才能确定植物的染色体数目[9]。由于存在统计上的差异,因此许多人认为至少统计30个细胞(染色体清晰可见且分布均匀),常认为只要85%以上的细胞具有相同的染色体数时,才可以确定该植物染色体数目。
染色体形态:关于染色体的形态分析[10],在显微镜视野中寻找分散良好的中期细胞染色体进行拍照,经过放大后然后彩印,用细绳(相比较精准)测量每条染色体的长短臂的相对长度,按照放大倍数求出其绝对长度;或者用测微尺测量绝对长度,染色体的随体不记长度,找到着丝粒的位置;再求出臂比、绝对长度和相对长度。在进行同源染色体的配对时需要根据染色体的长度、臂比、随体以及着丝粒的位置等数据进行配对。对染色体进行编号时,1号为最长的染色体,尾号为最短的染色体。若存在长度相同的染色体时,把染色体短臂长的排在前面,再将配对好的同源染色体按从小到大的编号排列在纸上且粘好,在排列时把染色体的着丝粒放在一条直线上,染色体的短臂放在上边,长臂放于直线以下,排放整齐后对其进行拍照,就可以得到染色体核型图,然后按照核型图绘制染色体的核型模式图,然后对染色体进行测量以及数据分析。
核型分析方法:按照李懋学、陈瑞阳等标准来确定染色体的数目以及分析染色体的形态[11],按照Stebbins的方法确定染色体核型的类别[12],经过压片法和图像处理共分析了60个有效细胞分裂相。
按照文献中提出的核型不对称系数确定染色体核型的不对称程度,染色体的核型不对称系数(As.K/%)按Arano的方法计算[13,14],可根据表1的臂比值的范围确定染色体着丝点位置,进一步确定染色体类型。
染色体形态测量公式:
相对长度=(染色体长度/染色体组总长度)×100%
着丝粒指数=(短臂/染色体全长)×100%
臂比=长臂/短臂
核型不对称系数(As.K%)=(长臂总长/全组染色体总长)×100%

表1 染色体臂比值、着丝点位置与染色体类型
2 分析
2.1 染色体数目
本实验按照李懋学、陈瑞阳建议的核型分析的标准,在矮牡丹的大量制片中观察了60个细胞分裂相,如表2、3所示。其中共计51个细胞均含有10条染色体,所占比例为85%,达到染色体数目所要求的85%,95%的置信区间为78.5%~88.20%,置信区间间隔过大,宽窄度为宽,所以结果显著;7个细胞各含有9条染色体,所占比例为11.67%,95%的置信区间为8.9%~17.72%,虽然置信区间达到要求,但细胞数量过少,未达到要求的85%的细胞数量;2个细胞各含有8条染色体,所占比例为3.33%,95%的置信区间为1.01%~5.65%,细胞数量和置信区间均未达到要求。因此确定矮牡丹的染色体数目为10条。
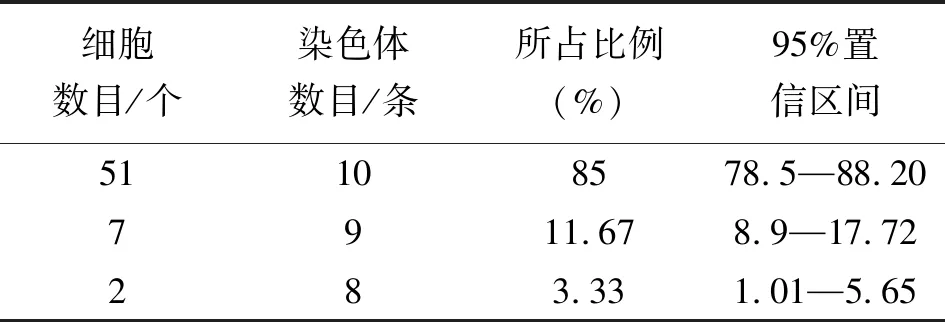
表2 染色体数目及置信区间
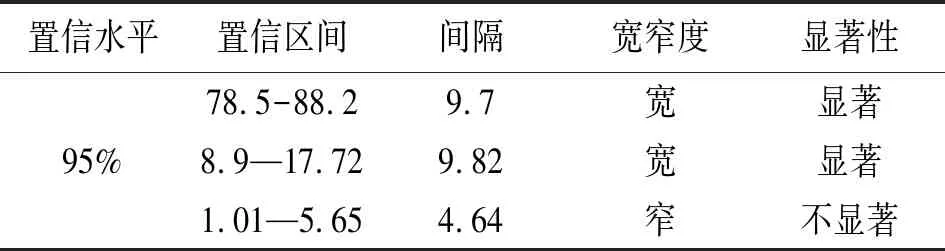
表3 显著性分析
2.2 长度与核型分析
由表4可见,矮牡丹染色体的相对长度范围为6.71%~10.01%,矮牡丹最长与最短染色体长度比值为1.49,臂比大于2∶1的染色体有1组,所占比例大于20%,两项主要特征可以判断矮牡丹属于2A型。核型不对称系数为62.43%。在配对的染色体中,m类型染色体有4组,st型染色体有1组。所以,矮牡丹染色体核型公式为2n=2x=10=8m+2st。核型图见图2,核型模型图见图3。
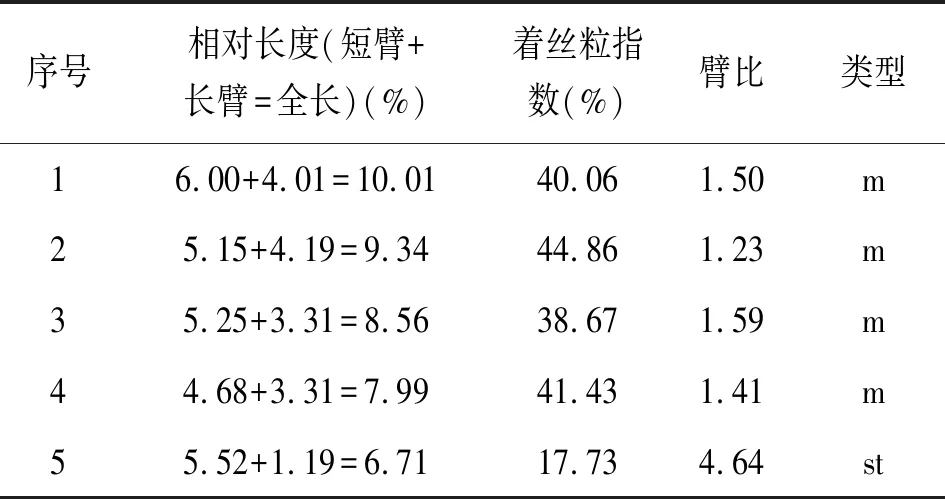
表4 染色体相对长度、臂比与类型

图2矮牡丹染色体
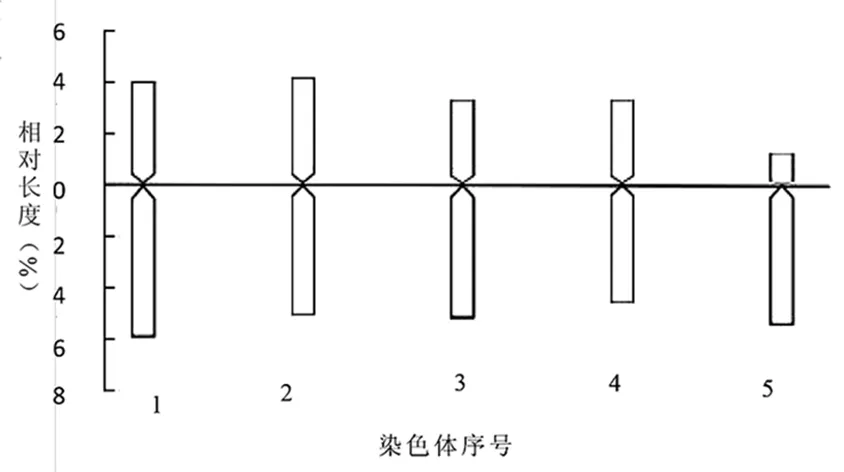
图3 矮牡丹染色体核型模型图
3 讨论与结论
3.1 讨论
3.1.1 材料选择
本研究选择的是矮牡丹幼嫩叶片而不是以根作为材料,因为幼嫩叶片已经是特化器官,相对根稳定性更高,变异的可能性不是很大,因此选择矮牡丹幼嫩叶片作为材料。
3.1.2 解离、制片
解离时需要水浴加热,使温度持续处于60 ℃,目的是为了保持恒温,加速解离[15],解离时间为5 min。在解离过程中一定要掌握好温度和时间,若解离温度不够,则压片不易分散,若解离时间过长,在下一步处理时会由于材料过软而容易将根尖部位丢失。
制片质量的好坏直接会影响实验结果,因此,在做实验的过程中必须根据自身情况采用各自的制片方式,压片法和涂片法是我们最常用的制片方式[16]。涂片法是先用镊子、解剖针等将材料弄碎,让细胞均匀分布在载玻片上,但很难观察到染色体或比较模糊。相比之下,由于压片法容易操作,而且观察到的染色体比较清晰,所以本次实验选择压片法制片。
3.1.3 染色体数目
染色体数目统计一般以体细胞染色体数目为准,统计的细胞数目应在30个以上,其中85%以上的细胞具有恒定一致的染色体数,即可认为是该植物的染色体数目。该实验观察了60个细胞分裂相,有51个细胞分裂相观察到的染色体数目为10条,7个细胞各含有9条染色体,2个细胞各含有8条染色体,造成染色体数目缺少的原因可能是因为压片过程中,两条或两条以上的染色体连成一条线很难区分出来,所以认为矮牡丹的染色体数目为10条。
3.1.4 核型
一个体细胞中的全部染色体,按照其大小、形态特征、着丝粒位置等顺序排列所构成的图像即为核型。根据Stebbins的核型不对称性分类标准[17],侯小改等对部分牡丹品种的染色体核型进行分析[18],这些牡丹均属于2A型。该实验证明矮牡丹也是2A型。
3.2 结论
本次实验从制作的矮牡丹染色体切片中观察了60个细胞并进行染色体计数,确定其染色体数目为10,且染色体基数都是X=5,这与其他人得出的染色体数目的观察结果一致[19~20]。确定矮牡丹染色体核型公式为:2n=2x=10=8m+2st。
根据Stebbins 1971年的核型不对称性分类标准来看,可以判断矮牡丹属于2A型。经过计算,矮牡丹的核型不对称系数为62.43%,核型不对称系数的大小反应了核型不对称程度,而核型不对称程度是进化的一种标志,因而不对称系数越大,则进化水平越高。由此可以看出矮牡丹的进化水平不是特别高,这则给我们在保护矮牡丹上提供了一个新的方向,就是如何提高矮牡丹的核型不对称程度。

