人脑皮质挫伤后不同细胞Nrf2的表达
郭相伸 ,温书恒 ,董雯雯 ,李炳譞 ,陈子原 ,王林林 ,官大威 ,赵锐
(1.中国医科大学法医学院法医司法鉴定中心,辽宁 沈阳 110122;2.智慧检务创新研究院 智慧司法鉴定联合实验室,辽宁 沈阳 110122;3.中国刑事警察学院,辽宁 沈阳 110035)
创伤性脑损伤(traumatic brain injury,TBI)是法医病理学鉴定中常见的死亡原因,脑损伤时间的推断是法医病理学研究的重点与难点[1-2],其准确推断不仅有助于缩小案件侦查范围,还可帮助确定案件性质。传统的损伤时间推断,主要是依据肉眼和光学显微镜观察脑损伤后组织病理学改变,但其受到损伤程度、损伤部位和个体因素等诸多因素的影响,而且损伤后形态学变化的时间窗口相对宽、缺乏明确的时间界限,甚至缺乏特征性的形态学改变,所以很难准确推断脑损伤后的经过时间。随着医学研究技术的发展,法医病理学者开始在脑损伤区及损伤周边区检测多种生物标志物(蛋白、细胞因子、炎症因子)总体蛋白或基因水平的表达变化,探讨其与损伤经过时间的相关性[3-4]。有研究[5]利用人脑损伤后神经元的凋亡情况对脑损伤时间进行推断,有利用单链DNA作为人脑神经元损伤的免疫组织化学标记物[6],也有对血清中各种标记物进行研究,以判断脑损伤后血清各指标的变化情况[7]。
核因子E2相关因子2(nuclear factor-erythroid derived 2-related factors,Nrf2)是细胞抗氧化防御体系的关键调节因子,属于CNC碱性亮氨酸拉链蛋白(cap’n’collar basic leucine zipper,CNC-bZIP)家族成员,在脑损伤后的抗氧化和抗炎症反应中发挥重要作用。目前,研究脑损伤时间主要针对损伤脑组织进行单一因子的蛋白或基因表达水平的检验,且局限于动物模型的研究。本研究针对人体脑损伤组织标本,应用免疫荧光双染色技术,检测Nrf2在人脑损伤后不同细胞内表达的动态变化,并探讨其与损伤时间的相关性,以期为推断脑损伤经过时间提供新的方法和参考指标。
1 材料与方法
1.1 材料
36例人脑组织均来自中国医科大学法医司法鉴定中心在2013—2018年间鉴定受理的案件,该研究根据1964年的赫尔辛基宣言进行,并得到了中国医科大学伦理委员会的批准。纳入标准:(1)有详细的案情调查资料;(2)明确的头部外伤史;(3)准确的颅脑损伤时间和死亡时间;(4)死后冷藏48h内或冷冻7d内进行检材提取。按照案情提供的损伤后经过时间将入选案例分为对照组,伤后0~1h、伤后3~6h、伤后1~3 d、伤后5~7 d、伤后10~14 d组。每组6例。对照组6例为心脏性猝死无脑外伤的个体,30例脑挫伤个体中损伤原因包括交通事故16例、钝器伤12例、坠落伤2例。
1.2 方法
1.2.1 取材及制片
将取材组织在4%多聚甲醛溶液内固定48h后,以皮质挫伤区为中心取材,大小为1.5cm×1.5cm×0.5cm,常规脱水、透明、浸蜡、包埋,连续切片(厚5μm)。
1.2.2 苏木素-伊红染色
常规苏木素-伊红(hematoxylin-eosin,HE)染色,中性树胶封片。
1.2.3 双重免疫荧光染色
切片经脱蜡、水化后,非免疫血清封闭2 h,加入磷酸缓冲液稀释、兔抗人Nrf2抗体(1∶500,ab62352,英国Abcam公司),小鼠抗人神经核(1∶100,neuronal nuclei,NeuN)抗体(MAB377,德国Merck公司)、小鼠抗人胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(1∶400,60190-1-ig,美国Proteintech公司)、小鼠抗人离子钙接头蛋白分子1(ionized calcium-binding adapter molecule 1,IBA1)抗体(1∶400,MABN92,德国Merck公司)4℃过夜。次日用磷酸缓冲液冲洗3次,每次10 min,加入异硫氰酸荧光素(fluorescein is othiocyanate,FITC)-驴抗小鼠IgG(H+L)、CY5-驴抗兔 IgG(H+L)荧光标记二抗,室温孵育2 h,充分水洗,并用含4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)的抗荧光淬灭剂封片。
1.2.4 阳性细胞计数分析
在每张免疫染色的切片中,在脑皮质损伤区及损伤周边区使用相同的放大倍数(物镜40倍)下随机选取5个视野,观察神经元(NeuN阳性)、星形胶质细胞(GFAP阳性)、小胶质细胞(IBA1阳性)的细胞数,分别计数以上细胞和Nrf2共同阳性的细胞数目,应用Image J 1.49v(美国Wayne Rasband开发)图像分析系统计数单位面积内不同阳性细胞的细胞数,计算平均值,应用同一分组内的不同数据计算平均值与标准差。
1.3 统计学分析
采用SPSS 20.0软件对数据进行统计分析。计量数据用±s表示,采用单因素方差分析。计数资料用百分比表示,采用χ2检验,检验水准α=0.05。
2 结 果
2.1 一般情况
36例入组年龄在19~68岁,男性23名,女性13名。经案情调查的损伤后经过时间为5min~14d。
2.2 组织病理学改变
正常脑组织皮质神经元尼氏体边聚,核仁清晰。脑挫伤后1h内见皮质结构破坏,散在灶性出血,皮质内小血管收缩;伤后3~6 h,损伤区神经元变性,呈梭形或圆形,周边区神经元嗜伊红染色增强;伤后1~3d,神经元、胶质细胞胞质红染,神经元数量减少;伤后5~7d,损伤区神经元坏死,胶质细胞增生、肥大;伤后10~14 d,出血被吸收,散在含铁血黄素样物,挫伤区脑软化,可见格子细胞伴散在小圆细胞浸润,损伤周边区胶质细胞嗜伊红染色增强(图1)。
2.3 Nrf2在脑挫伤后损伤周边区NeuN阳性神经元内的表达
在正常脑组织中,NeuN阳性神经元内未见明显的Nrf2表达。脑挫伤后,损伤区NeuN阳性神经元细胞数量从伤后3~6 h开始减少,1~3 d后NeuN阳性细胞数目基本稳定(图2)。由表1可见,Nrf2阳性神经元数量从伤后1h开始增加,伤后1~3d达到高峰(P<0.05),以后逐渐下降。Nrf2阳性神经元占总体神经元的比例在伤后1~3 d达到高峰(P<0.05),此后逐渐下降。

图1 脑皮质挫伤后组织病理学改变(HE×400)

图2 脑皮质挫伤后Nrf2和NeuN免疫荧光双重染色
2.4 Nrf2在脑挫伤后损伤周边区GFAP阳性星形胶质细胞内的表达

表1 TBI后不同时间段挫伤区脑皮质中NeuN阳性细胞与Nrf2阳性细胞数及比例
GFAP阳性星形胶质细胞内Nrf2在正常脑组织微弱表达。脑挫伤后,星形胶质细胞于伤后1~3d被激活,GFAP阳性强度增加,阳性细胞胞体肥大,突起明显、粗大、不规则(图3)。由表2可见,GFAP及Nrf2阳性星形胶质细胞数量从伤后1~3d开始增加,伤后5~7d达到高峰(P<0.05),以后逐渐下降,伤后14 d仍存在较高表达的GFAP阳性及Nrf2阳性细胞。Nrf2阳性星形胶质细胞占星形胶质细胞的比例在伤后相对稳定。

表2 TBI后不同时间段挫伤区脑皮质中GFAP阳性细胞与Nrf2阳性细胞数及比例
2.5 Nrf2在脑挫伤后损伤周边区IBA1阳性小胶质细胞内的表达
在正常脑组织中,IBA1阳性小胶质细胞内Nrf2微弱表达。脑挫伤后1h开始,IBA1阳性小胶质细胞被激活,胞体肥大,突起粗大,呈变形虫样形态(图4)。由表3可见,IBA1及Nrf2双阳性细胞数量从伤后1~3d开始增加,伤后5~7d IBA1阳性细胞达到高峰(P<0.05),此后逐渐下降,Nrf2阳性的小胶质细胞占小胶质细胞的比例在伤后5~7 d达到高峰(P<0.05),以后逐渐下降。

图4 脑皮质挫伤后Nrf2和IBA1免疫荧光染色
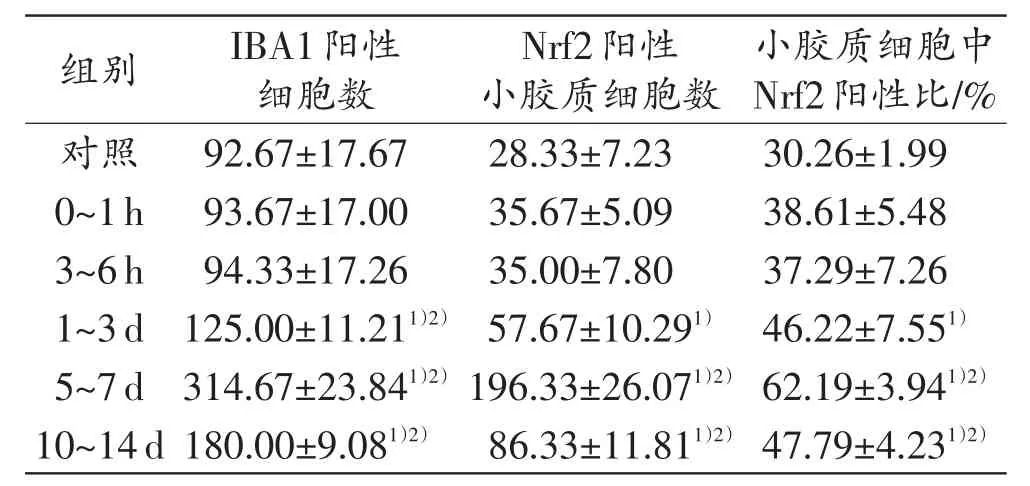
表3 TBI后不同时间段挫伤区脑皮质中IBA1阳性细胞与Nrf2的阳性细胞数及比例
3 讨 论
氧化应激损伤是颅脑损伤的重要机制之一[8]。Nrf2是细胞抗氧化反应的中枢调节因子,也是维持细胞内氧化还原稳态的关键因子,通过诱导调控一系列细胞抗氧化蛋白的表达,减轻活性氧和亲电体引起的细胞损伤,使细胞处于稳定状态,维持机体氧化还原动态平衡。大量[9-10]研究表明,Nrf2在脑损伤后发挥神经保护作用,不仅通过上调抗氧化酶发挥抗氧化应激作用,还通过抗细胞凋亡、抗炎及参与自噬和泛素化蛋白降解发挥神经保护性作用。前期实验动物研究[11-12]结果已经表明,Nrf2蛋白和mRMA水平在损伤侧的脑皮质和海马存在时间依赖性表达。本研究针对人脑挫伤组织,结合形态学变化,应用荧光双标记技术检测Nrf2在损伤区和损伤周边区不同细胞内表达的动态变化,并探讨其与损伤时间的相关性,探讨其在法医学实践中推断脑损伤时间的应用价值。同时,Nrf2在损伤后脑内不同细胞的表达差异,有利于阐述Nrf2在损伤后发挥神经保护作用的分子机制并为临床上以Nrf2为靶点治疗脑损伤提供理论依据。
研究结果[13]表明,大脑皮质神经元更容易受到氧化性损伤,主要是由于其内在抗氧化能力较弱,其抗氧化能力一方面依赖于周围的星形胶质细胞[14],另一方面通过获取周围星形胶质细胞提供的抗氧化底物来实现自身的抗氧化活性[15]。本研究发现,脑损伤后神经元内Nrf2在损伤后1d表达Nrf2的阳性细胞达到高峰,这种快速表达可能与损伤后大量活性氧(reactive oxygen species,ROS)生成有关。尽管损伤后神经元内表达Nrf2,但其细胞抗氧化能力有限,可能与上调的Nrf2主要存在于神经元胞浆内,并未发挥转录活性有关。
星形胶质细胞是大脑皮质维持生理稳态的关键细胞,其作用包括支持神经元、维护血脑屏障完整性、参与炎症反应、构建胶质瘢痕等[14,16]。前期动物实验结果[15]表明,星形胶质细胞中存在高水平Nrf2的表达,这可能与其维持神经系统内氧化还原平衡有关,主要是通过提供释放谷胱甘肽的前体,保证谷胱甘肽的生物合成。本研究发现,正常脑皮质GFAP阳性细胞内存在微弱的Nrf2着色,损伤后GFAP阳性细胞逐渐增多,在伤后7d达到高峰,而且Nrf2在GFAP阳性细胞内的表达也随伤后时间的延长轻度增高,维持在相对稳定的比例。尽管大量的星形胶质细胞内存在Nrf2的阳性着色,但其强度并非很高,提示内源性星形胶质细胞产生Nrf2的能力不足,这也解释了损伤后大量神经元死亡的原因。考虑到星形胶质细胞对神经元的支持作用及其在中枢神经系统内抗氧化反应的中枢调节作用,以星形胶质细胞内Nrf2为靶点可能是治疗神经系统损伤的潜在靶点。
神经炎症是继发性颅脑损伤的重要机制之一,创伤性脑损伤介导的炎症反应,涉及小胶质细胞、巨噬细胞以及外周来源的中性粒细胞、单核细胞和T细胞[14]。创伤性脑损伤后,脑内小胶质细胞从静息状态转变成激活状态,分泌炎症因子并吞噬清除坏死崩解的脑组织碎片[17]。研究[9,18]结果表明,Nrf2缺失的小鼠在颅脑损伤后出现小胶质细胞的过度活化,而Nrf2的过表达则有效减低损伤诱导的神经炎症,提示Nrf2在颅脑损伤后发挥了重要的抗炎作用。本研究结果发现,在对照组小胶质细胞内Nrf2微弱表达,损伤后出现大量IBA1阳性细胞活化,提示Nrf2参与损伤后的炎症调控,并且大部分活化的小胶质细胞表达Nrf2,其阳性细胞比例在伤后5~7d达到高峰,之后开始下降。在法医学实践中,应用免疫荧光双染技术检测Nrf2在脑皮质挫伤区及周边区不同细胞内的表达情况,辅助推断脑损伤的时间,有望为人体颅脑损伤时间的推断提供新的指标。作为脑损伤时间推断的理想分子标记物应该具有以下特点:(1)在正常脑组织存在但不表达或表达水平很低;(2)当挫伤发生时,各种内外因素的刺激促进其表达,抵抗外来损伤并参与机体损伤修复;(3)标记物的表达随损伤后经过时间呈现规律性变化。
目前,基于实验研究,有望用于推断颅脑损伤经过时间的指标主要包括热休克蛋白70(heat shock protein 70,HSP70)、Homer蛋白、P35/25蛋白、神经元特异性烯醇化酶(neuron specific enolase,NSE)、S100蛋白、髓磷脂碱性蛋白(myelin basic protein,MBP)、胶质纤维酸性蛋白(glial glial fibrillary acidic protein,GFAP)、神经丝蛋白(neurofilament protein,NFP)、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、泛素羧基末端水解酶L1(ubiquitin carboxy terminal hydrolases-L1,UCH-L1)等,以及核转录因子κB(nuclear factor kappa-B,NF-κB)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素(interleukin,IL)-6、IL-8、IL-1β等细胞因子,但应用单一指标进行脑挫伤时间推断往往不能准确判定[19]。本研究基于不同细胞内单一标记物Nrf2的表达变化,提出单一标记物在不同细胞类型的表达变化有望用于相对准确的脑损伤时间推断的研究思路。研究结果表明:Nrf2阳性细胞数在神经元内,于伤后1 d达到高峰;在星形胶质细胞和小胶质细胞内,于伤后7d达到高峰。根据Nrf2在这三类细胞中表达量的改变,有助于早期脑损伤的时间推断。但随着蛋白组学、基因组学和转录组学技术的广泛应用,以及应用多指标综合分析判断结合人工智能的算法等技术的发展,在未来这些技术有望为颅脑损伤时间推断开辟一条新的思路。

