云南不同仓储地复烤烟叶表面醇化期间可培养真菌的动态变化
白维晓,吴光丽,王 毅,宋鹏飞,马永凯,吴丽君,魏云林,季秀玲,李海燕*
1.昆明理工大学,昆明市呈贡区景明南路727号 650500
2.云南中烟工业有限责任公司,昆明市盘龙区世博路6号 650224
烟叶经初烤、复烤后,仍存在吸湿性强、燃烧性差、自然芳香不足、吃味苦涩等特点,需要经过一段时间的醇化,才能满足卷烟生产要求[1]。自然醇化是改善烟叶香味、提高烟叶品质和可用性的关键环节[1-2]。研究表明,微生物在烟叶自然醇化过程中发挥了关键作用,主要是通过产生生物酶类来增强生物大分子的转化、促进致香成分的产生和积累、降低烟叶中的有害物质[2-3]。此外,微生物还能显著缩短醇化时间,提高卷烟生产效率[4-8]。相反,如果烟叶醇化过程中某些腐霉微生物过度繁殖,则会导致烟叶霉变,甚至产生有害物质,从而降低卷烟品质[9-10]。因此,掌握烟叶醇化过程中微生物群落结构及其动态变化规律,是控制卷烟质量、揭示醇化机理、实现人为干预烟叶醇化及提高醇化效率的关键,具有一定的理论和实用价值。
云南是我国最主要的烟叶产区,整体气候适宜优质烟叶的生长[11-14]。然而,较为分散的烟叶醇化地,导致了烟叶醇化时间、醇化品质及其影响因素变得较为复杂。由于不同醇化地的环境条件不同,则导致醇化烟叶表面微生物群落结构不同,最终使烟叶的醇化品质不同[15]。目前,关于云南不同仓储地、不同醇化时间K326复烤烟叶表面真菌群落结构的研究鲜见报道。为此,分析了K326复烤烟叶在云南不同仓储地(弥勒、曲靖、元江、楚雄)醇化期间烟叶表面可培养真菌的数量、种类及其动态变化,旨在为改进烟叶醇化技术提供依据。
1 材料与方法
1.1 供试样品
供试的11份K326复烤烟叶样品均为2014年红云红河烟草(集团)有限责任公司、红塔烟草(集团)有限责任公司提供。分别为昆明WDC3F、WBBSF复烤烟叶,大理VCO2A复烤烟叶,楚雄VBO2S、VCO1S复烤烟叶,玉溪VCO2S、VBO2S复烤烟叶,红河WBB1F、WDC3F复烤烟叶,曲靖WBBSF、WDC3F复烤烟叶。
1.2 复烤烟叶异地醇化
2015年4月,将11份K326复烤烟叶样品分别送至曲靖、楚雄、弥勒和元江4个仓储地进行自然醇化。烟叶自然醇化的仓储条件:曲靖年均温度19.8℃、年均相对湿度58.23%;楚雄年均温度20.5℃、年均相对湿度59.55%;弥勒年均温度19.8℃、年均相对湿度73.30%;元江年均温度24.4℃、年均相对湿度64.97%。每个仓储地同步采集醇化0、6、9、15和17个月的烟叶样品。采集时间为2015年4、10月,2016年1、7、9月。每个仓储地每次采集11份样品,共220份样品。样品采集后密封于无菌袋中。
1.3 可培养真菌的分离
用马铃薯葡萄糖琼脂培养基(PDA)分离、培养烟叶表面真菌。PDA培养基成分:200 g新鲜马铃薯,20 g葡萄糖,1.2%~1.3%琼脂粉,加水定容至l 000 mL。于121℃高压蒸汽灭菌15 min,待培养基冷却至50℃左右,用细菌过滤器分别将0.5 g/L青霉素和0.5 g/L硫酸链霉素加入培养基,混匀后倒入培养皿及试管中。
真菌的分离。在无菌条件下,取50片烟叶放到培养皿中,用剪刀将叶片剪成1 cm2的小叶片,随机选取10片小叶片均匀贴在PDA培养基上,每个样品贴3个PDA培养基,共计30片小叶片。将贴有小叶片的培养基于25℃下恒温培养。当小叶片周围长出真菌时,便将真菌挑至新鲜的PDA培养基上进行分离、纯化。将纯化后的菌株转接到PDA试管中,用于分类鉴定和保存。
1.4 烟叶表面真菌的鉴定
1.4.1 形态学鉴定
根据菌落形态、颜色和生长速率将菌株分为不同的形态类群。从每个形态类群中随机挑取3~5株进行促孢培养(10~60 d)。产孢后,根据产孢方式、产孢结构、孢子形态特征等确定菌株的分类地位[16-18]。促孢培养后仍不产孢的菌株,根据菌落颜色、质地、生长速率等将其划分为不同的无孢类群组。
1.4.2 分子鉴定
对于不产孢或产孢后仍不能确定其分类地位的菌株,通过18S rDNA序列比对来确定分类地位[19-20]。用CTAB法(十六烷基三甲基溴化铵法)提取真菌基因组DNA,以基因组DNA为模板进行PCR扩增,获得18S rDNA序列。扩增引物为真菌ITS通用引物ITS1(5'-TCCGTAGGTGAACCTGCG G-3')和 ITS4(5'-TCCTCCGCTTATTGATATGC-3')。利用琼脂糖凝胶电泳对扩增产物进行检测,将检测合格的18S rDNA送至昆明硕擎生物科技有限公司进行测序。将测得的18S rDNA序列与GenBank数据库(http://www.ncbi.nlm.nih.gov/)中的序列进行比对,相似度>99%则属于同种菌株,相似度>97%则属于同属菌株[21-22]。根据覆盖率、相似度并结合形态学特征确定真菌的分类地位。
2 结果与分析
2.1 不同仓储地醇化烟叶表面可培养真菌的数量及其动态变化
从来自4个醇化地(曲靖、楚雄、弥勒、元江)的220份烟叶样品中,共分离得到2 963株可培养真菌。由图1可知,来自4个醇化地的烟叶表面真菌数量随醇化时间的变化规律基本相同:下降-上升-下降-趋于平缓。在醇化17个月时,除弥勒地区真菌数量还在持续下降外,其他3个地区的真菌数量基本趋于平缓。整体上,曲靖、楚雄地区醇化烟叶表面可培养真菌在不同醇化时间点的数量均非常接近,且高于元江和弥勒两地(除醇化15个月时)。弥勒地区醇化烟叶表面可培养真菌的数量除在醇化9个月时略高于元江地区外,其余时间点均为最低。总之,曲靖和楚雄两地醇化烟叶表面可培养真菌的数量最多且无较大差异,元江次之,弥勒最低。

图1 4个醇化地不同醇化时间烟叶表面可培养真菌数量的变化Fig.1 Variations in quantity of culturable fungi on surface of tobacco leaves aging for different times in four areas
2.2 不同仓储地醇化烟叶表面可培养真菌的种类及其动态变化
结合形态特征及18S rDNA序列,共鉴定出39个属(种)的真菌,但有5类无法确定种属(表1)。不同醇化时间、不同仓储地醇化烟叶表面的可培养真菌种类不同。醇化6个月时,在弥勒地区醇化烟叶的表面分离到青霉属真菌(Penicilliumspp.)和Phialophora cyclaminis真菌,而曲靖、元江、楚雄3个醇化地区则没有发现;在元江地区醇化烟叶的表面分离到交链孢属真菌(Alternariasp.)、粪壳菌(Sordariomycetessp.)和近缘毛壳菌(Chaetomium subaffine),而曲靖、弥勒、楚雄3个醇化地区则没有发现。醇化9个月时,在楚雄地区醇化烟叶的表面分离到枝孢属真菌(Cladosporiumspp.)、小不整球壳属真菌(Plectosphaerellasp.)和Helianthus annuus真菌,而曲靖、弥勒、元江3个醇化地区则没有发现。
根霉属真菌(Rhizopusspp.)在不同醇化地、不同醇化时间点均有分布。随醇化时间延长,4个醇化地分离得到同种真菌的概率逐渐增大。醇化15个月时,4个醇化地均分离到Cercophora samala真菌;醇化17个月时,4个醇化地均分离到柄孢霉真菌(Podospora anserina)、Coniochaeta velutina真菌和球毛壳菌(Chaetomium globosum)。
醇化前,从样品中共分离到3种真菌,随醇化时间延长,分离到的真菌种类逐渐增多。相同醇化时间不同醇化地的烟叶,其真菌种类存在一定差异。醇化6个月的真菌种类:弥勒=元江>曲靖>楚雄;醇化9个月的真菌种类:弥勒=楚雄>元江>曲靖;醇化15个月的真菌种类:元江>弥勒>楚雄>曲靖;醇化17个月的真菌种类:元江=楚雄>曲靖>弥勒。总体来看,不同醇化时间4个醇化地的烟叶真菌种类差异较大,醇化17个月后真菌种类才较为接近。
同一醇化地烟叶的真菌种类也随醇化时间的变化而变化。以弥勒地区为例,醇化6个月时,分离到7种真菌。与醇化前相比,相同种类的真菌有2种,不同种类的真菌有5种。醇化9个月时,分离到9种真菌,与醇化6个月相比,相同种类的真菌有2种,不同种类的真菌有7种。醇化15个月时,分离到13种真菌,与醇化9个月相比,相同种类的真菌有4种,不同种类的真菌有9种。醇化17个月时,分离到9种真菌,与醇化15个月时相比,相同种类的真菌有4种,不同种类的真菌有5种。

表1 4个醇化地不同醇化时间烟叶表面可培养真菌的种类Tab.1 Species of culturable fungi on surface of tobacco leaves aging for different times in four areas

表1(续)
2.3 不同仓储地醇化烟叶表面可培养真菌的优势菌群
从图2可知,4个醇化地不同醇化时间烟叶表面可培养真菌的优势菌群均为根霉属真菌。在醇化前、醇化6个月、醇化9个月时,根霉属真菌均占总真菌数目的90%以上。醇化9个月时,从曲靖地区醇化烟叶表面只分离到根霉属真菌。在烟叶醇化期间,青霉属真菌、曲霉属真菌(Aspergillusspp.)、Cercophora samala真菌、Myrmaecium rubricosum真菌、Coniochaeta velutina真菌、枝孢属真菌和柄孢霉真菌出现的频率相对较高。
随醇化时间的延长,4个醇化地烟叶表面可培养真菌的优势菌群(除根霉属真菌外)也不同。以元江地区为例,醇化前除根霉属真菌外无其他优势菌群,醇化6个月时曲霉属真菌成为第二优势菌群,醇化9个月时除根霉属真菌外无其他优势菌群,醇化15个月时优势菌群有枝孢属真菌、青霉属真菌和Cercophora samala真菌,醇化17个月时优势菌群有柄孢霉真菌、球毛壳菌和枝孢属真菌。
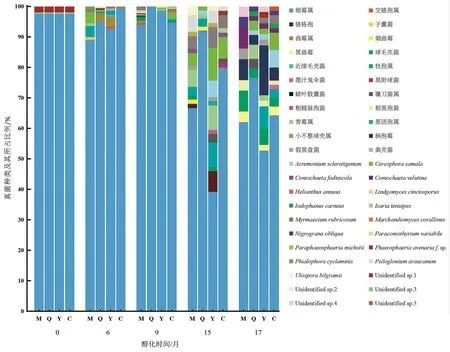
图2 4个醇化地不同醇化时间烟叶表面可培养真菌的组成Fig.2 Community of culturable fungi on surface of tobacco leaves aging for different times in four areas
3 讨论
浦绍占[23]研究表明,温湿度可影响烟叶表面的微生物活性,不同种类微生物萌发生长所需的环境条件不同,就导致在醇化过程中烟叶表面微生物种群结构存在差异。云南K326复烤烟叶在不同地区的醇化过程中,元江和弥勒烟叶表面真菌数量均小于曲靖和楚雄。其中,曲靖和楚雄烟叶表面真菌数量在每个醇化时间点的差异很小,但与元江和弥勒两地差异较大。从气候特征来看,元江和弥勒的年均温湿度与曲靖和楚雄均有较大差异,但曲靖和楚雄两地较为相似,表明烟叶表面真菌数量与环境条件密切相关。
与前人研究结果[2-3,6,24-25]相似,4 个醇化地烟叶表面真菌数量也呈“下降-上升-下降-趋于平缓”的趋势。真菌数量的减少可能存在两方面的原因:①由于醇化过程中烟叶含水量较低,从而抑制了真菌的生长;②烟叶表面微生物之间存在生存竞争关系,导致真菌数量减少[6,26]。
龚俊[27]研究表明烟叶表面微生物的种类随醇化时间的延长而发生变化。本研究中,不同醇化时间点的不同醇化地烟叶表面真菌种类也存在差异,且随醇化时间的延长而增加。苏加坤等[28]、邱立友等[29]研究发现烟叶表面的优势真菌为曲霉属真菌。Welty等[30]发现陈化烟叶表面真菌主要有曲霉属、青霉菌属、链格孢属、枝孢属和毛壳菌属,其中曲霉属真菌含量最高。而本研究中发现的优势菌属为根霉属真菌,与苏加坤等[28]、邱立友等[29]、Welty 等[30]的研究结果不同。徐洁[31]用一种根霉属真菌处理烟叶后发现,处理过的烟叶其香气、香味更优,并在烟叶中检测出具有增香作用的化学物质。因此,仍需对本研究中发现的大量根霉属真菌进行深入研究。
4 结论
从220份云南K326复烤烟叶样品(来自4个醇化地、不同醇化时间)中共分离、纯化到2 963株可培养真菌。不同醇化地区烟叶表面真菌的数量随醇化时间的变化呈“下降-上升-下降-趋于平缓”的趋势。4个醇化地不同醇化时间的真菌种类及优势菌群具有差异,随醇化时间的延长真菌种类不断增加。根霉属真菌是烟叶表面的优势菌群。

