早期肠内外营养对胃癌患者术后免疫功能影响
周典伟 余刚
胃癌患者在手术治疗之后容易出现创伤后遗症,在病情恢复期间会出现进食困难,导致患者术后生理代谢功能严重紊乱。其次,患者体内异化作用加强而固化作用降低,进一步引发免疫功能低下[1]。因此,为了保证胃癌患者术后的营养摄入,临床上常常对胃癌患者采取营养支持的治疗方法,主要包括肠内和肠外两种营养支持疗法。大多数情况下,临床上会选择在术后给予胃癌患者早期肠内营养治疗,因其不仅能够有效吸收营养素,还能够保护患者屏障功能和肠黏膜功能,提升患者免疫功能,避免出现较多炎症反应[2]。此次研究主要是探讨分析早期肠内和肠外营养对胃癌患者术后免疫功能影响,现将此次研究报告作如下汇报。
1 资料与方法
1.1 一般资料
选取2017年7月—2018年7月在医院拟行腹腔镜根治术治疗的90例胃癌患者,患者均经术前胃镜以及病理检查被确诊。按照随机分组原则将所有患者分为对照组和研究组,每组各45例患者。其中对照组中男23例,女22例,年龄44~64岁,平均年龄(53.6±4.1)岁;研究组中男27例,女18例,年龄43~63岁,平均年龄(53.1±3.9)岁;两组患者在一般资料上差异无统计学意义(P>0.05),可以进行比较。本次研究通过了本院伦理委员会的审核,所有患者均签署了研究知情同意书。
表1 两组患者一般情况对比(±s)
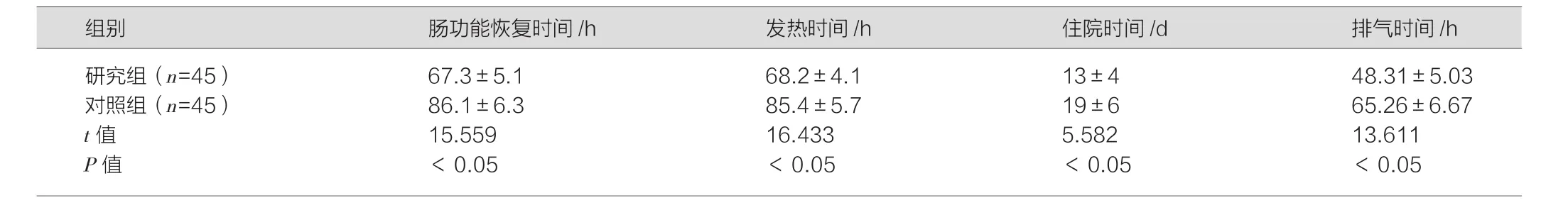
表1 两组患者一般情况对比(±s)
images/BZ_115_213_3039_2303_3097.png研究组(n=45) 67.3±5.1 68.2±4.1 13±4 48.31±5.03对照组(n=45) 86.1±6.3 85.4±5.7 19±6 65.26±6.67 t值 15.559 16.433 5.582 13.611 P值 <0.05 <0.05 <0.05 <0.05
1.2 方法
给予对照组患者肠外营养支持,输液总量为45 mL/kg·d,氨基酸注射液补充氮量,葡萄糖盐水和脂肪乳剂补充热量,适当应用微量元素和维生素。给予研究组患者肠内营养支持干预,术后第1 d补水,术后次日给予患者肠内营养制剂,口服肠内营养混悬液450 mL,按照上述流程持续给予900 mL肠内营养混悬液[3],与此同时给予患者半流质食物,治疗疗程为一周。
1.3 指标观察
观察并记录两组患者接受不同治疗措施之后,肠功能恢复时间、发热时间、排气时间、住院时间等一般情况;在术前与术后第1 d、7 d观察两组患者CD3+、CD4+和CD8+水平、CD4+/CD8+比值及NK细胞活性;记录并比较两组患者术前及术后第7d前白蛋白(prealbumin, PA)和白蛋白(albumin, ALB)含量。
1.4 统计学分析
采用SPSS 18.0软件对本次研究所得到的数据进行处理,计量资料用(均数±标准差)表示,用t检验,计数资料用(%)表示,用χ2检验,当P<0.05时,表示差异具有统计学意义。
2 结果
2.1 对比分析两组患者一般情况
在给予两组患者不同治疗措施之后,研究组患者肠功能恢复时间、发热时间、住院时间、排气时间均显著优于对照组,P<0.05,差异有统计学意义。见表1。
2.2 对比分析两组患者手术前后免疫功能
在给予两组患者营养支持治疗之前,两组患者免疫细胞活性差异无统计学意义(P>0.05);在给予治疗之后,在术后第1 d,两组患者各个免疫细胞活性与术前相比均显著降低,差异有统计学意义(P<0.05);术后第7 d,研究组患者各免疫细胞活性与术前相比差异无统计学意义(P>0.05);而术后第7 d,对照组患者各免疫细胞活性仍处于较低水平,与术前相比差异有统计学意义(P<0.05)。详情见表2。
2.3 两组患者手术前后营养状况比较
表2 对比分析两组患者手术前后免疫功能(±s)
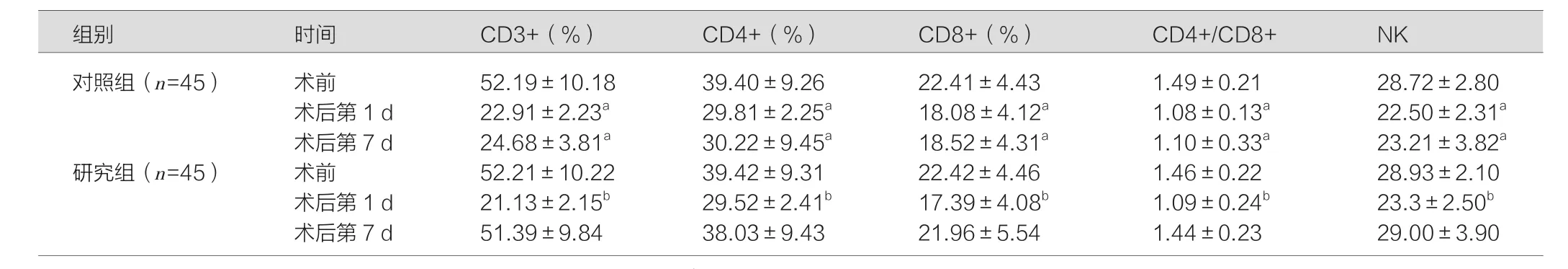
表2 对比分析两组患者手术前后免疫功能(±s)
注:对照组术后与术前相比,aP<0.05;研究组术后与术前相比,bP<0.05。
images/BZ_116_177_415_2267_474.png对照组(n=45) 术前 52.19±10.18 39.40±9.26 22.41±4.43 1.49±0.21 28.72±2.80术后第1 d 22.91±2.23a 29.81±2.25a 18.08±4.12a 1.08±0.13a 22.50±2.31a术后第7 d 24.68±3.81a 30.22±9.45a 18.52±4.31a 1.10±0.33a 23.21±3.82a研究组(n=45) 术前 52.21±10.22 39.42±9.31 22.42±4.46 1.46±0.22 28.93±2.10术后第1 d 21.13±2.15b 29.52±2.41b 17.39±4.08b 1.09±0.24b 23.3±2.50b术后第7 d 51.39±9.84 38.03±9.43 21.96±5.54 1.44±0.23 29.00±3.90
在术后7 d,两组患者的PA、ALB含量与术前相比均无显著差异,且两组组间差异无统计学意义(P>0.05)。见表3。
3 讨论
现阶段,临床上在治疗胃癌患者时主要应用根治手术,该项手术的基础要求在于将胃癌原发灶、受浸润临近脏器以及转移淋巴结彻底切除。胃癌根治术后患者的机体营养情况以及免疫功能均会出现下降趋势[3]。由于患者在术前受到疾病影响,术后进食困难等因素会导致患者出现营养不良等症状,导致患者机体内前白蛋白与白蛋白水平下降[4-5]。按照相关研究显示,胃癌患者体内CD4 / CD8含量减少,表明患者免疫功能下降[6]。胃癌患者术后通常都会使用营养支持治疗方法,包含早期肠内营养与肠外营养支持治疗[7]。此外,肠内营养有助于维持肠黏膜结构和肠屏障功能完整性,因此能减少肠源性感染的发生[8-9]。而长期的全肠外营养会使食物逐渐失去对肠黏膜的刺激作用,导致胃肠激素分泌减少,进而使肠黏膜的营养作用减弱,引起肠结构的改变[10]。相比于肠外营养治疗来说,肠内营养治疗能够减少患者并发症和死亡率[11]。在给予患者肠内营养支持之后可以有效改善营养状况和免疫功能[12-13]。按照此次研究结果显示,在术后第1 d,两组患者各个免疫细胞活性与术前相比均显著降低(P<0.05);术后第7 d,研究组患者各免疫细胞活性与术前无显著差异(P>0.05);而术后第7 d,对照组患者各免疫细胞活性仍处于较低水平,与术前相比存在显著差异(P<0.05)。此外,研究组患者术后肠功能恢复时间、发热时间、住院时间以及排气时间等指标均显著优于对照组,差异有统计学意义(P<0.05)。从上述研究结果能够验证肠内营养支持在胃癌术后患者中的应用价值。
综上所述,给予胃癌手术患者早期肠内营养治疗具有显著效果,有利于改善患者机体营养状况,加强免疫功能。
表3 对比两组患者手术前后营养状况(±s)

表3 对比两组患者手术前后营养状况(±s)
images/BZ_116_177_1996_2267_2055.png术前 PA(mg/L) 218.05±11.24 219.12±10.83 2.83 >0.05 ALB(g/L) 37.66±3.10 37.50±2.89 3.41 >0.05术后7 d PA(mg/L) 214.42±10.06 216.86±10.20 4.40 >0.05 ALB(g/L) 37.01±2.89 37.83±2.77 4.87 >0.05

