孕烷X受体配体结合结构域蛋白晶体的X线衍射结构解析
冯帆,姜棋予,孙慧伟,王祥喜,申立军,辛绍杰,李伯安
1.解放军总医院第五医学中心 a.临床检验医学中心,b.临床研究管理中心,c.肝脏衰竭诊疗中心,北京 100039;2.中国科学院 生物物理研究所,北京 100101
目前,病毒性肝炎不仅严重危害我国人民的身体健康,也对我国公共卫生事业构成巨大挑战。Polaris Observatory Collaborators于2018年撰文,系统分析和总结了全球病毒性肝病的最新流行病学数据,我国有超过8000万人携带乙型肝炎病毒(hepatitis B virus,HBV)或罹患HBV相关的慢性肝病,这些患者中有相当比例最终会进展为肝细胞癌(hepatocellular carcinoma,HCC),因此研究和开发高效的HCC治疗策略具有重要意义[1]。受诊疗技术的限制,绝大多数HCC患者初诊即为进展期(advanced HCC),目前抗肿瘤药物治疗策略主要是口服以多靶标蛋白激酶抑制剂索拉非尼为代表的分子靶向药物[2]。尽管目前对进展期HCC进行分子靶向治疗能够延长患者生存期,改善患者生存质量,但仍存在诸多问题。以索拉非尼为例,分子靶向治疗的临床获益在患者个体间存在较大差异,只有25%~40%的患者对索拉非尼敏感,随着持续服用药物,大多数一开始对分子靶向药物敏感的患者会出现耐药[3],而瑞戈非尼和乐伐替尼/仑伐替尼等新型分子靶向药物进入临床应用的时间较短[4],随着临床诊疗,也可能会有耐药等相关报道。
孕烷X受体(pregnane X receptor,PXR)是一种重要的核受体,蛋白结构特征是具有DNA结合结构域(DNA binding domain,DBD)及配体结合结构域(ligand binding domain,LBD)[5]。与雌激素受体等其他类型的核受体不同[6],PXR不具有配体非依赖的转录激活结构域AF-1,仅具有包含在LBD中的配体依赖的转录激活结构域AF-2,因此与配体或激动剂结合是PXR转录因子活性的重要调节因素。分子靶向药物索拉非尼能够作为配体/激动剂活化PXR进而诱导PXR的各类下游基因(包括各类药物代谢酶及耐药蛋白基因等)表达,通过这些代谢相关蛋白加速抗肿瘤药物自身的代谢与清除等过程,影响其对HCC的治疗效果[7-8]。因此,PXR介导的索拉非尼的代谢与清除机制可能是HCC对药物耐受的根本来源和特异性机制。
前期研究结果显示,用PXR的激动剂(利福霉素)处理细胞能够诱导PXR下游耐药相关基因的表达、加速索拉非尼的代谢与清除作用,最终上调HCC细胞对索拉非尼的耐药;而使用PXR拮抗剂(酮康唑)处理HCC细胞能够下调PXR的转录因子活性、PXR下游耐药基因的表达,延缓索拉非尼在HCC细胞中的代谢与清除作用,最终下调HCC细胞对索拉非尼的耐药,增加HCC细胞对索拉非尼的敏感性[1-2]。这表明,PXR是逆转HCC分子靶向治疗耐药的干预靶标,研究与开发PXR的拮抗剂有助于延缓HCC细胞对索拉非尼的代谢与清除作用,实现更为有效的HCC分子靶向治疗。本研究旨在利用X线晶体衍射技术,获得PXR配体结合结构域的三维结构,为研究和开发靶向PXR的全新药物奠定坚实基础。
1 材料与方法
1.1 材料
大肠杆菌BL21(DE3)菌株、pRSFDuet-1表达载体由中国科学院生物物理研究所王祥喜研究员惠赐;PXR-LBD序列的化学合成及表达载体的构建由济南维真公司完成;DNA聚合酶、限定性内切酶等购自NEB公司;PCR、DNA分离纯化等试剂盒购自Promega公司;DNA marker、琼脂糖等试剂购自北京全式金公司;X线衍射仪及数据分析工作站由中国科学院生物物理研究所王祥喜研究员提供;PCR仪、DNA电泳槽、紫外采像仪等购自ABI公司。
1.2 基因合成与分子克隆
构建含有PXR-LBD(PXR蛋白130~434氨基酸残基截短体)的表达载体[9]。首先对基因进行密码子优化后再进行化学合成,获得PXR-LBD区域的序列。在化学合成PXR-LBD时,将限制性内切酶BamHⅠ和HindⅢ序列加入PXD-LBD片段两端,在此基础上用BamHⅠ和HindⅢ双酶切PXRLBD片段及pRSFDuet-1载体,再将PXR-LBD片段与载体按10∶1混合,16℃孵育2 h,4℃孵育过夜,最终获得含有PXR-LBD序列的pRSFDuet-1载体。对PXR基因序列进行大肠杆菌表达密码子优化后氨基酸残基序列如下:

1.3 PXR蛋白的原核表达
将插入PXR基因的pRSFDuet-1表达载体转化至大肠杆菌BL21(DE3)感受态菌株,验证阳性克隆,保菌冻存于-80℃。将表达菌按1∶1000接种于含有卡那霉素的LB液体培养基小瓶中,37℃摇床上过夜培养,次日将扩增的小瓶接入LB大瓶进行扩增培养。为了防止蛋白错误折叠形成包涵体,待菌体D600nm值达到0.6左右时,将培养温度降至16℃,并加入0.3 mmol/L IPTG诱导目的蛋白低温表达,16~20 h后4000 r/min离心40 min收集菌体,弃上清,加入缓冲液[20 mmol/L Tris(pH7.8),100 mmol/L NaCl,5%甘油]重悬菌体,冻存于-80℃。用超声波破碎仪充分破碎大肠杆菌菌体,16 000 r/min离心40 min收集上清。
1.4 PXR蛋白的分离纯化
由于表达的PXR蛋白具有载体自带的组氨酸标签,故可通过Ni-NTA亲和层析的方法对目的蛋白进行纯化。将Ni-NTA亲和层析柱灌入10倍柱体积左右的纯化缓冲液[20 mmmol/L Tris(pH7.8),100 mmmol/L NaCl,5%甘油]进行平衡,用恒流泵将破菌后的离心上清加入Ni-NTA亲和层析柱,反复通过Ni-NTA亲和层析柱3次,使PXR蛋白充分结合Ni-NTA介质。Ni-NTA亲和层析柱结合结束后,加入纯化缓冲液冲掉剩余未结合的蛋白,继续用洗杂缓冲液[20 mmmol/L Tris(pH7.8),100 mmmol/L NaCl,5%甘油,20 mmmol/L咪唑]冲洗柱子,可将大部分非特异性结合的杂蛋白洗掉。洗去杂蛋白后,加入含有高浓度咪唑的洗脱缓冲液[20 mmmol/L Tris(pH7.8),100 mmmol/L NaCl,5%甘油,250 mmmol/L咪唑]可将目的蛋白从亲和柱洗脱。为了进一步提高蛋白纯度,继续使用凝胶排阻层析技术对蛋白进一步纯化。将分子筛Superdex75用纯化缓冲液[20 mmmol/L Tris(pH7.8),100 mmmol/L NaCl,5%甘油]平衡,用30kD超滤管对洗脱缓冲液洗脱的目的蛋白进行浓缩,将浓缩后的样品(约500 μL)上样Superdex75层析柱,对蛋白峰进行分管收集,再进行质谱检测,确定蛋白表达是否正确。
1.5 PXR蛋白结晶与结构解析
用30kD浓缩管将分子筛纯化后的PXR蛋白浓缩至5 mg/mL,用Hampton等公司的晶体筛选试剂盒对蛋白进行结晶条件筛选与优化。采用悬滴法,于20℃恒温恒湿环境下初步筛选到PXR蛋白结晶条件,在此基础上进行pH、盐浓度、沉淀剂浓度等的条件优化。优化后的晶体生长条件为80 mmmol/L咪唑(pH7.5)、100 mmmol/L Na-Cl、10%异丙醇,最终确定获得高质量的PXR蛋白晶体。以甘油作为防冻剂,在上海同步辐射光源收集晶体衍射数据,参考PDB 1NRL的研究作为初始模型,采用CCP4程序包中的Phaser软件,利用分子置换方法解析该蛋白质晶体的结构,最后用Phenix.refine软件和COOT软件对结构进行修正,确证所得蛋白三维结构数据的分辨率,并保证各项指标均在合理范围内。
2 结果
2.1 PXR蛋白的分离纯化
首先构建了PXR-LBD的表达载体(图1A),其中载体条带约为3000 bp,目标基因条带(PXR-LBD)为750~1000 bp。在此基础上对亲和层析结果进行SDS-PAGE分析,在含250 mmol/L咪唑的洗脱缓冲液的洗脱样品中有大量目的蛋白(图1B)。凝胶排阻层析结果显示目的蛋白性质均一,根据出峰位置判断蛋白应为单体形式存在,无聚集形式的蛋白(图2)。在此基础上,对分子筛吸收峰对应管号为3~11的样品进行SDSPAGE分析,结果显示样品5~9管为纯度较高、均一的PXR目的蛋白(图3)。切割SDS-PAGE凝胶对上述蛋白条带进行质谱鉴定,结果显示最终纯化获得的蛋白即为目的蛋白PXR,且匹配的肽段显示PXR蛋白无降解现象(图4)。
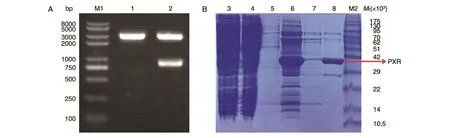
图1 PXR-LBD表达载体的鉴定及PXR-LBD蛋白Ni-NTA亲和层析SDS-PAGE分析

图2 PXR-LBD蛋白Superdex75分子筛纯化结果

图3 PXR-LBD蛋白经Superdex75纯化后的SDS-PAGE分析

图4 纯化的PXR-LBD蛋白SDS-PAGE条带的质谱鉴定结果
2.2 PXR蛋白晶体三维结构的X线衍射解析
采用悬滴法,于20℃恒温恒湿环境下得到PXR-LBD晶体(图5A、B)。对初步筛选到的结晶条件进行pH、盐浓度、沉淀剂浓度等条件优化,最终获得能够进行X线衍射数据收集的高质量蛋白晶体(图5C、D)。所得PXR-LBD蛋白晶体形状规则,质量较高。在此技术上对PXR蛋白晶体进行结构解析,结果如图6,所得蛋白晶体X线衍射的分辨率可达2.8 Å。进一步用HKL2000软件包对收集的衍射数据进行处理,经过指标化、积分和scale,最后确定晶体空间群为P212121。图7为PXR蛋白LBD区域平视和俯视视角的带-环(band-loop)结构图,显示出PXR-LBD的8个α螺旋结构与相应转角(loop)。图8为PXR-LBD的电子密度图,显示LBD蛋白肽链骨架和电子密度。

图5 PXR-LBD蛋白结晶结果

图6 PXR-LBD蛋白晶体X线衍射图

图7 解析的PXR-LBD蛋白晶体整体结构

图8 PXR-LBD晶体结构中配体结合袋(ligand-binding pocket)附近的电子密度(1.5σ)
3 讨论
PXR是重要的核受体,最初仅被认为是类固醇激素受体[7]。随着研究的拓展,多种内/外源药物/毒物都可作为PXR的配体/激动剂,这些药物或毒物能够活化PXR,诱导代谢酶及药物转运体的表达[7]。活化的PXR与维甲酸X受体形成异源二聚体从细胞质迁移进入细胞核,与其下游基因启动子区/增强子区所包含的PXR结合元件结合,最终介导其下游基因的转录[7]。PXR的下游基因种类多样、作用广泛,主要包括多药耐药基因-1和乳腺癌耐药蛋白等各类耐药蛋白(即药物Ⅲ相代谢酶/药物转运体)、CYP 3A4等多种亚型的细胞色素氧化酶(即药物Ⅰ相代谢酶/药物氧化代谢酶)、尿苷二磷酸葡萄糖醛酸转移酶等基团转移酶(即药物Ⅱ相代谢酶/基团转移酶)[7]。各种抗肿瘤药物能够对HCC细胞造成严重损伤,因此抗肿瘤药物既是外源性药物,又是外源性毒物。PXR作为肝脏对外源性药物和毒物代谢与解毒机制的调控枢纽,各种抗肿瘤药物有可能作为配体/激动剂活化PXR,进而诱导PXR的各类下游基因(包括各类药物代谢酶及耐药蛋白等)表达,最终通过这些代谢相关蛋白加速抗肿瘤药物的代谢与清除等过程,最终影响HCC的治疗效果。由于肝脏是人体代谢的中心,而HCC细胞具有更为旺盛的物质摄取和代谢特性,因此PXR介导的抗肿瘤药物的代谢与清除机制可能是HCC对抗肿瘤药物多药耐药的根本来源和特异性机制。这表明,研究和开发PXR的拮抗剂具有重要意义。但现有药物研究存在较大不足,体现在:以利福平为代表的多种药物被确认为PXR的激动剂或明确其具有诱导PXR转录的作用,但关于PXR拮抗剂的报道极少,仅酮康唑一种药物被用作PXR的拮抗剂;现有研究主要关注PXR的药代动力学、药物相互作用,其作为抗肿瘤干预靶标的研究极少;目前未有依据PXR设计小分子化合物拮抗剂的研究报道,而获得PXR的高分辨率三维结构数据是设计与研发PXR特异性拮抗剂的基础。我们解析了PXR-LBD的晶体结构,不仅有助于PXR相关研究,也为基于PXR三维结构的药物设计与研发奠定了坚实基础。

