苦参素对大鼠全脑缺血再灌注损伤保护作用的实验研究
外科手术、心脏骤停、窒息等导致低压、低氧常引发全脑缺血[1],目前临床以药物或介入手术溶栓为主要治疗方案,但再灌注损伤极大地影响病人预后,其机制与炎症、氧化应激及细胞凋亡有关[2-3]。现代药学研究发现,苦参素为喹诺西啶类生物碱,是一类具有抗炎、抗凋亡活性的中药提取物[4-5],但苦参素对全脑缺血再灌注损伤影响的相关报道较少,本研究探讨苦参素对大鼠全脑缺血再灌注后脑组织的保护作用。
1 材料与方法
1.1 实验动物 健康清洁级SD大鼠(雌雄不限)由河北医科大学实验动物中心提供[SCXK(冀)2013-1-003]。
1.2 实验药物与试剂 苦参素(南京泽朗医药科技有限公司,批号:20170114);白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子α(TNF-α)试剂盒和末端脱氧核苷酰基转移酶介导dUTP切口末端标记(TUNEL)试剂盒购自北京博奥森生物技术有限公司,批号:170129、170312、170116、170324;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒购自南京建成生物工程研究所,批号:20170309、20170413、20170114。
1.3 实验方法
1.3.1 动物分组、给药与模型制备 采用随机数字表法将100只SD大鼠随机分为假手术组(0.9%氯化钠溶液)、模型组(0.9%氯化钠溶液)和苦参素低剂量组[25 mg/(kg·d)]、中剂量组[50 mg/(kg·d)]、高剂量组[100 mg/(kg·d)],每组20只。术前10 min腹腔注射相应浓度药物,实施麻醉后通过夹闭四动脉(双侧椎动脉和双侧颈动脉)制备全脑缺血大鼠模型,造模成功标志:脑电图波幅下降正常25%以下、翻正反射消失、瞳孔颜色变灰白,夹闭四动脉20 min;假手术组不夹闭四动脉,其余操作同模型组[6]。
1.3.2 翻正反射和脑电恢复时间记录 应用BL-420E型生物机能实验系统记录大鼠翻正反射恢复时间;记录脑电振幅恢复到正常75%时间,即脑电恢复时间。
1.3.3 脑组织含水量 各组随机取6只大鼠,麻醉后取脑并去除小脑和脑干,称重为湿重;用锡纸包裹后置110 ℃干燥箱烘烤至恒重,称重为干重,脑组织含水量=[(湿重-干重)/湿重]×100%。
1.3.4 海马CA1区病理学检查及神经元凋亡观察 每组随机取6只大鼠,麻醉后取脑并去除小脑和脑干后置于浓度4%多聚甲醛溶液固定72 h,之后进行石蜡包埋和切片,切片厚度约2 μm,经二甲苯透明、脱蜡水化处理后,进行苏木精-伊红(HE)染色,梯度乙醇脱水后封片,最后通过光学显微镜观察海马CA1区组织细胞病理学改变。取石蜡切片并脱蜡水化处理后,按照TUNEL试剂盒操作说明步骤进行,通过光学显微镜观察细胞凋亡状况,计算视野内细胞总数和凋亡细胞数,每张切片均取5个不重叠的视野并分别计数后取平均值,计算凋亡指数(AI)=(凋亡细胞数/细胞总数)×100%。
1.3.5 海马组织炎症细胞因子含量、抗氧化酶活性和MDA含量 取各组剩余8只大鼠,麻醉后取脑组织并剥取海马组织,于冰上剪碎后加入适量冷裂解液后行研磨匀浆,4 ℃条件下,12 000 r/min离心,取上清液,之后按照各试剂盒操作方法测定炎症细胞因子IL-1β、TNF-α、IL-6含量和抗氧化酶SOD、CAT活性和MDA含量。

2 结 果
2.1 各组大鼠翻正反射和脑电恢复时间、脑含水量比较 与模型组比较,苦参素中剂量组、高剂量组翻正反射和脑电恢复时间均显著缩短(P<0.01)。模型组脑组织翻正反射恢复时间、脑电恢复时间和脑含水量较假手术组显著升高(P<0.01);与模型组比较,苦参素中、高剂量组脑含水量显著降低(P<0.05或P<0.01)。详见表1。

表1 各组大鼠翻正反射和脑电恢复时间、脑含水量比较(±s)
与假手术组比较,1)P<0.01;与模型组比较,2)P<0.05,3)P<0.01
2.2 海马CA1区神经元形态结构 假手术组未见异常;模型组海马CA1区神经元数量减少、排列稀疏、层次紊乱,胞体肿胀或空泡变性,核固缩或溶解、核膜不清等病理性改变;苦参素干预能改善全脑缺血再灌注大鼠海马CA1区神经元病变,以高剂量组最显著。详见图1。
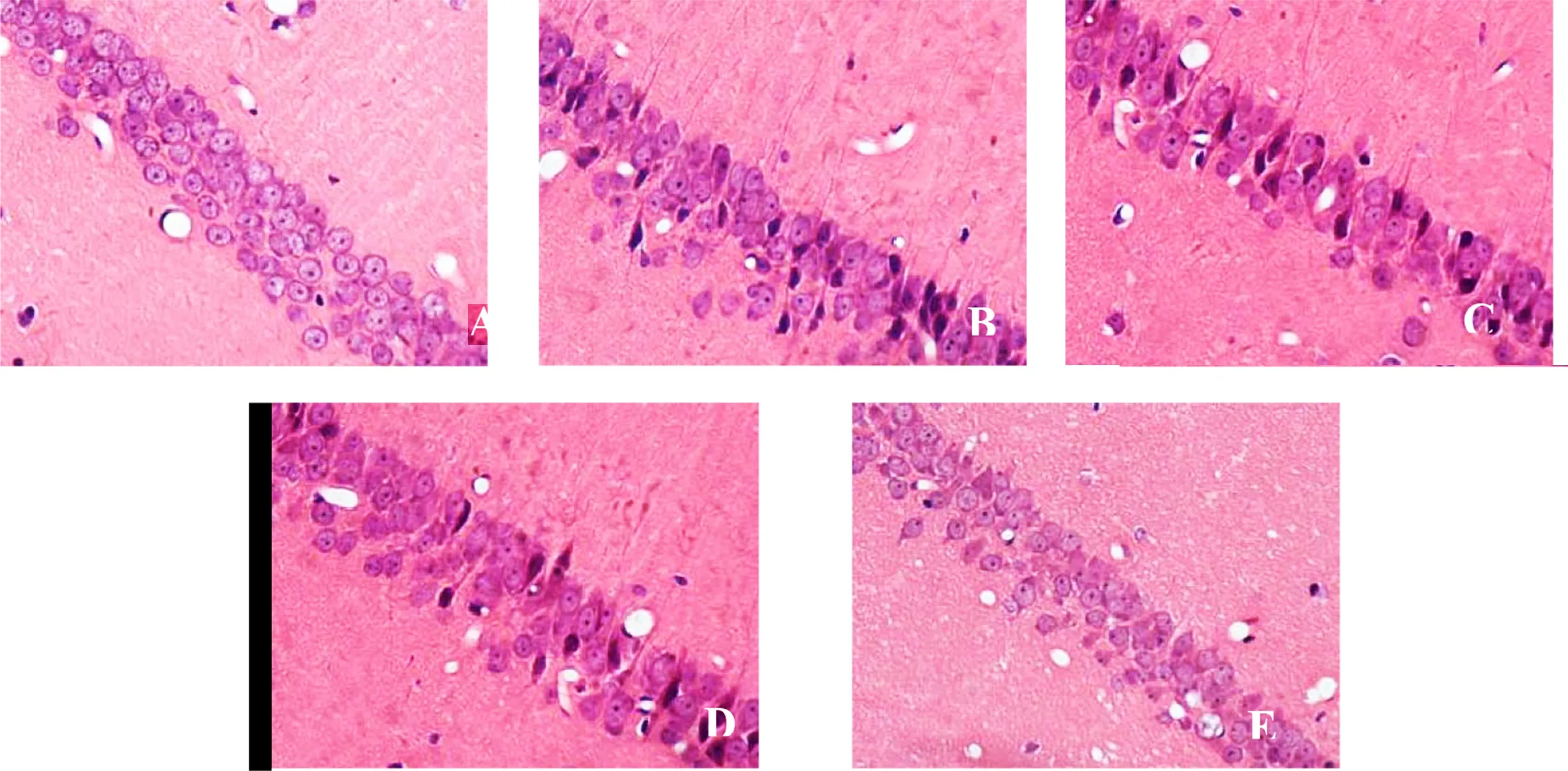
A为假手术组;B为模型组;C为苦参素低剂量组;D为苦参素中剂量组;E为苦参素高剂量组
图1各组大鼠大脑海马CA1区神经元形态结构(HE,×400)
2.3 海马CA1区神经元凋亡状况 假手术组仅见少量凋亡神经元;模型组凋亡神经元数量明显多于假手术组;与模型组比较,苦参素能减少神经元凋亡,以高剂量组最显著。详见图2。模型组AI高于假手术组[(64.8±8.3)%与(2.3±0.9)%,P<0.01];与模型组比较,苦参素中、高剂量组AI明显降低[(41.2±7.0)%、(15.8±3.6)%与(64.8±8.3)%,P<0.01]。

A为假手术组;B为模型组;C为苦参素低剂量组;D为苦参素中剂量组;E为苦参素高剂量组
图2各组大鼠大脑海马CA1区神经元凋亡状况(TUNEL,×400)
2.4 各组大鼠海马组织炎症细胞因子含量比较 模型组炎症细胞因子TNF-α、IL-1β、IL-6含量较假手术组均明显升高(P<0.01);与模型组比较,苦参素中剂量组、高剂量组炎症细胞因子TNF-α、IL-1β、IL-6含量均显著降低(P<0.05或P<0.01)。详见表2。
2.5 各组大鼠海马组织抗氧化酶活性和MDA含量比较 模型组抗氧化酶(SOD、CAT)活性较假手术组降低(P<0.01),MDA含量升高(P<0.01);与模型组比较,苦参素中剂量组、高剂量组SOD、CAT活性增高且MDA含量降低(P<0.05或P<0.01)。详见表3。

表2 各组大鼠海马组织炎症细胞因子含量比较(±s) nmol/L
与假手术组比较,1)P<0.01;与模型组比较,2)P<0.05,3)P<0.01

表3 各组大鼠海马组织抗氧化酶活性和MDA含量比较(±s)
与假手术组比较,1)P<0.01;与模型组比较,2)P<0.05,3)P<0.01
3 讨 论
氧化应激、炎症及神经元凋亡在再灌注损伤发生发展中发挥重要作用[2-3,7],其作为靶点已成为防治缺血再灌注损伤新型药物研发热点。苦参素是中药苦参的主要有效成分之一,王雪芬等[8]研究发现苦参素具有扩张血管、改善微循环的药理学作用,苦参素通过抑制氧化应激、细胞凋亡表现出对心肌缺血再灌注损伤的保护作用[8-9];贾昌盛等[10]研究发现苦参素通过调控机体抗氧化系统对肾脏缺血-再灌注损伤起到一定保护作用;高鹏[11]研究发现苦参素通过抑制细胞凋亡而保护肝脏缺血再灌注。既往关于苦参素对全脑缺血再灌注损伤影响文献的报道尚不多见。
本研究采用与人类病理特点接近的四动脉夹闭法制备全脑缺血再灌注大鼠模型[12]展开研究,海马是对脑缺血最敏感的区域之一,尤其是CA1区的锥体细胞层[13],因此本研究以大脑海马CA1区为组织损伤及改善观察区域。本研究结果显示,中、高剂量苦参素预处理能有效缩短翻正反射和脑电恢复时间、降低脑组织含水量、抑制海马CA1区病变并抑制该区域神经元凋亡,提示苦参素对全脑缺血再灌注损伤具有一定的保护作用。
氧自由基代谢失衡是导致细胞膜不饱和脂肪酸氧化破坏等氧化应激损伤的根源,其代谢失衡,在体内蓄积与抗氧化酶(SOD、CAT)过度消耗有关[14];MDA为不饱和脂肪酸氧化应激损伤终产物之一,其含量间接反映氧化应激损伤程度[15]。炎症细胞因子是临床监测炎症反应的常用指标。本研究结果显示,中、高剂量苦参素预处理能有效提高海马组织SOD、CAT活性并降低MDA含量,降低TNF-α、IL-1β、IL-6含量,提示苦参素对全脑缺血再灌注损伤后氧化应激损伤及炎症反应具有一定的抑制作用。
综上所述,苦参素对全脑缺血再灌注损伤具有保护作用,其机制可能与抑制氧化应激和炎症反应有关。

