碳量子点对甜瓜幼苗镉胁迫的缓解作用
王运强 肖炼 邹正康 杨道勇 李俊丽 戴照义

摘 要:为探究碳量子点对植物镉胁迫的缓解作用,在含Cd2+的水培系统中加入不同浓度的碳量子点研究其对甜瓜生长发育的影响。结果表明,碳量子点能降低甜瓜幼苗根和叶中的Cd2+含量(11.4%~82%),缓解Cd2+对甜瓜生长的抑制作用。另外,碳量子点能提高叶绿素含量(8.5%~10.7%),降低根系活力、花青素、MDA含量(12.5%~14.4%)和POD活性,减弱Cd2+对叶绿素合成的阻碍,并通过调节根中代谢使可溶性蛋白含量增加抵御镉胁迫,提高根中CAT和叶中APX等酶的防御功能。综上所述,75 mg·L-1碳量子点对50 mg·L-1以下Cd2+造成的镉毒害修复作用最佳,为碳量子点作为一种新型重金属毒害修复剂在农业上的应用提供了参考。
关键词:甜瓜;碳量子点;镉离子;抗氧化酶 ;缓解
Abstract: In order to explore the alleviation effect of carbon quantum dots on cadmium stress in plants, different concentrations of carbon quantum dots were added to hydroponic systems containing cadmium ions (Cd2+) to cultivate melon seedlings. The results showed that carbon quantum dots can reduce the Cd2+(11.4%-82%)content in roots and leaves of melon seedlings, and alleviate the inhibitory effect of Cd2+ on melon seedlings growth. In addition, carbon quantum dots can increase chlorophyll content (8.5%-10.7%), reduce the root activity, anthocyanin, MDA content (12.5%-14.4%) and POD activity, attenuate the inhibition of Cd2+ on chlorophyll synthesis, and restore soluble protein content to resist cadmium stress by regulating root metabolism, and restore the defense function of enzymes such as CAT in the root and APX in the leaves. In summary, 75 mg·L-1 carbon quantum dots have the best repair effect on cadmium toxicity caused by Cd2+ below 50 mg·L-1. These provide a new reference for the application of carbon quantum dots as a heavy metal poisoning repair agent in agriculture.
Key words: Melon; Carbon quantum dots; Cadmium ion; Antioxidant enzyme; Alleviation
隨着经济的快速发展,在追求绿色文明的同时,环境污染问题也越来越受到人们的重视[1]。其中重金属由于毒性大、污染范围广、潜伏时间长,已经严重危害到生态环境[2]。镉(Cd)由于其在环境中具有很强的迁移转化特性及对人类健康的高度危害性而被列为第6位危害人类健康的有毒物质[3]。食物链是镉对人类健康造成危害的主要途径之一,而植物是生态系统的生产者,因而降低镉在植物体内的积累和毒害作用显得尤为重要[4-5]。已经有很多研究报道了降低植物镉毒害的方法,如已经发现硅(Si)可以减轻花生和玉米等植物中镉的毒性、分布和抗氧化酶的刺激[6-7];Hu等[8]报道了过氧化氢预处理可降低水稻幼苗的镉毒害和易位;Bai等[9]证明了添加200 μmol·L-1水杨酸可以显著减轻镉诱导的生理胁迫并促进黑麦草植物生长。这些方法存在应用率不高、使用范围小、副作用大等缺点,仍需探索更加适宜的方法来缓解镉毒害。
纳米技术作为21世纪的高新科技已经被应用于能源、信息、环境、生物医学及国家安全等各个领域[10]。纳米肥料、纳米农药、纳米塑料等纳米材料在农业生产上得到广泛的应用[11]。黄一帆[12]研究发现,纳米二氧化锰明显减轻了镉对水稻幼苗的生物量的影响,但是却造成了更加严重的氧化应激反应。这可能是由于金属纳米材料本身会对植物造成一定的生理胁迫[13]。相比而言,碳纳米材料由于其组分和独特的物理化学特性,具有生物相容性好、细胞毒性小、易于吸收等优良性质[14]。已经有报道证实了碳纳米材料对植物的生长发育存在促进作用,表现为促进植物的种子萌发、根系生长以及生物量积累[15]。此外Song等[16]发现了碳纳米管能降低镉对绿豆和萝卜种子萌发和根系生长的毒害作用。这些都证明了碳纳米材料在降低植物的重金属毒害方面有着广阔的应用前景。
在碳纳米材料中,碳量子点(CQDs)以其生产成本低、水溶性好、高荧光稳定性等优异特性被证实在生物传感、生物成像、药物载体、光催化等众多领域有优异的应用价值[17]。Tripathi和Sarkar[18]报道了碳量子点能进入小麦体内,无植物毒性且能促进小麦根和叶的生长,增加作物产量。但是目前还没有关于碳量子点对植物重金属毒害影响的报道。甜瓜属葫芦科,一年生蔓性草本植物,味美香甜,除了富含营养价值外,还具有消暑热、解烦渴、利小便等药用价值[19]。甜瓜受到镉毒害后,光合作用被显著抑制,影响幼苗生长和后期的结果[20]。当Cd2+浓度达到5 mg·L-1以上时,甜瓜幼苗的鲜质量会明显下降,表现出明显的生长受阻现象[21]。基于以上观点,笔者探究了生理毒性较小的CQDs对受镉毒害的甜瓜幼苗体内镉积累量和生理生化影响,以期为CQDs作为新型植物镉毒害修复剂的开发提供依据,也为CQDs在农业上的安全应用做出评价。
1 材料与方法
1.1 材料
水溶性的碳量子点(CQDs)由武汉理工大学光纤传感技术国家工程试验室合成,其形状和大小用Tecnai G2 20 TWIN 透射电子显微镜(TEM)(FEI,美国)测定,如图1所示,平均粒径为3~5 nm。
甜瓜种子(‘HCO14,厚皮甜瓜)由湖北省农业科学院经济作物研究所提供,试验中的水培营养液为改良型的霍格兰营养液。
1.2 试验设计
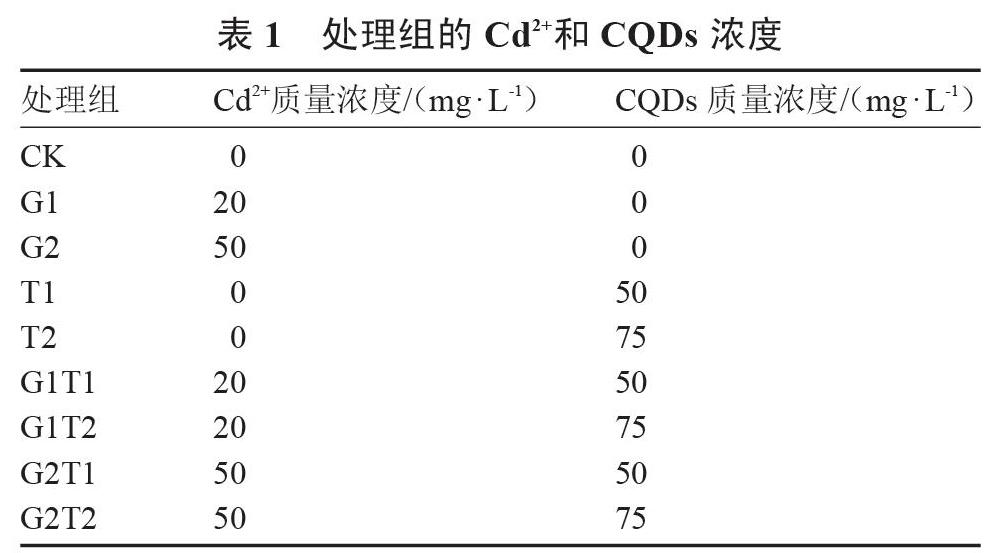
试验于2017年3—7月在湖北省农业科学院经济作物研究所南湖蔬菜试验基地进行。首先挑选籽粒饱满的甜瓜种子,用55 ℃温水浸泡并不断搅拌,待水温降至室温后浸泡3 h,捞起种子,洗净甩干,用湿润的纱布包裹,置于30 ℃的恒温培养箱里催芽24 h,然后挑选芽长一致的甜瓜种子播种在消毒灭菌后的无镉基质土中,然后放置在塑料大棚中培育。待幼苗子叶平展后,将甜瓜幼苗移栽到水培盆中,用去离子水进行适应性培养,每盆18株,放入温度为28/18 ℃(16/8 h),光照为20 000/0 lx(16/8 h)的人工气候箱。3 d后换用含1/4霍格兰营养液(pH 5.6)培养,每隔5 d更换1次1/4营养液。培养10 d后,用从预试验中得到的对甜瓜幼苗无生理毒性且有一定生长促进作用的碳量子点质量浓度50和75 mg·L-1,以及对甜瓜幼苗生长有一定影响的镉离子(氯化镉)质量浓度20和50 mg·L-1进行处理。将试验分为9个处理组,每组18株幼苗,每处理组3次重复,其处理浓度如表1所示。
表1 处理组的Cd2+和CQDs浓度
[处理组 Cd2+质量浓度/(mg·L-1) CQDs质量浓度/(mg·L-1) CK 0 0 G1 20 0 G2 50 0 T1 0 50 T2 0 75 G1T1 20 50 G1T2 20 75 G2T1 50 50 G2T2 50 75 ]
1.3 方法
待甜瓜幼苗在处理组中生长7 d后,用直尺测量植株的根长、茎长和总长,称量植株鲜质量,105 ℃杀青,然后将其放在60 ℃烘箱中烘至恒重,称量干质量并计算含水量。
将甜瓜幼苗用EDTA-Na2溶液洗净,再用去离子水冲洗2~3遍,用不锈钢工具把样品的叶、茎和根分开,装入牛皮纸信封,105 ℃杀青,在60 ℃烘箱内烘干至恒重。用料理机粉碎后,称取适量植物样品用浓硝酸和H2O2在100 ℃下进行消解,冷却后用原子吸收分光光度计(GBC,澳大利亚)测定其中的Cd含量。
取每个处理组所有甜瓜幼苗的同一位置的叶和根分别剪碎混匀,再分别称取0.3 g叶和根研磨均匀,将匀浆离心后用磷酸缓冲液(pH=7.8)定容到10 mL并保存在低温下,用于测定植物组织的各项生理生化指标。用红四氮唑(TTC)法测定根系活力[22];用乙醇浸泡叶片提取叶绿素,并用比色法测定叶绿素含量[23];用考马斯亮蓝G-250染色法测定可溶性蛋白含量;用盐酸乙醇(1∶100)浸泡提取并用比色法测定花青素含量[24];用硫代巴比妥酸(TBA)测定丙二醛(MDA)含量[25];用氮蓝四唑光化还原法测定超氧化物歧化酶(SOD)活性[25];用愈創木酚法测定过氧化物酶(POD)活性[26];用紫外分光光度法测定过氧化氢酶(CAT)活性[27];用过氧化氢启动抗坏血酸(AsA)和酶的反应并用比色法测定抗坏血酸过氧化物酶(APX)活性[28]。
1.4 数据处理
所有试验数据采用 Excel 2016和SPSS 22.0进行处理,利用Duncan 法进行多组样本间的差异显著性分析,用Origin 7.5绘制图表。
2 结果与分析
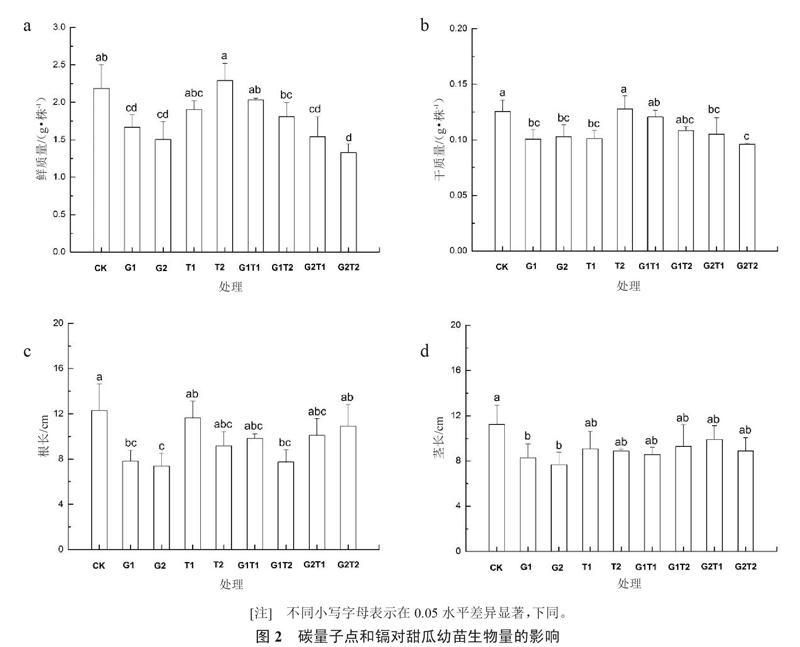
2.1 碳量子点和镉对甜瓜幼苗生物量的影响
如图2所示,在只含Cd2+的处理组中(G1和G2),甜瓜幼苗的鲜质量、干质量、根长和茎长都显著低于对照,表明Cd2+对甜瓜幼苗具有很强的生长抑制作用。而在CQDs的处理组中,甜瓜的鲜质量和长度都与对照无明显差异。相比于G1处理组,G1T1处理组的甜瓜幼苗的鲜质量高出27%,干质量的差异虽然不显著,但是在数值上高19.9%,这证明CQDs的加入明显缓解了镉对甜瓜生物量的毒性。此外,G2处理组比G2T2处理组的根长短32.4%,茎长虽然差异不显著,但是数值上低13.6%,这些都说明了CQDs能减轻Cd2+对甜瓜幼苗的生长抑制作用。
2.2 甜瓜幼苗的镉积累量
如图3所示,在只含Cd2+处理组中,甜瓜幼苗根中的镉含量随着Cd2+浓度的增加而增大。而在 G2T1和G2T2处理组的根中的镉含量均显著低于G2处理组,分别相当于G2组的88.6%和58.1%,,表明CQDs能够有效阻碍Cd2+进入根中。G2T2处理组根中的镉含量低于G2T1中的,表明随着CQDs浓度的升高,根中的镉含量降低越显著。而在甜瓜幼苗的叶中,G2处理组的镉含量低于G1处理组,可能是由于根中高浓度的Cd2+破坏了根细胞运输功能,导致根中的Cd2+难以向上转运。在G2T1和G2T2处理组中,叶中镉含量显著低于50 mg·L-1 Cd2+处理组(分别相当于G2组的30.1%和18.0%),证明加入CQDs也降低了叶中的镉含量。结合图2中的数据可知,CQDs可以通过减少Cd2+在植物体内的积累来缓解镉对生长的抑制。
2.3 碳量子点和镉对甜瓜幼苗的叶绿素和根系活力影响
如图4-a所示,在只含Cd2+的处理组中,甜瓜幼苗的根系长度明显比对照短,且须根数量比对照组少,表明Cd2+抑制甜瓜幼苗根系生长。在图4-b中,只含镉的处理组的幼苗根系活力显著高于对照组,可能是Cd2+刺激了根系活力的增加。另外,我们发现同时含有Cd2+和CQDs的处理组的根系活力明显低于只含Cd2+的处理组,且与对照组的根系活力相近。图4-a中,明显观察到G2处理组的甜瓜幼苗叶子枯黄,这表明镉对叶的强毒害作用。图4-c中G2处理组的叶绿素含量明显低于对照组,但G2T1和G2T2处理组中叶绿素含量比G2处理组分别高8.5%和10.7%,这表明CQDs能缓解镉对甜瓜叶的毒害作用。
2.4 碳量子点和镉对甜瓜幼苗可溶性蛋白和花青素含量的影响
图5-a中,只含Cd2+的处理组根和叶中的可溶性蛋白含量随着Cd2+的浓度增大而增加,表明镉造成了甜瓜幼苗叶中的氧化胁迫。同时含有Cd2+和CQDs的处理组中根和叶的可溶性蛋白含量与相同浓度单独的Cd2+处理组差异不显著,但是随着Cd2+的浓度增大,可溶性蛋白含量依旧增大。图5-b中,G2处理组根中的花青素显著高于对照,表明镉对根造成了氧化损伤从而引起花青素含量增加。而在G2T1和G2T2处理组中,CQDs的加入显著降低了甜瓜幼苗根中花青素含量,且随着CQDs含量的增加花青素下降越明显。
2.5 碳量子点和镉对甜瓜幼苗叶片MDA含量的影响
在图6中,G2处理组叶中的MDA含量显著高于对照(高46.2%),表明Cd2+对甜瓜叶片造成了严重的氧化损伤,从而导致叶片中的细胞膜脂质过氧化。而G2T1和G2T2处理组中MDA含量显著低于G2处理组(分别低14.4%和12.5%),表明CQDs能降低Cd2+对叶片的氧化刺激使MDA含量下降。
2.6 碳量子点和镉对甜瓜幼苗抗氧化酶活性的影响
在图7-a中,所有处理组根中的SOD活性与对照组中的比较无显著差异,但是G2处理组叶中的SOD活性显著高于对照组的(高29.8%)。而G2T1和G2T2处理组的SOD活性与对照差异不显著,相对与G2处理组在数值上分别下降了6.4%和11.0%。图7-b中,G1和G2处理组根中的POD活性明显高于对照,且G2处理组叶中的POD活性也高于对照。而G2T1的处理组叶中的POD活性比G2处理组叶中的低25%,根中的虽然差异不显著但是在数值上也低5.8%。图7-c中,只含有Cd2+的处理组根中的CAT活性显著低于对照组。而同时含有Cd2+和CQDs的处理组的CAT活性显著高于只含Cd2+的处理组,且与对照组相似。在叶中,只含有Cd2+的处理组的CAT活性高于对照。同时加入CQDs的处理组的CAT活性虽然与单独含镉的处理组中的差异不显著,但是数值上均存在不同程度的下降。在图7-d中,所有含Cd2+处理组根中的APX活性均低于对照,而只含CQDs的处理组的APX活性与对照无差异。在叶中,G1处理组的APX活性明显高于对照,但在G2处理组的APX活性却低于G1处理组的。而在G1T1和G2T2处理组中,其APX活性均显著高于G2处理组,分别高32.7%和90.0%。
3 讨论与结论
Cd2+对植物的毒性通常表现为对生长特性和生物量的影响[29]。Li等[30]证明碳量子点对绿豆植物的生物量没有显著影响。本研究结果也表明CQDs对甜瓜幼苗无植物毒性,且能缓解Cd2+对甜瓜幼苗生长发育的抑制作用。通过检测镉含量,结果显示CQDs降低了甜瓜根和叶中的镉积累,且随着CQDs的增加,降低镉含量的效果越显著。曾云龙等[31]证明了碳量子点可以通过吸附作用去除水中的重金属离子(Cu2+、Hg2+、Pb2+、Ni2+、Cd2+、Cr3+、Fe3+、Co2+、Zn2+、Ag+等),用来降低环境污染和重金属的回收利用。刘阿梅等[32]也报道了生物碳能降低植物地上部分的镉含量,从而缓解镉产生的生理胁迫。因此,我们推测是由于CQDs特有的纳米结构使其能吸附水中的Cd2+,从而降低溶液中游离的Cd2+浓度,导致其不容易被植物吸收进入根,叶中的镉含量也因此降低了。进一步的研究显示,Cd2+对甜瓜根系活力有刺激作用,黄运湘等[33]也发现了镉导致大豆幼苗根的根系活力升高的现象。吴恒梅等[34]也发现,Cd2+浓度为5 mg·L-1处理7 d后丝瓜幼苗的根系活力是高于对照的,随着镉離子浓度的升高根系活力逐渐下降到低于对照。这些表明Cd2+随着浓度的增加,对根系活力的影响是先增加后下降的。本研究中甜瓜幼苗属于对镉抗性较强的植物,所以在20和50 mg·L-1 Cd2+处理下,甜瓜处于Cd2+刺激根系活力增加的浓度。而加入碳量子点根系活力恢复到与对照无明显差异,表明CQDs对根中的镉毒害有修复作用。此外,Cd2+也抑制甜瓜幼苗中叶绿素的合成,姜永雷等[35]也报道了Cd2+胁迫引起水蕨幼苗叶绿素含量下降,而CQDs能缓解镉对叶绿素合成的抑制作用,进一步证明CQDs对叶也有修复作用。
另外,植物在重金属胁迫下可溶性蛋白含量增加,会调整蛋白质的结构和功能,有助于维持细胞的正常代谢[36]。张永平等[20]证明了甜瓜幼苗的可溶性蛋白含量随着镉浓度的增加先升后降低。在本研究中,甜瓜根和叶中可溶性蛋白含量随Cd2+浓度的增加而增加,表明植物的防御机制被激活,而同时含Cd2+和CQDs的处理组中可溶性蛋白含量无明显变化,一种原因可能是抗氧化系统足以抵御镉胁迫,其他的原因有待进一步研究。花青素是一种具有优异的抗氧化功能并广泛存在于植物中的天然色素[37],其含量的增加有利于抵抗氧化刺激。戴灵鹏等[38]报道了花青素含量的增加是满江红抗性机理之一,可缓解Cd2+对植物的毒害。本研究中单独的50 mg·L-1 Cd2+处理刺激甜瓜根中花青素含量显著增加,CQDs的加入使花青素含量降低,表明CQDs缓解了Cd2+对甜瓜叶造成的氧化损伤。
MDA是植物膜脂质过氧化其产物之一,被用来衡量植物对逆境条件反应的强弱[39]。陈宏等[40]也发现了小麦幼苗经镉胁迫后,随着镉浓度的增高,叶片中的MDA的含量明显升高,且叶片中MDA积累量高于根。研究结果表明CQDs的加入降低MDA的含量,表明CQDs缓解了镉对细胞膜的刺激。抗氧化酶系统是植物抵抗逆境胁迫重要防御体系[41],其中SOD是活性氧(ROS)的清除剂,将活性氧转化为过氧化氢来维持活性氧的代谢平衡[42]。POD、CAT和APX均是可以清除过氧化氢的酶,用于减少过氧化物对细胞的氧化损伤[43]。50 mg·L-1 Cd2+增加了叶中的SOD活性表明其对甜瓜幼苗的叶片产生氧化刺激。姜武等[44]报道了镉胁迫引起了铁皮石斛SOD活性升高,且SOD活性与镉浓度成正相关。结果显示CQDs的加入可以显著降低SOD活性,表明CQDs减少了活性氧的产生,从而缓解镉毒害。单独镉处理使POD活性增加,说明Cd2+对甜瓜根和叶都产生了氧化刺激。段云青等[45]发现了小白菜的POD活性在一定范围内均随镉胁迫强度的增加而升高。加入50 mg·L-1 CQDs后降低了甜瓜叶中POD的活性,进一步证明CQDs的解毒作用。单独镉处理使根中CAT活性下降,可能由于根中镉含量较高产生的氧化刺激太强,导致抗氧化系统受损。在叶中单独镉处理却导致CAT活性升高,表明镉对叶产生氧化刺激,引起抗氧化酶活性增加来清除过氧化氢。赵士诚等[46]报道了镉诱导玉米叶中CAT活性增加,且随着镉浓度增加,CAT活性逐步下降。本研究中CQDs使CAT的活性保持稳定,说明其缓解了镉对CAT活性的影响。在单独镉处理下,根和叶中APX的活性变化与CAT的相似。范庆等[47]发现了镉胁迫导致矮牵牛幼苗叶片的APX活性显著升高。本研究中在高浓度的镉胁迫下,APX活性反而低于对照,可能是细胞受损严重导致APX功能紊乱,但是CQDs的加入使APX活性恢复正常,间接证明CQDs对镉毒害的修复效果。
本试验结果表明,Cd2+抑制甜瓜幼苗的干质量、鲜质量、根长和茎长等生长参数,而CQDs的能减轻镉对甜瓜生长发育的抑制作用。此外CQDs显著降低了甜瓜根和叶中的镉积累量,从而缓解了镉对根系活力和花青素的刺激,增加了叶绿素含量。尽管甜瓜本身对镉的抗性较强,但50 mg·L-1 Cd2+仍然诱导了甜瓜叶中MDA含量增加和相关抗氧化酶活性的变化。加入CQDs后 ,除了缓解这些氧化应激,还能降低镉对CAT、APX等酶活性的破坏,增加抗氧化酶活性来清除镉产生的活性氧。这些都证明了CQDs能修复镉对甜瓜幼苗的毒害作用,为其作为新型植物修复剂奠定了基础。
参考文献
[1] 车均,梁荣海,崔丰元,等.环境科技创新在绿色经济发展中的应用与实践研究[J].环境科学与管理,2014,39(12):74-76.
[2] 王振中,张友梅,邓继福,等.重金属在土壤生态系统中的富集及毒性效应[J].应用生态学报,2006,17(10):1948-1952.
[3] 翟齐啸.乳酸菌减除镉危害的作用及机制研究[D].无锡:江南大学,2015.
[4] 崔玉静,赵中秋,刘文菊,等.镉在土壤-植物-人体系统中迁移积累及其影响因子[J].生态学报,2003,23(10):2133-2143.
[5] 邱志勇.双酚A与镉对大豆幼苗生长及叶绿素荧光的复合影响[D].无锡:江南大学,2013.
[6] GANGRONG S,QINGSHENG C,CAIFENG L,et al.Silicon alleviates cadmium toxicity in peanut plants in relation to cadmium distribution and stimulation of antioxidative enzymes[J].Plant Growth Regulation,2010,61(1):45-52.
[7] LUKA?OV Z,?VUBOV R,KOHANOV J,et al.Silicon mitigates the Cd toxicity in maize in relation to cadmium translocation,cell distribution,antioxidant enzymes stimulation and enhanced endodermal apoplasmic barrier development[J].Plant Growth Regulation,2013,70(1):89-103.
[8] HU Y L,GE Y,ZHANG C H,et al.Cadmium toxicity and translocation in rice seedlings are reduced by hydrogen peroxide pretreatment[J].Plant Growth Regulation,2009,59(1):51-61.
[9] BAI X,DONG Y,KONG J,et al.Effects of application of salicylic acid alleviates cadmium toxicity in perennial ryegrass[J].Plant Growth Regulation,2015,75(3):695-706.
[10] 蘇日娜,王丹.融合科学前沿和高新技术为一体的综合性科学技术——纳米材料与技术论坛侧记[J].中国材料进展,2016,35(10):726-727.
[11] 汪玉洁,陈日远,刘厚诚,等.纳米材料在农业上的应用及其对植物生长和发育的影响[J].植物生理学报,2017,53(6):933-942.
[12] 黄一帆.纳米二氧化锰吸附重金属铜、镉离子特性及安全性评价[D].北京:中国农业科学院,2016.
[13] 吕继涛,张淑贞.人工纳米材料与植物的相互作用:植物毒性、吸收和传输[J].化学进展,2013,25(1):156-163.
[14] 方馨.基于荧光碳纳米材料的生物分析新方法[D].无锡:江南大学,2016.
[15] 赵振杰,梁太波,陈千思,等.碳纳米材料对植物生长发育的调节作用[J].作物杂志,2017(2):7-13.
[16] SONG B,ZENG G,GONG J,et al.Effect of multi-walled carbon nanotubes on phytotoxicity of sediments contaminated by phenanthrene and cadmium[J].Chemosphere,2017,172:449-458.
[17] 史燕妮,李敏,陈师,等.碳量子点及其性能研究进展[J].高分子通报,2016(1):39-46.
[18] TRIPATHI S,SARKAR S.Influence of water soluble carbon dots on the growth of wheat plant[J].Applied Nanoscience,2015,5(5):609-616.
[19] 叶伟震.甜瓜染色体片段置换系的初步构建及种子相关性状QTL分析[D].哈尔滨:东北农业大学,2017.
[20] 张永平,沈若刚,姚雪琴,等.镉胁迫对甜瓜幼苗抗氧化酶活性和光合作用的影响[J].中国农学通报,2015,31(34):82-88.
[21] 雷振宏,魏晓艳,陈叶.镉胁迫对甜瓜种子萌发及幼苗生长的影响[J].农业灾害研究,2018,8(1):38-40.
[22] 白宝璋,金锦子,白崧,等.玉米根系活力TTC测定法的改良[J].玉米科学,1994,2(4):44-47.
[23] 郭胜伟,高云东.比色法测定中华芦荟叶片中叶绿素含量方法的研究[J].中华中医药学刊,2004,22(1):53.
[24] 陈芬.紫薯花青素提取工艺的研究[J].武汉职业技术学院学报,2015,14(5):97-100.
[25] 文瑛,廖飞勇,刘智慧.不同水分胁迫对黄枝槐生理特性的影响研究[J].中国农学通报,2012,28(13):47-52.
[26] 赵炀,李永生,高秀峰.基于愈创木酚荧光减量准确测定过氧化物酶活性的新方法[J].分析化学,2015,43(7):1040-1046.
[27] 张福平,陈蔚辉,谢莉丹,等.莲雾果实过氧化氢酶活性及其影响因素分析[J].南方农业学报,2014,45(1):94-97.
[28] 孙云,江春柳,赖钟雄,等.茶树鲜叶抗坏血酸过氧化物酶活性的变化规律及测定方法[J].热带作物学报,2008,29(5):562-566.
[29] 王慧忠,何翠屏,赵楠.镉对草坪植物生长特性及生物量的影响[J].草业科学,2003,20(5):32-34.
[30] LI W,ZHENG Y,ZHANG H,et al.Phytotoxicity,uptake,and translocation of fluorescent carbon dots in mung bean plants[J].Acs Appl Mater Interfaces,2016,8(31):19939-19945.
[31] 曾云龙,陈佳鑫,任婕凤,等.异相成核水热法制备碳量子点及用于去除水中重金属离子的方法:湖南,CN105435741A[P].2016-03-30.
[32] 刘阿梅.生物炭对植物生长发育及镉吸收的影响[D].湖南湘潭:湖南科技大学,2014.
[33] 黄运湘,廖柏寒,肖浪涛,等.镉处理对大豆幼苗生长及激素含量的影响[J].环境科学,2006,27(7):1398-1401.
[34] 吴恒梅,纪艳,姜成,等.重金属镉对丝瓜种子萌发及根系活力的影响[J].北方园艺,2012(11):38-40.
[35] 姜永雷,唐探,陈嘉裔,等.镉胁迫对水蕨幼苗叶绿素荧光参数和生理指标的影响[J].江苏农业科学,2015,43(9):357-360.
[36] 洪仁远,杨广笑,刘东华,等.镉对小麦幼苗的生长和生理生化反应的影响[J].华北农学报,1991,6(3):70-75.
[37] 陈小婕,阴文娅.植物中花青素提取方法探讨[J].食品工业科技,2013,34(2):395-399.
[38] 戴灵鹏,熊治廷,董新姣,等.满江红花青素在镉胁迫下的抗氧化作用[J].环境科学学报,2008,28(10):2089-2094.
[39] 陈贵,胡文玉,谢甫绨,等.提取植物体内MDA的溶剂及MDA作为衰老指标的探讨[J].植物生理学通讯,1991(1):44-46.
[40] 陈宏,徐秋曼,王葳,等.镉对小麦幼苗脂质过氧化和保护酶活性的影响[J].西北植物學报,2000,20(3):399-403.
[41] 杨舒贻,陈晓阳,惠文凯,等.逆境胁迫下植物抗氧化酶系统响应研究进展[J].福建农林大学学报(自然科学版),2016,45(5):481-489.
[42] 王建华,刘鸿先,徐同.超氧物歧化酶(SOD)在植物逆境和衰老生理中的作用[J].植物生理学通讯,1989(1):1-7.
[43] 王娟,李德全,谷令坤.不同抗旱性玉米幼苗根系抗氧化系统对水分胁迫的反应[J].西北植物学报,2002,22(2):77-82.
[44] 姜武,吴志刚,陈松林,等.镉胁迫对铁皮石斛叶片抗氧化酶活性的影响及动力学分析[J].浙江农业学报,2017,29(9):1421-1429.
[45] 段云青,王艳,雷焕贵.镉胁迫对小白菜POD、PPO和SOD活性的影响[J].河南农业科学,2006(7):88-91.
[46] 赵士诚,孙静文,马有志,等.镉对玉米幼苗活性氧代谢、超氧化物歧化酶和过氧化氢酶活性及其基因表达的影响[J].中国农业科学,2008,41(10):3025-3032.
[47] 范庆,吕秀军,杨柳,等.镉胁迫对矮牵牛种子萌发、幼苗生长及抗氧化酶活性的影响[J].植物研究,2010,30(6):685-691.

