一对虾养殖场的多病原跟踪*
武和英 王秀华 杨 冰 于党辉 黄 倢
一对虾养殖场的多病原跟踪*
武和英1,2王秀华2,3①杨 冰2,3于党辉2黄 倢2,3
(1. 上海海洋大学水产与生命学院 上海 201306;2. 中国水产科学研究院黄海水产研究所 农业农村部海水养殖病害防治重点实验室 青岛市海水养殖流行病学与生物安保重点实验室 青岛 266071;3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071)
本研究通过对一对虾养殖场定期采样,采用分子生物学鉴定方法,分别对对虾体内及水环境中弧菌(sp.)、虾肝肠胞虫(, EHP)及主要病毒性病原进行了跟踪检测,同时,检测了水环境中的氨氮及亚硝基氮含量的变化趋势。结果显示,该对虾养殖场中存在的主要病原为多种致病弧菌和EHP,未检测出对虾白斑综合征病毒(WSSV)、传染性肌肉坏死病毒(IMNV)、偷死野田村病毒(CMNV)及传染性皮下和造血组织坏死病毒(IHHNV);该养殖场中弧菌检出种类达到16种,其中,主要的弧菌种类有副溶血弧菌()溶藻弧菌 ()欧文氏弧菌()创伤弧菌()哈维氏弧菌(),且存在导致急性肝胰腺坏死病的副溶血弧菌(VPAHPND);养殖中期大棚养殖池水体氨氮及亚硝氮浓度分别达到(3.5±2.0)、(8.2±0.7) mg/L,显著高于室外养殖池水体氨氮及亚硝基氮浓度(<0.05)。养殖期跟踪的7个虾池中,出现严重对虾病害的大棚养殖池比例达到100%,而室外养殖池仅出现轻度对虾病害,发病池比例为25%。根据研究结果推测,造成大棚养殖池对虾发病死亡的主要原因为养殖对虾感染弧菌及虾肝肠胞虫,同时,养殖密度大、水体氨氮及亚硝基氮浓度过高等在对虾病害发生中起到了协同作用。本研究结果可为当前对虾养殖病害防控技术提供理论支持和科学依据。
凡纳滨对虾;病原;弧菌;虾肝肠胞虫;病毒病;病原跟踪
近年来,对虾病害给国内外对虾养殖业造成了巨大的损失,其特点表现为对虾发病期提前(Tran, 2013),病原种类繁多(韩琳等, 2018),虾病发生区域广(Lightner, 2012; Nunan, 2014; Soto-Rodriguez, 2015; 王博雅等, 2017; 陈禄芝等, 2016),且患病对虾死亡率高(Han, 2015; Hernández-Palomares, 2018)。研究发现,目前中国对虾养殖中主要存在的病毒性病原有白斑综合征病毒(White spot syndrome virus, WSSV) (Hernández-Palomares, 2018)、传染性皮下及造血组织坏死病毒(Infectious hypodermal and hematopoietic necrosis virus, IHHNV)(Yan, 2016; 李秋璇等, 2015)、传染性肌肉坏死病毒(Infectious myonecrosis virus,IMNV)(Kurcheti, 2017)及偷死野田村病毒(Covert mortality nodavirus, CMNV)(Zhang, 2017),最新报道还存在对虾黄头病毒(Sinnuengnong, 2018; 朱罗罗等, 2016)、对虾虹彩病毒(Qiu, 2017);细菌性疾病主要为急性肝胰腺坏死综合症(Hepatopancreatic necrosis disease, AHPND)(Han,2015;孙明玉等, 2018)和微孢子虫病原虾肝肠胞虫(,EHP)导致的虾肝肠胞虫病(Prasertsri, 2009)。
在对虾疾病防控方面,无论对虾种苗场还是养殖场都已采取了防控措施,减少对虾病原感染率、降低养殖水体中的病原数量,采用各种水质改良剂、微生态制剂改善水质,提高对虾抗病力(Warneke, 2011; 王春迪等, 2016),对虾病害发生率依然没有显著下降(王筱珊等, 2017;陈禄芝等, 2016; 王博雅等, 2017; 施慧等, 2017),且国内对虾养殖产量呈逐年下降趋势。
为查明当前对虾养殖中病害形成的原因,本研究选择山东潍坊沿海1个具备大棚养殖池、室外养殖池的凡纳滨对虾()养殖场作为虾病调查研究的采样点,采取定期取样的方法,跟踪监测了对虾及水体中的主要病原的种类数量,水中氨氮及亚硝基氮浓度的变化及对虾病害发生情况,以期通过分析养殖场的对虾疾病感染过程、发病特点,找出患病死亡的原因,为对虾养殖的疾病防控提供理论依据与技术支持。
1 材料与方法
1.1 养殖场基本资料收集
1.1.1 养殖场基本情况 对虾养殖场位于山东省潍坊市北部近海的内陆盐碱地区域,养殖用水为近海河口区水源。养殖场现有水面13.8 hm2,其中,养殖用室外池塘30个(小型池塘12个,每个面积为0.2 hm2;中型池塘18个,每个面积为0.3 hm2);大棚养虾池4个(小型棚2个,每个0.1 hm2;大型棚 2个,每个0.5 hm2)。另有大型池塘6个,每个面积为0.8 hm2,用于水处理。室外养殖池平均有效水深为1.6 m,大棚养殖池平均有效水深为1.4 m。从其中随机抽取池塘7个为跟踪取样虾池,池塘编号、面积、放苗时间及密度等信息见表1。
表1 养殖池的基本情况
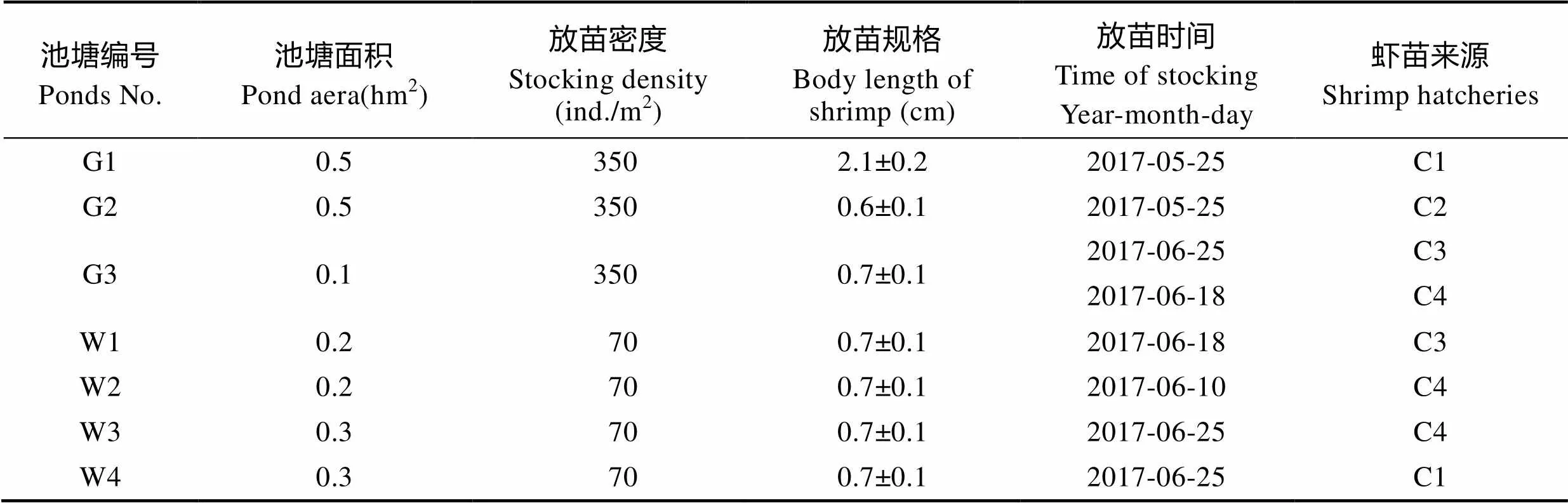
Tab.1 Basic information of the shrimp ponds
注:C1~C4:育苗场;G1~G3:大棚养殖池;W1~W4:室外养殖池
Note: C1~C4: Shrimp hatcheries; G1~G3: Indoor ponds; W1~W4: Outdoor ponds
1.1.2 养殖管理 养殖用水先经漂白粉(30 mg/L)处理,再曝气脱氯后使用,养殖期间,水体盐度为11±3.6,pH为7.8~8.5,大棚养殖池水温为26.2℃~ 32.5℃,室外养殖池水温为23℃~28.5℃。大棚养殖池配备底部增氧管(3 W/m2)及水车式增氧机(1.5 W/m2),室外养殖池配备水车式增氧机(1.5 W/m2)。在养殖期间,室外养殖池水体中的DO>5 mg/L,大棚养殖池水体DO>4 mg/L。养殖投喂人工配合饵料,虾苗体长为3 cm以前,日投喂 6次,日投饵量为对虾体重的5%;3 cm后,日投喂4次,日投饵量为对虾体重的3%。大棚养殖池日换水量为(20±5)%,外塘养殖池每10 d换水1次,每次20%。
1.1.3 数据采集 自放苗开始,每20 d跟踪检测虾池及进水渠的水质指标(温度、盐度、pH、DO、氨氮、亚硝氮)的变化情况,采集水样、对虾样品进行细菌分离鉴定、病原检测,并观察记录对虾发病症状。
1.2 样品采集及处理
1.2.1 水样采集 用无菌瓶于换水前,在每个采样池中取水样100 ml,低温带回实验室,用于氨氮及亚硝基氮分析。
1.2.2 细菌分离 从养殖场水源和养殖池水体中分别取100 μl的水样,灭菌海水10倍梯度稀释,无菌状态下涂布2216E和TCBS固体培养基;无菌取对虾肠道及肝胰腺混合研磨后,用生理盐水10倍梯度稀释,分别涂布2216E和TCBS的固体培养基,于28℃恒温培养箱内培养24 h。
1.2.3 病原检测样品采集 每个池塘每次取对虾30尾,鳃丝、步足、肌肉及肝胰腺样品合并为 1个独立样品,放入95%的乙醇中保存带回实验室,用TIANGEN试剂盒(TIANamp Marine Animals DNA Kit)提取样品全基因组DNA,-80℃保存备用;用RNAiso Plus (TaKaRa)提取样品总RNA,-80℃保存备用。
1.3 可培养细菌分析及弧菌的占有率
1.3.1 可培养细菌的分离鉴定 取接种培养后的2216E平板,根据细菌的形态、大小、颜色等进行分离纯化。用细菌16S rDNA序列扩增方法对所分离的细菌进行初步鉴定(Bikrol,2010),扩增产物委托生工生物工程(上海)股份有限公司分析,所得序列在NCBI数据库中进行同源性比对。
1.3.2 水体中可培养细菌数及总弧菌数评估 根据某水样在一定稀释度下涂布2216E平板形成的菌落数,推算该原始水样每毫升中的总细菌数为单位水体中可培养细菌数;根据某水样在一定稀释度下涂布TCBS平板形成的菌落数,推算该原始水样总弧菌数量,单位为CFU/ml。
1.3.3 某种弧菌占有率 根据TCBS平板所分离弧菌的菌落数、鉴定结果及样品稀释度,分别统计大棚养殖池和室外养殖池中各种弧菌(sp.)的数量。弧菌占有率=单位水体中某种弧菌数量/单位水体中可培养细菌数×100%。
1.4 对虾多病原检测
EHP及AHPND的检测方法分别参照Jaroenlak等(2016)和Dangtip等(2015)的方法;WSSV、IHHNV及IMNV的检测采用国际兽疫局(Office Interna- tional des Epizooties, OIE 2016)推荐的检测方法,CMNV检测参照Zhang等(2014)的方法。其中,WSSV、IMNV及CMNV均为套式PCR,IHHNV采用常规PCR 2对物检测。
1.5 水质指标检测
使用YSI556便携式水质测定仪(Xylem, 美国),每个取样日的09:00测量养殖池水体温度、盐度、溶解氧和pH。水体中氨氮和亚硝基氮的浓度测定分别采用靛酚蓝分光光度法(GB17378.4-2007)和萘乙二胺分光光度法(GB17378.4-2007)。
1.6 数据分析
实验结果用平均值±标准差(X±SD,=3)表示,运用SPSS 18.0软件,经单因素方差分析(One-way ANOVA),采用Duncan’s多重检验分析实验结果的差异显著性,设置差异水平=0.05 (<0.05为差异显著)。
2 结果
2.1 对虾生长及病害发生情况
观察各采样池塘中的对虾发病情况,记录发病时间,各虾池病症初次发生时间见表2。该养殖场大棚虾池在发病前10 d已表现出摄食减少、生长缓慢的症状,之后陆续出现对虾不摄食、空肠空胃、肠道细、趴边,末期对虾腹部和尾节变白,1周后出现死亡,且死亡率升高,最后出池;G2对虾症状与死亡情况与G1完全相似,相应的症状出现的时间仅较G1池晚4 d左右;G3的对虾发病较为迅速,症状表现为对虾不摄食,空肠空胃,发病1周后,对虾死亡率近50%,消毒排塘。根据对虾的发病特点及检测结果,初步判定大棚养殖池中的对虾发病为弧菌与虾肝肠胞虫混合感染所致,且与水体中氨氮、亚硝氮浓度过高有关;室外养殖池整个养殖周期发病较轻,个别池塘在养殖后期出现一定的发病症状,表现为对虾趴边,空肠空胃,但数量较少,跟踪的4个室外养殖池中,仅W1在9月25日出现病症,死亡率极低,因为已到收获季节,采取了收虾处理。
表2 各池对虾发病情况
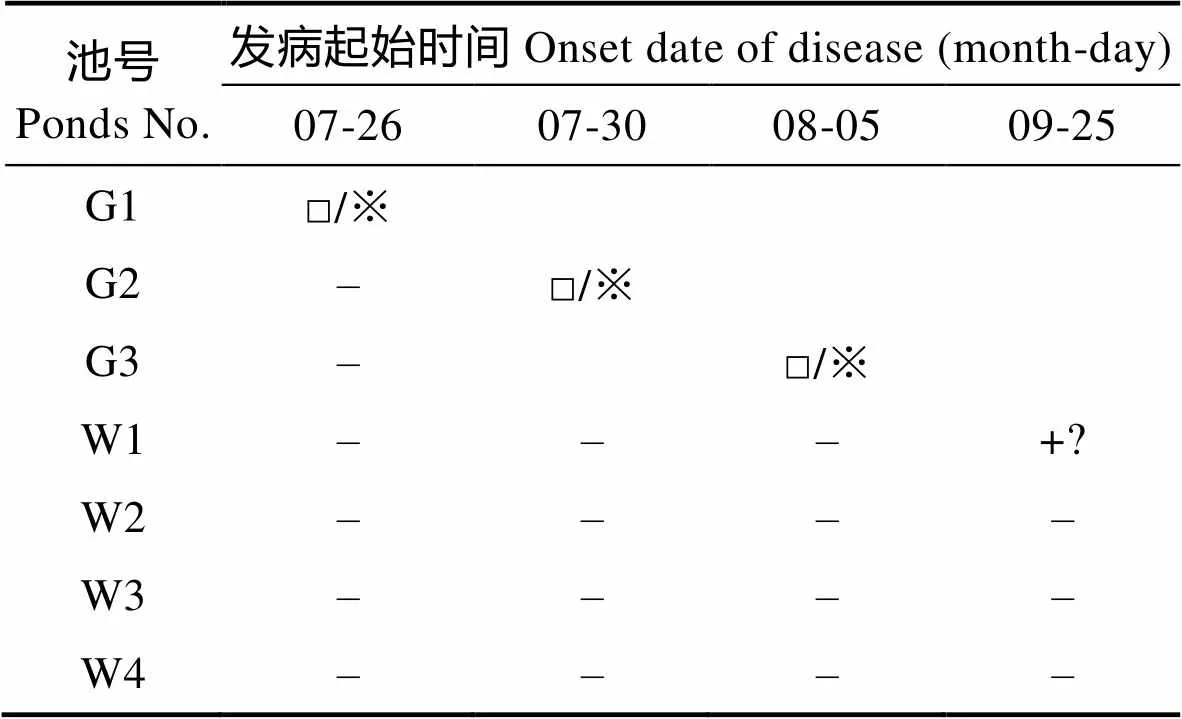
Tab.2 Occurrence of shrimp disease in different ponds
注:□/※:对虾发病出现死亡,检测确认感染弧菌及肠胞虫;–:对虾正常;+?:对虾发病但没有检测
Note: □/※: Shrimp infected by AHPND and EHP in the same time and appeared death; –: Shrimp is normal; +?: Dead shrimp appeared but without detection
2.2 整个检测期养殖水体及对虾体内可培养细菌组成
整个检测期间,共分离单菌落305个,对所分离的细菌进行初步鉴定,共成功鉴定细菌258株,其中,养殖水体中164株,对虾体内94株。比对结果显示,养殖水体中164株菌中含有菌株49种,对虾体内有菌株31种,对虾体内和水体主要细菌组成见表3。由表3可知,养殖水体中菌群种类比对虾体内的种类多。
表3 对虾体内和养殖水体中的菌群组成

Tab.3 Component of predominant bacterial communities isolated from shrimp and water

续表3
2.3 不同养殖期大棚养殖池与室外养殖池中总弧菌密度
分别统计不同采样时间所有跟踪的大棚及室外养殖池中弧菌平均数量(图1)。由图1可知,经过漂白粉处理后,再经过脱氯曝气的水,进入养殖池后其内的弧菌数量在10 CFU/ml左右,随着养殖时间的增长,无论室外养殖池还是大棚养殖池,水体中的弧菌数量都持续增多。且在各个采样时间内大棚养殖池中的弧菌数量均高于室外养殖池,至最后一次采样(8月13日),大棚养殖池中弧菌的平均密度达到了(3.7±0.9)´104CFU/ml;而室外养殖池仅为(6.3±4.0)´102CFU/ml。
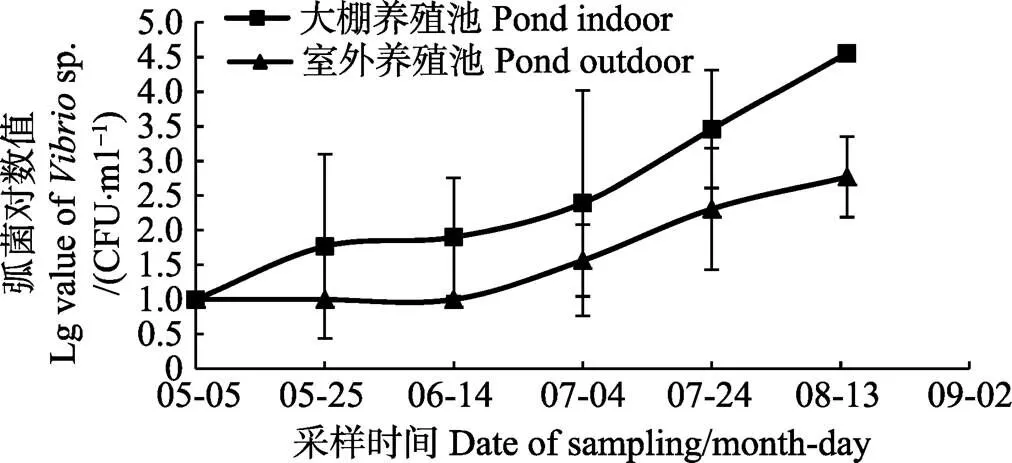
图1 大棚养殖池及室外养殖池中弧菌数量的变化趋势
2.4 室外养殖池与大棚养殖池中不同采样时间内水体中主要弧菌种类占有率
分别统计大棚和室外养殖池养殖水体不同采样时间各种弧菌的占有率(图2和图3)。由图2和图3可知,无论大棚养殖池还是室外养殖池,均存在副溶血弧菌溶藻弧菌欧文氏弧菌、创伤弧菌、哈维氏弧菌。大棚养殖池中,各种弧菌于6月14日前的占有率变化不大,之后,水体中的副溶血弧菌占有率持续升高,至采样末期达到了56.5%;室外养殖池养殖水体中7月4日之前,各种弧菌占有率均较低(13%以下),随后,副溶血弧菌的占有率快速上升,至采样末期达21.4%。

图2 不同采样时间内大棚养殖水体中5种主要弧菌的占有率

图3 不同采样时间内外塘养殖水体中5种主要弧菌的占有率
2.5 EHP的检测结果
所跟踪的养殖池中,对虾感染EHP的检测结果见表4。由表4可知,养殖场于6月14日首次检出EHP,出现在大棚养殖池G1,另外2个大棚养殖池分别于7月4日与24日检出EHP。所有的4个外塘池仅在最后一次取样时,有3个池中检出EHP。代表性EHP检测结果见图4。
表4 EHP检测结果
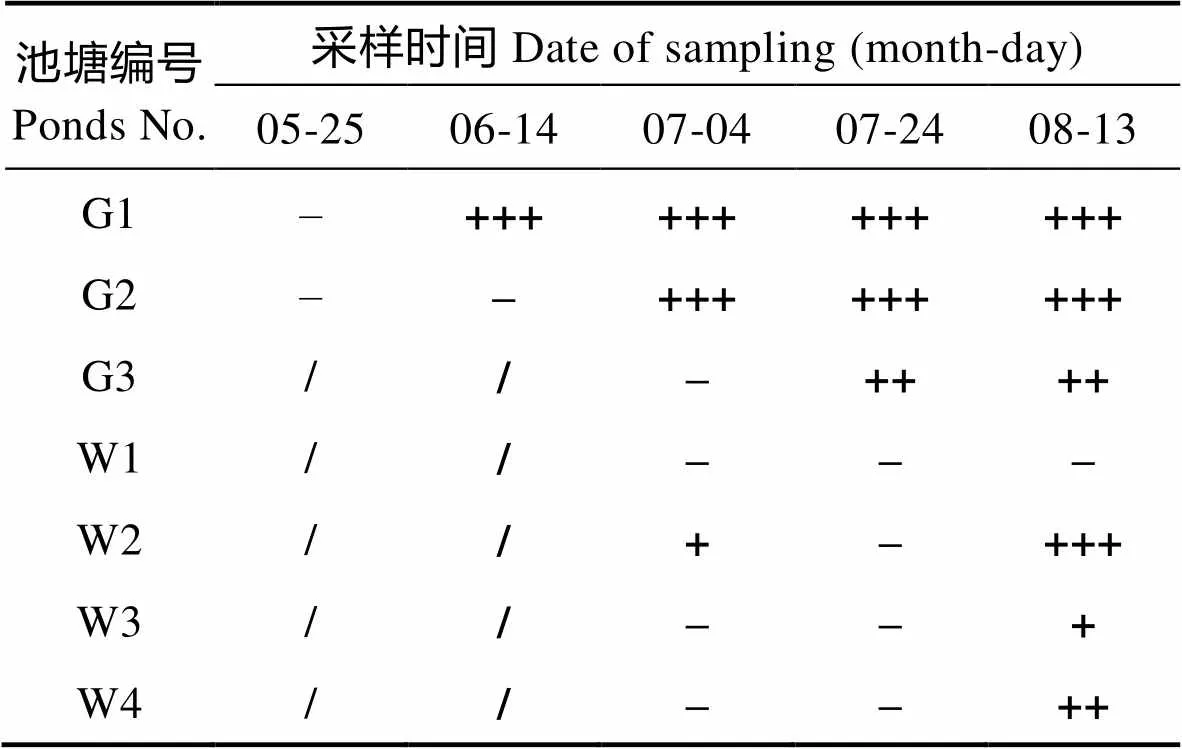
Tab.4 Detection results of EHP
注:G1~G3:大棚养殖池;W1~W4:室外养殖池; +:弱阳性;++:阳性;+++:强阳性;–:阴性;/:未放苗。下同
Note: G1~G3: Ponds indoor; W1~W4: Ponds outdoor; +: Weak positive; ++: Positive;+++: Strong positive; – : Negative; / : Not stocking. The same as below
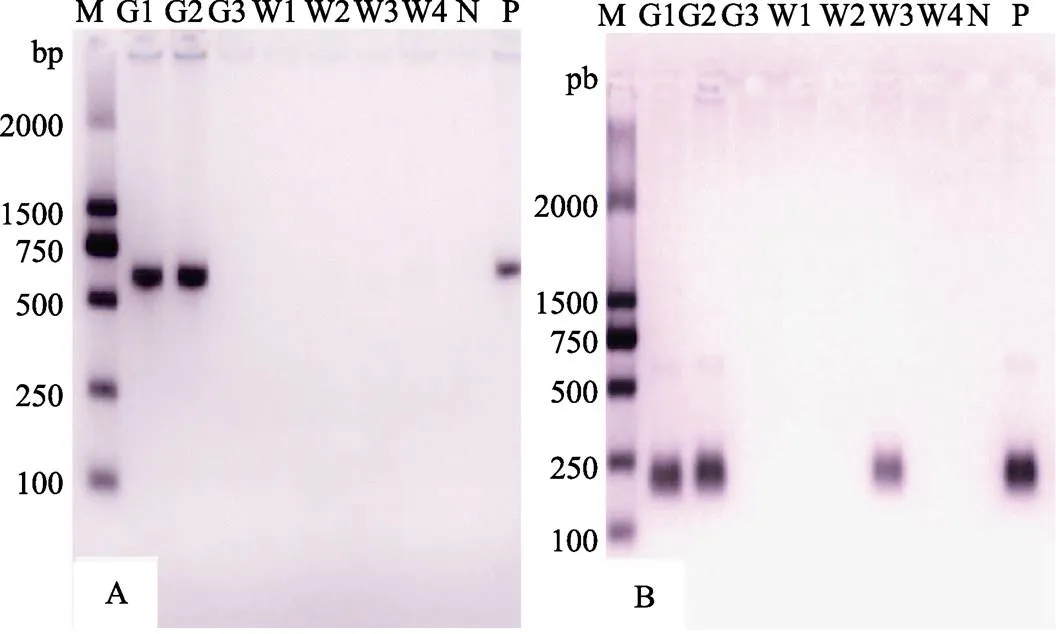
图4 7月4日各池样品EHP PCR扩增产物
A:第1轮PCR产物;B:第2轮PCR产物;M:DL2000 DNA分子标准;G1~G3:大棚养殖池;W1~W4:室外养殖池;N:阴性对照;P:阳性对照。下同
A: PCR products of first round; B: PCR products of second round; M: DL2000 DNA marker; G1~G3: Ponds indoor; W1~W4: Ponds outdoor; N: Negative control; P: Positive control. The same as below
2.6 AHPND检测结果
AHPND跟踪监测的结果见表5。由表5可知,在7月4日检测时,所有检测池中的对虾AHPND均为阴性,至7月24日,除了室外养殖池W4外,均检出AHPND;8月13日检测显示,所用跟踪的养殖池中的对虾均有AHPND检出。代表性AHPND检测结果见图5。
表5 AHPND检测结果
Tab.5 Test results of AHPND
2.7 WSSV、IHHNV、CMNV、IMNV的检测结果
对各采样期对虾样品进行PCR扩增,检测WSSV、IHHNV、CMNV、IMNV 4种对虾病毒,均未有出现阳性条带,部分代表性PCR结果分别见图6。说明该养殖场养殖凡纳滨对虾感染这4种病原的几率很低。

图5 7月24日各池样品AHPND PCR扩增产物
2.8 养殖水体中NH4+-N及NO2–-N的浓度变化
检测各期大棚养殖池及室外养殖池水体中NH4+-N及NO2–-N平均浓度,结果分别见图7、图8。在大棚养殖池中,无论NH4+-N还是NO2–-N,其变化的幅度较大,而室外养殖池中,变化相对平稳。NH4+-N的最高值出现在7月上旬的大棚养殖池中,平均浓度达到(3.5±2.0) mg/L,而NO2–-N浓度在养殖中后期的大棚养殖池中持续提高,至8月14日,平均浓度已达到(8.2±0.7) mg/ml。
3 讨论
近几年来,国内外养殖的凡纳滨对虾病害发生较为普遍,导致养殖产量降低,效益下滑,而对虾病原的多样化给对虾病害防控带来了较大的难度。特别是EHP的暴发流行,给产业带来的冲击较大。EHP是一种细胞内寄生虫,首次发现于泰国(Tourtip, 2009)。近年来,在中国养殖的日本囊对虾()、凡纳滨对虾以及罗氏沼虾()中也有检出(刘珍等, 2016),对虾感染EHP后可导致生长迟缓(Rajendran,, 2016; Chayaburakul,, 2004)。Aranguren等(2017)研究表明,对虾感染EHP后,易受敏感性细菌的侵染。本研究结果表明,所跟踪的养殖场,随着养殖过程的持续,EHP病原存在扩散的可能,最初的EHP发现于大棚养殖池中,至养殖末期,除了W1外,其他所有跟踪的池塘中均检出EHP感染。尽管该养殖场的养殖用水采用漂白粉消毒处理,但由于该养殖场进排水采用同一条水渠,对养殖废水并没有进行消毒处理,为病原扩散提供了条件。
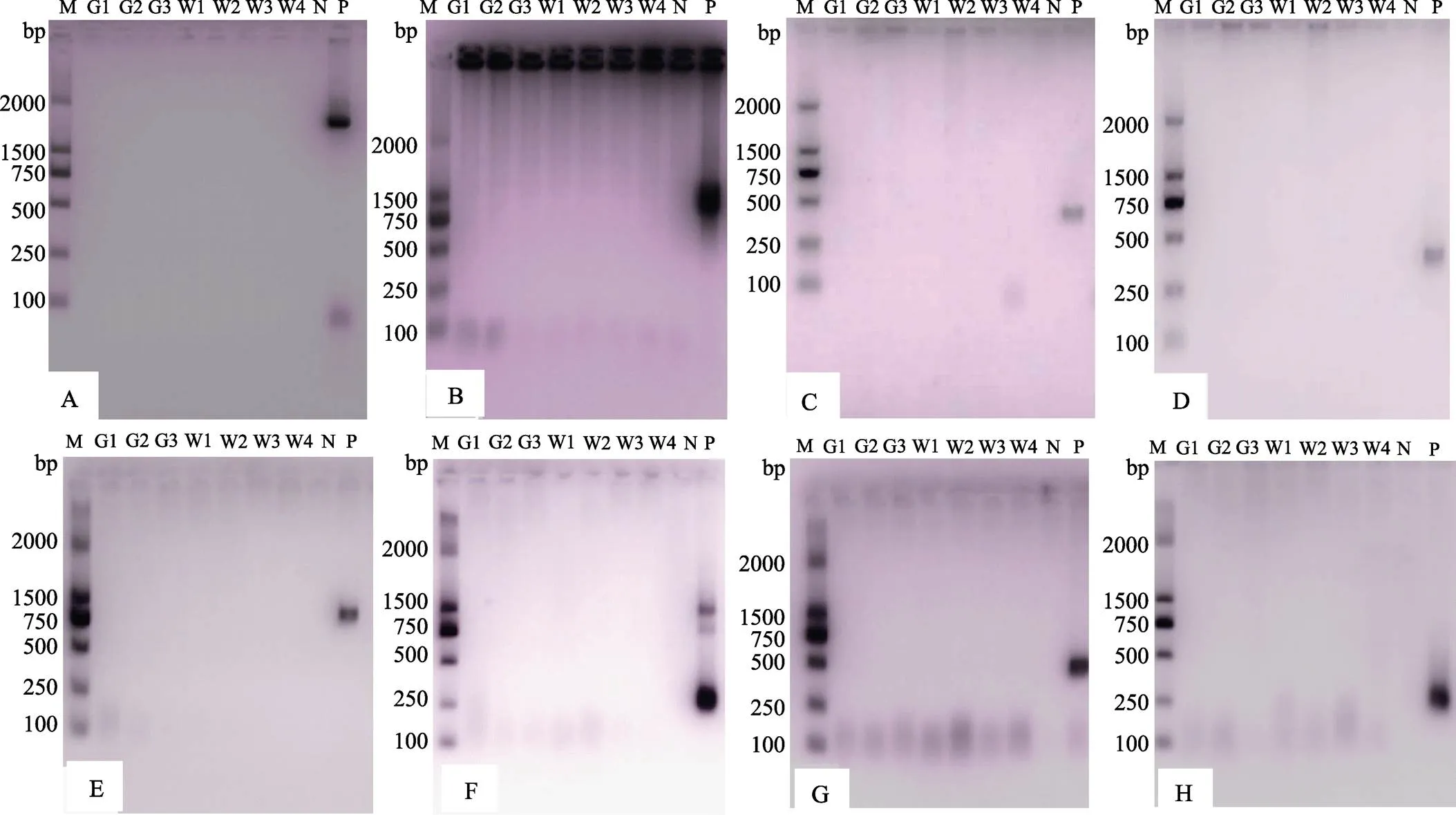
图6 8月13日各池样品WSSV、IHHNV、CMNC及IMNV 4种对虾病毒PCR扩增产物
A、B分别为WSSV第1轮及第2轮PCR产物;C、D分别为引物389F/389R及309F/309R检测IHHNV PCR产物;E、F分别为CMNV第1轮及第2轮PCR产物,G、H分别为IMNV第1轮及第2轮PCR产物
A: First round PCR products for WSSV; B: Second round PCR products for WSSV; C: PCR products for IHHNV by primer 389F/389R; D: PCR products for IHHNV by primer309F/309R; E: First round PCR products for CMNV; F: Second round PCR products for CMNV; G: First round PCR products for IMNV, H: Second round PCR products for IMNV

图7 对虾养殖水体中NH4+-N浓度的变化趋势
早期的研究发现,对虾AHPND的发生与感染含有PirA及PirB质粒的副溶血弧菌有关(Lee,, 2015; Tran,, 2013; 孙明玉等, 2018),最近研究表明,对虾感染坎氏弧菌(Han, 2017)、哈维氏弧菌(Kondo, 2015)后也表现出AHPND症状。本研究跟踪检测AHPND的结果显示,在养殖前期(7月4日前)养殖场中并未检测出该病菌,但在7月24日后,几乎在所有跟踪的养殖池中检测到了AHPND的弱阳性信号,且持续到末期感染均为弱阳性,结合养殖对虾发病特点及其他弧菌的检测结果认为,该养殖场中对虾存在诱发AHPND的副溶血弧菌,特别是在大棚养殖池中,但副溶血弧菌并不是唯一导致对虾发病的因素,因在养殖水体中及对虾体内也检测出其他的致病弧菌,如溶藻弧菌、欧文氏弧菌、创伤弧菌和哈维氏弧菌,对该类弧菌的致病力评估尚待研究。
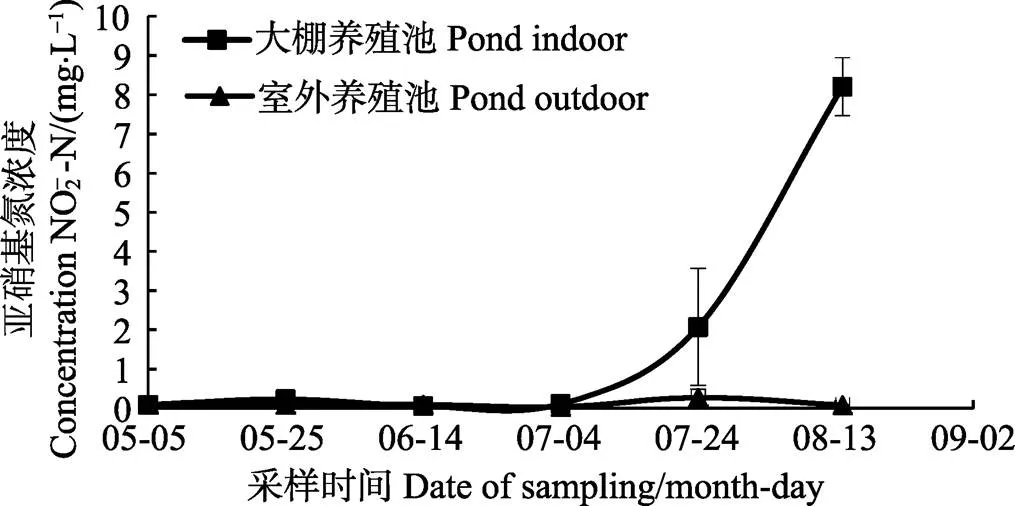
图8 对虾养殖水体中NO2--N浓度的变化趋势
在跟踪的7个养殖池中,出现明显病害的3个池塘均为大棚养殖池,尽管所放的对虾种苗来源及养殖用水与室外养殖池相似,因大棚养殖池投苗密度是室外养殖池的5倍,相应的饵料投喂量也远高于室外养殖池,由此可导致水体中氨氮及亚硝基氮的浓度在养殖中后期出现超标现象(图4、图5),达到了危害对虾的范围(魏俊利等, 2012)。表明,大棚养殖池中水质管理存在欠缺,导致养殖废物排放不彻底,水质变差。已有研究表明,较高的氨氮浓度能降低凡纳滨对虾的抵抗力(黄翔鹄等, 2006),增加对副溶血弧菌的易感性(葛红星等, 2014)。
综合分析本研究所检测的各种对虾病原及养殖环境条件认为,该凡纳滨对虾养殖场存在多种对虾病原,其中,多种弧菌与EHP共感染是导致大棚养殖对虾发病的原因之一。结合大棚养殖池与室外养殖池的发病特点,可以推断,大棚养殖池中因放养密度高,水质管理不善,氨氮及亚硝基氮浓度过高,是导致大棚养殖池对虾发病的主要因素。本研究跟踪调查的WSSV、IHHNV、IMNV、CMNV 4种对虾病毒,是近年来在凡纳滨对虾养殖中危害较为严重的病原,但是,在本场并没有阳性样品检出,表明这些病毒性病原不是该对虾养殖场的致病因子。提示在未来的对虾养殖中,对EHP、细菌病的防控及水环境管理也应引起高度的重视。
Aranguren LF, Han JE, Tang KFJ,.(EHP) is a risk factor for acute hepatopancreatic necrosis disease (AHPND) and septic hepatopancreatic necrosis (SHPN) in the Pacific white shrimp. Aquaculture, 2017, 471: 37–42
Bikrol A, Saxena N, Singh K. Characterization ofstrains isolated from different varieties of soybean with 16SrDNA RFLP from agricultural land of Madhya Pradesh, India. Indian Journal of Microbiology, 2010, 50(4): 404–411
Chayaburakul K, Nash G, Pratanpipat P,. Multiple pathogens found in growth-retarded black tiger shrimpcultivated in Thailand. Diseases of Aquatic Organisms, 2004, 60(2): 89–96
Chen LZ, Yu XY, Hu YC,. Preliminary investigation of Enterocytozoon hepatopenaei (EHP) and infectious hypodermal and hematopoietic necrosis virus (IHHNV) fromin west Guangdong Province. Journal of Fisheries Research, 2016, 38(4): 273–280 [陈禄芝, 余霞艳, 胡一丞, 等. 粤西地区凡纳滨对虾虾肝肠胞虫、传染性皮下和造血组织坏死病毒感染情况的初步调查. 渔业研究, 2016, 38(4): 273–280]
Dangtip S, Sirikharin R, Sanguanrut P,. AP4 method for two-tube nested PCR detection of AHPND isolates of. Aquaculture Reports, 2015, 2: 158–162
Ge HX, Li J, Chen P. The Immune Response ofand its susceptibility tounder stress caused by ammonia nitrogen at different concentrations. Progress in Fishery Sciences, 2014, 35(6): 76–82 [葛红星, 李健, 陈萍, 等. 氨氮胁迫下凡纳滨对虾对副溶血弧菌的易感性. 渔业科学进展, 2014, 35(6): 76–82]
Han JE, Tang KF, Aranguren LF,. Characterization and pathogenicity of acute hepatopancreatic necrosis disease natural mutants,ABvp(−), andABvp(+)strains. Aquaculture, 2017, 470: 84–90
Han JE, Tang KFJ, Pantoja CR,qPCR assay for detecting and quantifying a virulence plasmid in acute hepatopancreatic necrosis disease (AHPND) due to pathogenic. Aquaculture, 2015, 442: 12–15
Han L, Wang XH, Yang B,. Analysis of pathogen in an outbreak death of. Journal of Fisheries of China, 2018, 42(3): 431–441 [韩琳, 王秀华, 杨冰, 等. 一例日本囊对虾暴发性死亡的病原分析. 水产学报, 2018, 42(3): 431–441]
Hernández-Palomares MLE, Godoy-Lugo JA, Gómez-Jiménez S,. Regulation of lactate dehydrogenase in response to WSSV infection in the shrimp. Fish and Shellfish Immunology, 2018, 74: 401–409
Huang XH, Li CL, Deng L. The toxicity of NO2-N onand effects of NO2-N on factors relating to the anti-disease ability. Acta Hydrobiologica Sinica, 2006, 30(4): 466–471 [黄翔鹄, 李长玲, 郑莲, 等. 亚硝酸盐氮对凡纳滨对虾毒性和抗病相关因子影响. 水生生物学报. 2006, 30(4): 466–471]
Jaroenlak P, Sanguanrut P, Williams BA,. A nested PCR assay to avoid false positive detection of the microsporidian(EHP) in environmental samples in shrimp farms. PLoS ONE, 2016, 11(11): e0166320
Kondo H, Van PT, Dang LT,. Draft genome sequence of non-acute hepatopancreatic necrosis disease strain KC13.17.5, isolated from diseased shrimp in Vietnam. Genome Announcement, 2015, 3(5): e00978-15
Kurcheti PP, Shyam KU, Banu H,. Infectious myonecrosis virus (IMNV)–An alarming viral pathogen to Penaeid shrimps. Aquaculture. 2017, 477: 99–105
Lee CT, Chen IT, Yang YT,. The opportunistic marine pathogenbecomes virulent by acquiring a plasmid that expresses a deadly toxin. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(34): 10798–10803
Li QX, Fei RM. The prokaryotic expression for ORF3 gene of infections hypodermal and hematopoietic necrosis virus NJ strain and its bioinformatics analysis. Journal of Fisheries of China, 2015, 39(3): 439–446 [李秋璇, 费荣梅. 传染性皮下及造血组织坏死病毒NJ株ORF3基因的原核表达及生物信息学分析. 水产学报, 2015, 39(3): 439–446]
Lightner DV, Redman RM, Pantoja CR,. Early mortality syndrome affects shrimp in Asia. Global Aquaculture Advocate, 2012, 15(1): 40
Liu Z, Zhang QL, Wan XY,. Development of real-time PCR assay for detecting microsporidianand the application in shrimp samples with different growth rates. Progress in Fishery Sciences, 2016, 37(2): 119–126 [刘珍, 张庆利, 万晓媛, 等. 虾肝肠胞虫()实时荧光定量PCR检测方法的建立及对虾样品的检测. 渔业科学进展, 2016, 37(2): 119–126]
Nunan L, Lightner D, Pantoja C,. Detection of acute hepatopancreatic necrosis disease (AHPND) in Mexico. Diseases of Aquatic Organisms, 2014, 111(1): 81–86
Prasertsri S, Limsuwan C, Chuchird N. The effects of microsporidian () infection on the growth and histopathological changes in pondreared Pacific white shrimp (). Kasetsart Journal-Natural Science, 2009, 43: 680–668
Qiu L, Chen MM, Wan XY,. Characterization of a new member of, shrimp hemocyte iridescent virus (SHIV), found in white leg shrimp (). Scientific Reports, 2017, 7(1): 11834
Rajendran KV, Shivam S, Praveena EP,. Emergence of(EHP) in farmed()in India. Aquaculture, 2016, 454: 272–280
Shi H, Xu WJ, Xie JJ,. Pathogenicity ofslow growth syndrome in intensively cultured penaeid shrimp in Zhoushan. Journal of Fishery Sciences of China, 2017, 24(2): 387–394 [施慧, 许文军, 谢建军, 等. 舟山地区大棚凡纳滨对虾生长缓慢病因的调查分析. 中国水产科学, 2017, 24(2): 387–394]
Sinnuengnong R, Attasart P, Smith DR,. Administration of co-expresseddensovirus-like particles and dsRNA-YHV-Pro provide protection against yellow head virus in shrimp. Journal of Biotechnology, 2018, 267: 63–70
Soto-Rodriguez SA, Gomez-Gil B, Lozano-Olvera R,. Field and experimental evidence ofas the causative agent of acute hepatopancreatic necrosis disease of cultured shrimp () in Northwestern Mexico. Applied and Environmental Microbiology, 2015, 81(5): 1689–1699
Sun MY, Feng B, Zhang ZH,. New sequence type isolates of AHPND-causingfromby multilocus sequence typing. Journal of Fisheries of China, 2018, 42(3) 410–418 [孙明玉, 冯博, 张昭寰, 等. 引起凡纳滨对虾急性肝胰腺坏死病的副溶血弧菌MLST新序列型. 水产学报, 2018, 42(3): 410–418]
Tourtip S, Wongtripop S, Stentiford GD,.sp. nov. (Microsporida: Enterocytozoonidae), a parasite of the black tiger shrimp(Decapoda: Penaeidae): Fine structure and phylogenetic relationships. Journal of Invertebrate Pathology, 2009, 102(1): 21–29
Tran L, Nunan L, Redman RM,. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp. Diseases of Aquatic Organisms, 2013, 105(1): 45–55
Wang BY, Wang L, Liu MR,. Epidemiological investigation of three major viruses and(EHP) in Pacific white leg shrimpin Liaoning Province. Journal of Dalian Fisheries University, 2017, 32(2): 150–154 [王博雅, 王力, 刘美如, 等. 凡纳滨对虾3种主要病毒和虾肝肠胞虫在辽宁地区的流行情况分析. 大连海洋大学学报, 2017, 32(2): 150–154]
Wang CD, Song XL, Zhang XJ,. Effects of addingPC465 to rearing water on disease resistance of. Journal of Fishery Sciences of China, 2016, 23(1): 146–155 [王春迪, 宋晓玲, 张晓静, 等. 养殖水体中添加蜡样芽孢杆菌PC465对凡纳滨对虾抗病力的影响. 中国水产科学, 2016, 23(1): 146–155]
Wang XS, Hu ZB, Fei RM. Prevalence of three viruses in Pacific white leg shrimp in Jiangsu Province and the analysis of coding sequence of five strains of infectious hypodermal and hematopoietic necrosis virus. Journal of Fisheries of China, 2017, 41(10): 1623–1630 [王筱珊, 胡智博, 费荣梅. 江苏地区对虾3种病毒病的流行病学调查及5株IHHNV的编码区基因序列分析. 水产学报, 2017, 41(10): 1623–1630]
Warneke S, Schipper LA, Bruesewitz DA,. Rates, controls and potential adverse effects of nitrate removal in a denitrification bed. Ecological Engineering, 2011, 37(3): 511–522
Wei JL, Sun JS, Li X,Acute toxic effects of ammonia nitrogen on. Journal of Tianjin Agricultural University, 2012, 19(3): 58–61 [魏俊利, 孙金生, 李翔, 等. 氨氮对凡纳滨对虾稚虾的急性毒性作用. 天津农学院学报, 2012, 19(3): 58–61]
World Organization for Animal Health (OIE). Manual of diagnostic tests for aquatic animals 2016. Paris, French: World Organization for Animal Health, 2010, 110–186
Yan DC, Huang J, Yang B,. Competition of infectious hypodermal and haematopoietic necrosis virus (IHHNV) with white spot syndrome virus (WSSV) for binding to shrimp cellular membrane. Journal of Fish Diseases, 2016, 39(10): 1225–1229
Zhang QL, Liu Q, Liu S,. A new nodavirus is associated with covert mortality disease of shrimp. Journal of General Virology, 2014, 95(12): 2700–2709
Zhang QL, Xu TT, Wan XY,. Prevalence and distribution of covert mortality nodavirus (CMNV) in cultured crustacean. Virus Research, 2017, 233: 113–119
Zhu LL, Zhang QL, Wan XY,. Molecular epidemiology of a new yellow head virus strain in China. Progress in Fishery Sciences, 2016, 37(3): 68–77 [朱罗罗, 张庆利, 万晓媛, 等. 我国一株新型黄头病毒的分子流行病学. 渔业科学进展, 2016, 37(3): 68–77]
Tracking of Shrimp Multiple Pathogens in a Shrimp Farm
WU Heying1,2, WANG Xiuhua2,3①, YANG Bing2,3, YU Danghui2, HUANG Jie2,3
(1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306; 2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs; Qingdao Key Laboratory of Mariculture Epidemiology and Biosecurity, Qingdao 266071; 3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071)
In order to clarify the shrimp disease occurred currently in the shrimp farms, shrimp pathogens including vibrio,(EHP) and four viral pathogens(WSSV、IMNV、CMNV and IHHNV) were detected using molecular biological detect methods under a regular sampling pattern, meanwhile the concentration of ammonia nitrogen and nitrogenous nitrogen in water body were also detected. The results showed that the main pathogens in the shrimp farm comprised various pathogenic vibrio and EHP. However the shrimp virus WSSV、IMNV、CMNV and IHHNV were not detected. The vibrio species isolated and identified reached 16 totally, and the main species were,,,. Furthermore thethat could cause acute hepatopancreatic necrosis disease (VAHPND) was found out. The concentration of ammonia nitrogen and nitrate nitrogen in the indoor pond reaching (3.5±2.0) mg/L and (8.2±0.7) mg/L, were significantly higher than that in the outdoor pond respectively (< 0.05) in the medium-term (July 24) of crop cycle. The intensity of infection of VAHPNDand EHP show a growing trend in the culture period. In the seven ponds monitored, the ponds indoor had a higher incidence rate (100%), while the ponds outdoor had a lower incidence rate (25%). The results indicated that shrimp disease onset in the pond indoor might be caused by the infection of various vibrio and EHP, also the higher stocking density, higher concentration of the ammonia nitrogen and nitrate nitrogen in the water body played a synergy role in outbreak of shrimp disease. The results of this study could provide theoretical support and scientific data for the prevention and control of shrimp diseases.
; Pathogen;;(EHP); Viral pathogens; Pathogen tracking
WANG Xiuhua, E-mail: wangxh@ysfri.ac.cn
S945.1
A
2095-9869(2019)04-0104-11
10.19663/j.issn2095-9869.20180518002
* 广西创新驱动发展专项(桂科AA17204044)和中国水产科学研究院黄海水产研究所基本科研业务费(20603022018001)共同资助[This work was supported by Guangxi Innovation-Driven Development Project (AA17204044), and Central Public- Interest Scientific Institution Basal Research Fund, YSFRI, CAFS(20603022018001)]. 武和英,E-mail: 1450847915@qq.com
王秀华,研究员,E-mail: wangxh@ysfri.ac.cn
2018-05-18,
2018-05-30
武和英, 王秀华, 杨冰, 于党辉, 黄倢. 一对虾养殖场的多病原跟踪. 渔业科学进展, 2019, 40(4): 104–114
Wu HY, Wang XH, Yang B, Yu DH, Huang J. Tracking of shrimp multiple pathogens in a shrimp farm. Progress in Fishery Sciences, 2019, 40(4): 104–114
(编辑 马璀艳)

