噪声习服对豚鼠急性声损伤的听力保护作用及机理
杨媛媛胡洪义 陈伟 冀飞 李小玲钟家滔 琚良艳丁楚楚陶源*
1北京大学深圳医院耳鼻咽喉科(深圳518036)
2中国人民解放军总医院耳鼻咽喉头颈外科;解放军总医院耳鼻咽喉研究所,耳鼻咽喉头颈外科国家临床研究中心,聋病教育部重点实验室,聋病防治北京市重点实验室,军事声损伤防护实验室,老年共病国家临床研究中心(北京100853)
3中山大学附属第八医院心血管内科(深圳518036)
噪声习服(Sound conditoning,SC)是由 Canlon发现并提出[1]。即在给动物高强度噪声暴露之前,给予中等水平的长期的声音刺激,可减少随后高强度噪声所致暂时性阈移及永久性阈移。急性声损伤易引起噪声性耳聋,噪声习服对急性声损伤存在着听力保护作用,但目前具体的机制不明。本文研究噪声习服对急性声损伤是否存在听力保护作用,计数突触数目的变化,耳蜗内氧自由基丙二醛(Malondialdehyde,MDA)含量与抗氧化酶(Superoxide dismutase,SOD)活力,初步探讨其对急性声损伤具有听力保护功能的可能机理。
1 材料与方法
1.1 实验动物与分组
2-3月龄SPF级标准的健康白毛雌性豚鼠40只,体重250-300g,耳廓反射正常,由解放军总医院动物实验中心提供,研究符合解放军总医院伦理委员会相关动物试验相关规定。随机分为4组,每组10只豚鼠,对照组(Control)为空白对照组,另3组为实验组,具体为:习服噪声组(Sound condtionging,SC),连续7天予以85dB白噪声暴露,每天持续3小时;噪声暴露组(Noise exposure,NE),连续3天予以105dB白噪声暴露,每天持续3小时;习服噪声后噪声暴露组(SC+NE),连续7天予以85dB白噪声暴露,每天持续3小时,休息24小时后,再连续3天105dB白噪声暴露,每天持续3小时。
1.2 噪声暴露
标准声级计对声音进行校准后,按照分组,分别对3组豚鼠行噪声暴露。暴露时将豚鼠置于鼠笼中,鼠笼空间尽可能狭小,扬声器置于鼠笼之上。
1.3 ABR阈值测定
采用美国TDT测听设备(TDT,Alachua,Florida,美国)和Biosig测听软件进行ABR测试。测听在隔声屏蔽室内进行,测听前使用1%戊巴比妥(40 ml/kg,腹腔注射)对豚鼠进行麻醉。记录电极置于两侧耳廓前缘连线中点皮下,参考电极置于右耳耳后皮下,接地电极置于对侧耳耳后皮下。发声扬声器距外耳道口约0.5cm。实验采用短声(Click)和4k、8k、16k、24k、32k Hz短纯音(Tone burst,上升/下降时间1 ms,平台4 ms)作为刺激声,带通滤波为300~3000Hz,叠加次数为1024次,扫描时间10ms。刺激声强度自最大刺激强度(90 dB SPL)开始,以10 dB为步距逐渐递减,直至检测不出重复的ABR波形,再向上递增5 dB,直至能检测出重复的ABR波形,以能分辨出可重复的ABR波Ⅲ的最低刺激强度判断阈值。分别于噪声暴露前24小时及暴露后即刻(1-3小时内)完成右耳ABR阈值测定。
1.4 耳蜗基底膜取材
各组分别取5只豚鼠,ABR测听完成后断头,去除脑组织,分离颞骨与听泡,去除听泡骨质,取出耳蜗,将耳蜗置入4%多聚甲醛的培养皿中。在显微镜下使用显微镊戳破蜗顶,前庭窗和蜗窗,灌注多聚甲醛,4°C冰箱过夜。第二天置于PBS培养皿中,缓慢剥去蜗壳,螺旋韧带、前庭膜及盖膜,分离蜗轴和基底膜,按顶、第3、第2、底回分为4段。
1.5 免疫荧光及染色
0.5%Triton100-X打孔30min,含有PBS缓冲液的5%的山羊血清封闭1小时,漂洗充分后加入一抗(小鼠来源CtBP2,1:200,abcam;兔来源Myosin VIIA,1:200,abcam)后4°C孵育一晚上,次日用PBS漂洗3遍,每次5min,随后加入二抗(羊抗小鼠647抗体1:200、羊抗兔488抗体1:200),毛细胞的纤毛染色染色(anti-phalloidin),直接加入phalloidin 555(1:1000,thermo)室温避光孵育1h,随后漂洗3次每次5min,用含DAPI的封片剂封片避光保存。
1.6 共聚焦显微镜
使用Leica正置共聚焦显微镜(TCSSP5 II;Leica Microsystems,Wetzlar,Germany),20倍镜下,选择405nm、488nm及555nm波长的激发光对标本进行层扫,层厚1um/层,荧光激发下分别显示蓝色、紫色和红色。以信号出现时开始层扫,以信号消失时结束,将所有图片叠加后形成最终的结果图片。切换至63倍油镜,选择405nm、488nm及647nm波长的激发光对标本进行层扫,层厚0.35um/层,荧光激发下分别显示蓝色、紫色和绿色。以信号出现时开始层扫,以信号消失时结束,将所有图片叠加后形成最终的结果图片。
1.7 突触前膜计数
在激光共聚焦显微镜下(63X),在顶、第3、第2、底回分别以10个内毛细胞核为一个计数矩形视野,每个视野中将突触前膜标记信号选中(CtBP2,绿色),总数计数,除以10,得到每个内毛细胞平均突触标记物数量,每个标本每回随机选取3个视野,共计3个标本(4回,每回9个视野,共36个视野),最后统计出每组动物突触前膜的数量(均数±标准差)。
1.8 耳蜗组织MDA含量和SOD活力测定
每组5只豚鼠处死后快速断头,取下双侧听泡,分别制备10%组织匀浆,每个匀浆组织分别测试MDA含量及SOD活力(每组10个样本),均按照南京建成生物工程研究所试剂盒步骤进行。
1.9 统计学方法
采用SPSS25进行统计分析。分别对4组的ABR阈值、突触计数、MDA含量及SOD活力行正态性检验,采用单因素方差分析,各组组间比较采用LSD法检验。P<0.05差异具有统计学意义。
2 实验结果
2.1 ABR阈值检测
分析 Control、SC、NE、SC+NE 各频率(Click、Tb4k、Tb8k、Tb16k、Tb24k、Tb32k Hz)的 ABR阈值(dB SPL,表1),单因素方差分析,LSD法检验各组各频率的阈值差异。NE各频率的ABR阈值最高,SC+NE各频率阈值明显低于NE,差异具有统计学意义(P<0.01)。同时,SC+NE各频率的ABR阈值明显高于Control,差异具有统计学意义(P<0.01)(图1)。
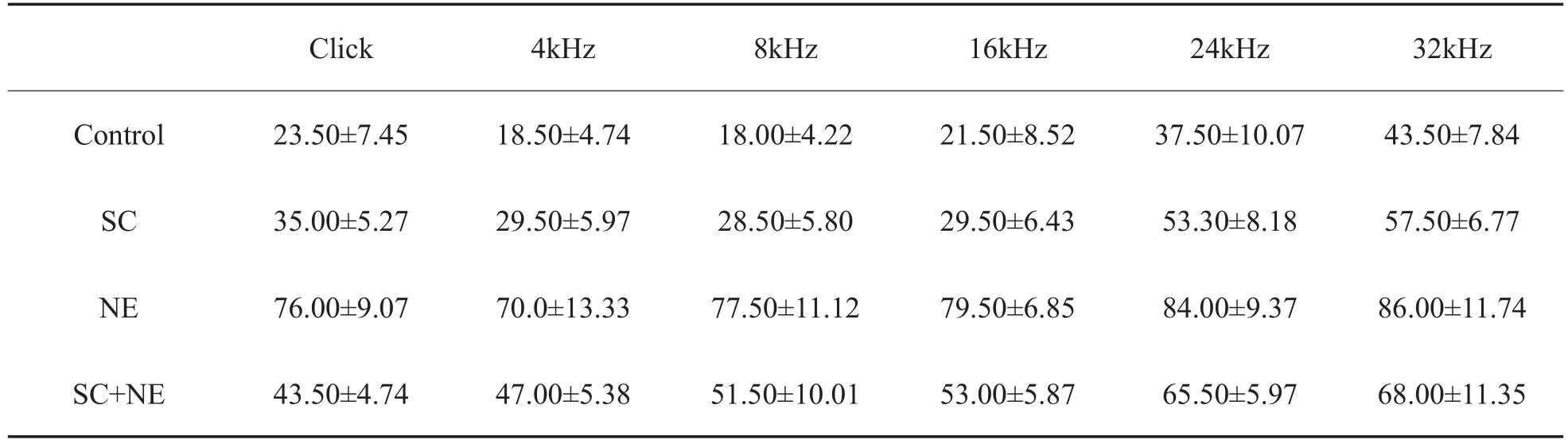
表1 实验组与对照组的ABR阈值变化(dBSPL,x±s,n=10)Table 1 The ABR threshold of the experiment groups and control group(dB SPL,x±s,n=10)

图1 实验组与对照组的ABR阈值变化Fig.1 The ABR threshold of the experiment groups and control groupSC+NE各频率的ABR阈值明显低于NE,差异具有统计学意义(P<0.01)。SC+NE各频率的ABR阈值明显高于Control,差异具有统计学意义(P<0.01)。**表示P<0.01。SC+NE was significantly reduced in the ABR thresholds across frequencies compared with NE(P<0.01);Control was significantly reduced in the ABR thresholds across frequenciescompared with SC+NE(P<0.01).**indicates P<0.01.
2.2 突触前膜计数
通过免疫标记内外毛细胞核(DAPI,蓝色)及突触前膜(CtBP2,绿色),分别计数每组3个标本的顶、第3、第2及底回突触前数量变化,分析4组之间的差异。各组各回的外毛细胞,均未见外毛细胞缺失。CtBP2特异性标记标记突触前膜,分别计数Control,SC,NE,SC+NE每个内毛细胞CtBP2数量(/IHC,x±s)。顶回分别为 11.80±0.59,11.29±0.29,8.87±0.30C,10.93±0.65;第3回分别为12.27±0.35,11.39±0.55,9.69±0.42,11.03±0.38;第 2回分别为13.67±0.43,11.85±0.51,7.03±0.30,12.46±0.56;底回分别为 21.39±1.35,14.18±0.40,7.47±0.67,12.68±1.32。单因素方差分析,LSD法检验组间的差异,Control每回的单个内毛细胞突触前膜数目均多于SC+NE,差异有统计学意义(P<0.01);NE每回单个内毛细胞的突触前膜数量均少于SC+NE,差异有统计学意义(P<0.01);SC顶回及第3回单个内毛细胞突触前膜计数与SC+NE相比,无统计学差异(PApical=0.13,P3rd=0.91,P>0.05),但第2回单个内毛细胞突触前膜计数,SC少于SC+NE,差异有统计学意义(P<0.01);底回单个内毛细胞突触前膜计数,SC多于SC+NE,差异有统计学意义(P<0.01)。
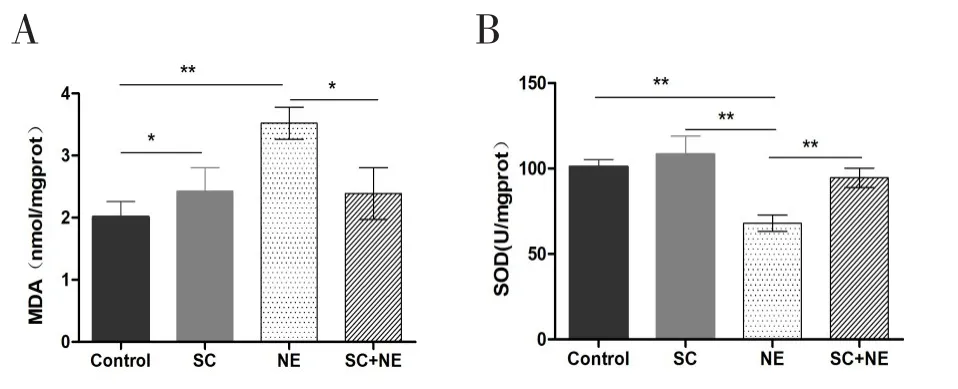
2.3 耳蜗组织MDA含量及SOD活力测定
对照组,习服噪声组,噪声组,习服噪声后噪声组,MDA 含量(nmol/mgprot,x±s,n=10)分别为:2.01±0.78,2.43±1.19,3.52±0.82,2.39±1.31。SOD活力(U/mgprot,x±s,n=10)分别为:101.05±13.29,108.37±33.82,68.00±15.06,94.52±18.16。噪声组MDA含量最高,SOD活性最低,单因素方差分析,LSD法检验各组之间的差异。习服后噪声组与噪声组相比,MDA含量低于噪声组,差异有统计学意义(P<0.05)。SOD活力高于噪声组,差异有明显统计学意义(P<0.01)。但与正常组及习服噪声组相比,MDA含量及SOD活力均无明显统计学差异。
3 讨论
噪声习服,是指先给予一定时间的中等强度噪声,能保护耳蜗免受更高强度噪声造成的损伤[1],最早由Canlon 等报道,在沙鼠[2]、大鼠[3]、小鼠[4]、豚鼠[5]、兔子[6]以及人类[7]都发现了此种现象。随后Roy S等和Suryadevara AC等报道,噪声习服(2小时90dB SPL宽频噪声)能保护铂类及氨基糖苷类对小鼠耳蜗毛细胞的损伤[2,4]。本实验,是先给中等强度的习服噪声,再给高强度的噪声,发现了噪声习服对更高强度的噪声有着听力保护作用,也验证了噪声习服这种现象的存在。关于噪声习服对听力的保护作用机理,目前尚不明确。有观点认为可能是通过上调热休克蛋白(HSPs)的表达而发挥保护作用(如HSP32,HSP70),减少毛细胞的损伤[4];也有观点认为是通过激活下丘脑-垂体-肾上腺轴[2],从而增加糖皮质激素的释放而发挥保护作用;Mohammadkhani G等认为是通过增加抗氧化酶而发挥作用[8]。Maison SF等则认为可能是噪声习服影响了外橄榄核,从而导致耳蜗神经纤维活性改变而发挥听力保护作用[9]。
本实验中,予以白噪声85dB或105dB噪声暴露,未发现其内外毛细胞有明显损伤,Chuang S等也得出了类似的研究结果[10]。突触位于内毛细胞与I型螺旋神经节之间。对噪声敏感,突触损害是噪声性感音神经性聋的基础。噪声能导致突触损伤,表现为不同程度的末端肿胀,导致了内毛细胞与螺旋神经节之间的连接被破坏[11]。突触可能是哺乳动物最易受噪声影响的。噪声习服对强噪声的听力保护作用,是否与突触的损伤有关,本实验中发现,噪声习服组、噪声组、噪声习服+噪声组的突触数目均比对照组减少,噪声组突触数目最少,损伤最大,耳蜗基底膜的第2回及底回表现最明显;噪声习服+噪声组的突触数目明显比噪声组多,且与正常对照组相比,顶回及第3回的突触数目基本接近于对照组。Ke L[12]等认为突触的数目改变及重新分布可能会导致听力的改变。Kujawa SG与Liberman MC报道CBA小鼠噪声暴露(100dB SPL 8-16k倍频噪声2h)后1天突触减少至40%,但未引起永久性阈移[13],于2015年再次报道噪声引起了耳蜗内突触数目的减少[14]。Liu L等研究发现豚鼠噪声暴露后1天,突触数量减少,体积稍变大,位置更靠近内毛细胞,平均减少约40%[15,16],且底回突触损伤的最多[15]。这与我们得出的结果类似,我们推测,噪声习服可能通过对突触的保护发挥听力保护的作用。
正常情况下,机体通过抗氧化剂、抗氧化酶系统消除氧自由基,使机体活性氧的氧化与抗氧化防御系统保持平衡,强噪声暴露后,平衡被打破,激发细胞凋亡,听力损失[17]。有学者认为,噪声习服对听力的保护作用,是通过恢复这种抗氧化平衡而发挥作用[18,19]。有研究报道,抗氧化剂药物对保护或治疗噪声性耳聋有效果[20,21]。噪声习服能增加抗氧化酶的有效性,从而保护噪声对耳蜗造成的氧化损伤[8,18]。MDA含量是细胞内氧自由基攻击生物膜中的不饱和脂肪酸的产物,组织内MDA含量是细胞活性氧堆积水平和细胞损伤程度的重要指标[21]。SOD是一种抗氧化酶,清除氧自由基,组织内SOD活力能间接反映机体的抗氧化防御系统功能[22]。本实验检测耳蜗内MDA含量及SOD活力,了解噪声习服对听力的保护作用,是否通过恢复这种氧化与抗氧化平衡而发挥作用。噪声组的MDA含量最高,SOD活力最低,习服噪声组与正常对照组相比,MDA含量稍高,而SOD活力稍低。习服噪声后噪声组与噪声组相比,MDA含量明显减低,而SOD活力明显增高,我们推测噪声习服可能通过恢复氧化与抗氧化的平衡而发挥听力保护的功能。
本实验验证了噪声习服对豚鼠急性声损伤的听力保护作用,初步探索了其发挥听力保护作用的机制,可能是通过减少噪声对突触的损伤及恢复耳蜗组织内氧化与抗氧化平衡而发挥作用。

