美洲大蠊抗肝纤维化活性部位酶解制备工艺的水解蛋白酶筛选Δ
杨华蕊,杨永寿,肖培云(1.大理大学药学与化学学院,云南大理671000;.云南省昆虫生物医药研发重点实验室,云南大理 671000)
美洲大蠊(Periplaneta americana L.)作为我国传统药用昆虫,其性寒,味咸,归肝、脾、肾经,古人称之为“蜚蠊”,是地球上起源最早、生命力最顽强的昆虫类群之一[1]。现代研究表明,美洲大蠊中含有蛋白质、氨基酸、多糖、核苷、甾体和萜类等多种活性物质[2-3],具有抗肿瘤、保肝、促进组织修复、增强机体免疫力、抗氧化等药理作用[4-6]。多项研究证实,美洲大蠊提取物可不同程度地抑制肝纤维化相关因子的含量,改善肝功能,从而抑制肝纤维化的进展[7-8]。本课题组一直致力于美洲大蠊的开发研究,前期研究已优化获得美洲大蠊脱脂膏提取工艺,并拟进一步对脱脂膏进行分离纯化以获得抗肝纤维化活性部位。然而,美洲大蠊脱脂膏提取率虽然较高(可达14.06%),但其抗肝纤维化活性部位提取率却偏低(仅0.54%)[9],不利于后期的开发利用。
自20世纪以来,酶化学与多学科的交叉研究得到了迅速发展和应用,特别是在医药和食品领域发挥了巨大作用[10]。酶解技术被常用于动物类药材的提取。动物类药材的物质基础多为小分子肽类,在提取过程中引入酶解技术,可将蛋白质、多肽等大分子物质酶解为能被更好地吸收入血的小肽类物质,有利于提高动物类药材活性成分的提取效率并改善其药理活性[11-14]。由于不同的蛋白酶具有不同的专一性和切割位点,所得到的酶解产物中肽类物质的氨基酸序列也各异[15],因此本研究通过对5种常用蛋白酶进行考察,拟筛选出最适于美洲大蠊中抗肝纤维化活性部位酶解制备工艺的水解蛋白酶,为后续酶解制备抗肝纤维化活性部位提供工艺基础。
1 材料
1.1 仪器
AL204-IC型电子天平[梅特勒-托利多仪器(上海)有限公司];SN255939型多功能酶标仪(美国Bio-Tek公司);5510E型CO2恒温培养箱(美国NuAire公司);SK5200H型超声仪(上海科导超声仪器有限公司);4500A型多功能粉碎机(永康市艾泽拉电器有限公司);TU1901型紫外-可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 试剂
胰蛋白酶(TR,250 U/mg)、胃蛋白酶(PE,250 U/mg)、碱性蛋白酶(AL,200 U/mg)、木瓜蛋白酶(PA,6 000 U/mg)、中性蛋白酶(NE,200 000 U/mg)、pH 7.4磷酸盐缓冲液(PBS)、四甲基偶氮唑蓝(MTT)均购自北京索莱宝科技有限公司;酪氨酸对照品、小牛血清白蛋白对照品(中国食品药品检定研究院,批号分别为111577-200201、140619-201723,纯度均为100%);高糖DMEM培养基、胎牛血清(美国Gibco公司);二甲基亚砜(DMSO,美国Sigma公司);HP20大孔树脂(20~60目,廊坊淼阳化工有限公司);其余试剂均为分析纯或实验室常用规格,水为蒸馏水。
1.3 药材
美洲大蠊药材(批号:20140109)由云南省大理州弥渡县美蠊养殖基地提供,经云南省昆虫生物医药研发重点实验室杨自忠教授鉴定为昆虫纲蜚蠊科昆虫美洲大蠊(Periplaneta americana L.)的干燥虫体。
1.4 细胞
大鼠肝星状细胞株HSC-T6购于中国科学院典型培养物保藏委员会昆明细胞库。
2 方法与结果
2.1 美洲大蠊脱脂膏的制备
称取美洲大蠊药材适量,粉碎,过2号筛,按料液比1∶5(g/mL)加入70%乙醇,于80℃加热提取3次,每次2.5 h。合并提取液,减压浓缩至约1.3 g/cm3,石油醚脱脂,即得。
2.2 脱脂膏酶解工艺
取“2.1”项下制备的美洲大蠊脱脂膏适量,用水稀释至溶液密度为1.07 g/cm3,调节溶液温度至酶解反应温度后,用1 mol/mL氢氧化钠溶液或浓盐酸溶液调节pH至所需值;加入不同种类蛋白酶,在一定温度条件下酶解反应一定时间(具体酶解反应条件[16-20]见表1);反应结束后于沸水浴中灭酶10 min。酶解液在室温下放置冷却,用1 mol/mL氢氧化钠溶液或浓盐酸溶液调节pH值至中性。另设一组不加蛋白酶的脱脂膏溶液,同法操作,得对照反应液。
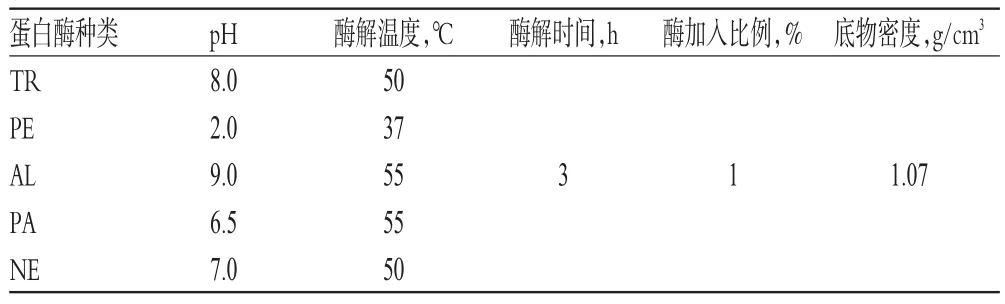
表1 酶解反应条件Tab 1 Conditions for enzymatic hydrolysis
2.3 不同蛋白酶的酶解活性考察
2.3.1 酪氨酸标准曲线的绘制 精密称取105℃干燥至恒质量的酪氨酸对照品0.5 mg,置于10 mL量瓶中,加0.02 mol/L氢氧化钠溶液1 mL,超声(功率:200 W,频率:53 kHz,下同)使溶解,加水定容,混匀,得酪氨酸对照品溶液。采用茚三酮法[21]进行测定:精密移取上述对照品溶液0.20、0.50、1.00、1.50、1.80、2.00 mL,分别置于10mL量瓶中,加0.2 mol/L柠檬酸缓冲液(柠檬酸4.202 g,以水40 mL溶解后,用1 mol/mL氢氧化钠溶液调节pH至6.0,加水稀释至100 mL,即得)1.0 mL、1%茚三酮试液(茚三酮0.5 g,以适量无水乙醇超声溶解后定容至50 mL,即得)1.0 mL,摇匀,沸水浴中加热30 min,取出,冷却,再加60%乙醇3.0 mL,用水定容至刻度,摇匀。以水为空白,用紫外可见分光光度计在570 nm波长处测定吸光度,以酪氨酸质量浓度(x,μg/mL)为横坐标、吸光度(y)为纵坐标绘制标准曲线,得回归方程为y=56.978x+0.008 3(r=0.999 2)。结果表明,酪氨酸质量浓度在1.0~10.0 μg/mL范围内与吸光度线性关系良好。
2.3.2 小牛血清白蛋白标准曲线的绘制 精密称取小牛血清白蛋白对照品适量,以水配制成质量浓度为0.203 mg/mL的对照品溶液。采用福林酚法[22]进行测定:精密移取上述对照品溶液0.2、0.5、1.0、1.5、1.8、2.0 mL,置于10 mL量瓶中,加福林酚试剂A液1.0 mL,混匀,35℃反应10 min,冷却;然后快速加入福林酚试剂B液4.0mL,混匀,55℃反应15 min,冷却;用水定容至刻度,摇匀。以水为空白,在762.2 nm波长处测定吸光度,以白蛋白质量浓度(x,μg/mL)为横坐标、吸光度(y)为纵坐标绘制标准曲线,得回归方程为y=18.867x+0.055 2(r=0.999 4)。结果表明,白蛋白质量浓度在4.06~40.60 μg/mL范围内与吸光度线性关系良好。
2.3.3 美洲大蠊脱脂膏及其酶解液中游离氨基肽氮的含量测定 取“2.1”项下制得的美洲大蠊脱脂膏及其按“2.2”项下酶解工艺制得的5种酶解液适量,用水稀释至适当浓度,按“2.3.1”项下茚三酮法测定,并按标准曲线法计算酪氨酸含量;参照文献[23],以酪氨酸/游离氨基肽氮的转换系数为0.662计算样品中游离氨基肽氮含量。试验重复3次。结果显示,美洲大蠊脱脂膏中游离氨基态氮含量为(19.55±0.57)%;NE和PA酶解液中游离氨基态氮含量较高,分别为(23.7±0.52)%、(23.29±0.71)%;AL和TR酶解液其次,游离氨基态氮含量分别为(21.8±0.22)%、(19.74±0.64)%;PE酶解液中游离氨基态氮含量最低,仅为(17.21±0.16)%。
2.3.4 不同蛋白酶水解度的测定 采用“2.3.2”项下福林酚法测定样品的吸光度,以标准曲线法计算美洲大蠊脱脂膏中的蛋白质含量,并以此推算出其总氮量为45.98%;然后结合“2.3.3”项下测得的美洲大蠊脱脂膏及其酶解液的游离氨基态氮量,按公式计算各蛋白酶水解度[21]:水解度(%)=已水解肽键数/蛋白质总肽键数×100%=(A-C)/(B-C)×100%(式中,A为各蛋白酶水解液中游离氨基态氮量,B为美洲大蠊脱脂膏的总氮量,C为美洲大蠊脱脂膏中游离氨基态氮量)。结果显示,NE水解度为15.70%,表明其酶解能力最强;PA水解度为14.15%,其酶解能力次之;AL水解度为8.51%,酶解能力较弱;TR和PE的水解度均小于1%,几乎没有酶解能力。
2.4 不同蛋白酶解液的分离纯化得率考察
取“2.2”项下美洲大蠊脱脂膏的各酶解液及对照反应液,经HP20大孔树脂分离纯化:按1/6柱体积(BV)的量上样吸附10 h后,分别以体积分数为50%、60%、70%、95%的乙醇按0.025 BV/min流速进行洗脱,洗脱溶剂用量均为2 BV[9]。各洗脱部位经减压浓缩、冷冻干燥后,计算得率。采用SPSS 17.0软件对数据进行统计分析,多组间比较采用单因素方差分析;方差齐时,两组间比较采用最小显著法(LSD)检验;方差不齐时则采用Tamhanes T2法检验,结果见表2。
由表2可见,各酶解液的50%乙醇洗脱部位得率最高,均在9%以上;60%乙醇洗脱部位的得率次之,在2%左右;70%、95%乙醇洗脱部位的得率相对较低。对不同蛋白酶解液进行横向比较后结果显示,50%乙醇洗脱部位得率大小排序依次为NE>AL>PE>PA>TR>对照反应液;60%乙醇洗脱部位得率大小排序依次为TR>PA>AL>PE>NE>对照反应液;70%乙醇洗脱部位得率大小排序依次为NE>AL>PA>TR>对照反应液>PE;95%乙醇洗脱部位得率大小排序依次为PA>NE>AL>对照反应液>TR>PE。其中,经PA、NE、AL酶解后所得反应液的95%乙醇洗脱部位得率较对照反应液有所提高,提高率分别为30.36%、16.07%、14.29%;经PE、TR酶解后所得反应液的95%乙醇洗脱部位得率较对照反应液有所降低,差异均有统计学意义(P<0.05或P<0.01)。
表2 不同蛋白酶解液分离纯化洗脱部位得率比较(±s,n=3,%%)Tab 2 Comparison of yield of the elution parts isolated and purified from different protease hydrolyzates(±s,n=3,%%)
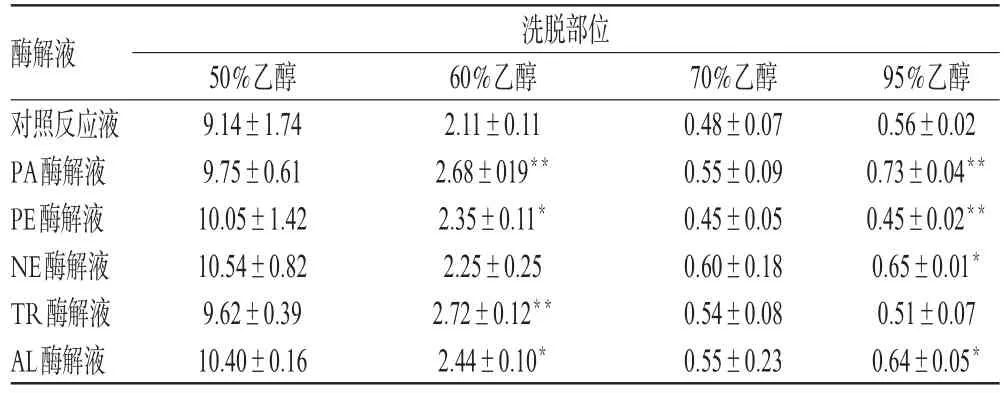
表2 不同蛋白酶解液分离纯化洗脱部位得率比较(±s,n=3,%%)Tab 2 Comparison of yield of the elution parts isolated and purified from different protease hydrolyzates(±s,n=3,%%)
注:与对照反应液比较,*P<0.05,**P<0.01Note:vs.control reaction liquid,*P<0.05,**P<0.01
酶解液对照反应液PA酶解液PE酶解液NE酶解液TR酶解液AL酶解液洗脱部位95%乙醇0.56±0.02 0.73±0.04**0.45±0.02**0.65±0.01*0.51±0.07 0.64±0.05*50%乙醇9.14±1.74 9.75±0.61 10.05±1.42 10.54±0.82 9.62±0.39 10.40±0.16 60%乙醇2.11±0.11 2.68±019**2.35±0.11*2.25±0.25 2.72±0.12**2.44±0.10*70%乙醇0.48±0.07 0.55±0.09 0.45±0.05 0.60±0.18 0.54±0.08 0.55±0.23
2.5 不同蛋白酶解液洗脱部位对HSC-T6细胞的体外抑制活性考察
2.5.1 药物溶液的配制 精密称取“2.4”项下所得各洗脱部位冻干粉适量,用DMSO溶解配成质量浓度为30 mg/mL的溶液,用含1%胎牛血清的DMEM培养基稀释至300 μg/mL后,用0.22 μm的无菌微孔滤头滤过;滤液用含1%胎牛血清的DMEM培养基依次稀释为110、120、130、140 μg/mL(给药剂量根据前期预试验结果设置),现配现用。
2.5.2 分组、给药及抑制率的检测 取对数生长期的HSC-T6细胞,调整细胞浓度至8×104个/mL,按100 μL/孔接种于96孔板中,于37℃、5%CO2培养箱(以下培养条件相同)培养24 h后,弃去上清液。将细胞随机分为空白组、正常组和不同剂量给药组,空白组不加细胞和药液、正常组加细胞但不加药液(均加入等量空白培养基,各给药组分别加入“2.5.1”项下配制的不同质量浓度的药物溶液。各组均设5个复孔。各组细胞分别继续培养24、48、72 h后,弃去上清液,每孔加入5 mg/mL的MTT溶液20 μL;继续培养4 h后,每孔加入DMSO 150μL,摇匀,使紫色结晶溶解。采用酶标仪于490 nm波长处检测各孔光密度(OD)值。根据公式计算各洗脱部位对HSC-T6细胞增殖的抑制率:抑制率(%)=[1-(给药组平均OD值-空白组平均OD值)/(正常组平均OD值-空白组平均OD值)]×100%。
2.5.3 各蛋白酶解液的不同洗脱部位对HSC-T6细胞的抑制作用分析 结果显示,在试验剂量范围内,5种酶解液及对照反应液的50%、60%、70%乙醇洗脱部位对HSC-T6细胞的抑制率均较低,个别洗脱部位还呈现促细胞增长现象(即抑制率为负值);而95%乙醇洗脱部位对HSC-T6细胞的抑制率(均在20%以上)较其他洗脱部位更高,且与给药剂量呈正相关,表现出较好的细胞增殖抑制效果。不同洗脱部位作用不同时间时对细胞增殖的抑制率见图1~图3。
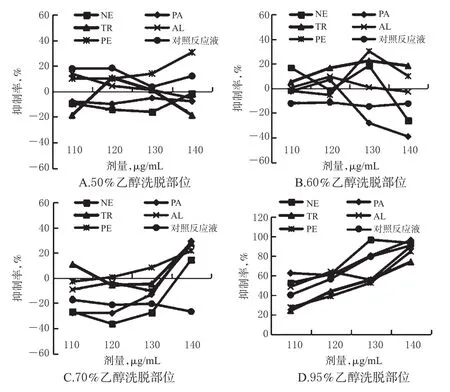
图1 不同洗脱部位作用24 h时HSC-T6细胞的抑制率Fig 1 Inhibitory rates of different elution parts on HSC-T6 cells at 24 h
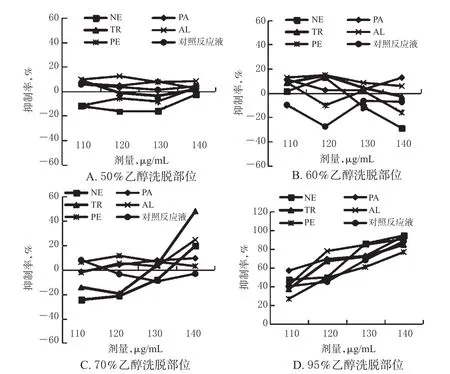
图2 不同洗脱部位作用48 h时HSC-T6细胞的抑制率Fig 2 Inhibitory rates of different elution parts on HSC-T6 cells at 48 h
2.5.4 各蛋白酶解液的95%乙醇洗脱部位对HSC-T6细胞的抑制作用分析 与对照反应液的95%乙醇洗脱部位比较,PA酶解液的95%乙醇洗脱部位在作用24、48、72 h时对HSC-T6细胞的半数抑制浓度(IC50,经SPSS 17.0软件计算获得)有所降低,NE、AL、TR酶解液的95%乙醇洗脱部位的IC50值较为接近,而PE酶解液的95%乙醇洗脱部位的IC50值明显增加。结合“2.4”项下的95%乙醇洗脱部位的得率综合考虑,最终选择NE、PA作为美洲大蠊脱脂膏抗肝纤维化部位酶解工艺的水解蛋白酶。不同酶解液的95%乙醇洗脱部位作用不同时间对HSC-T6细胞的影响见表3~表5。
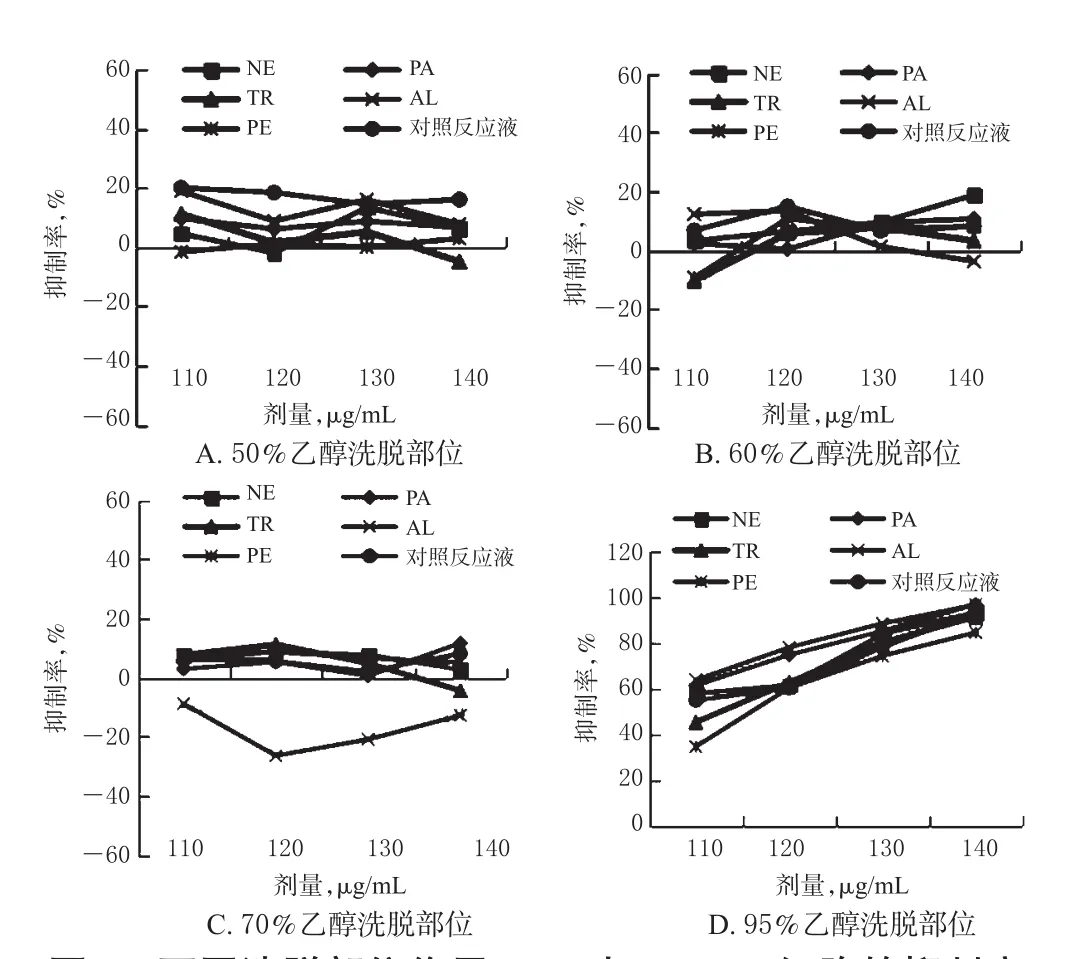
图3 不同洗脱部位作用72 h时HSC-T6细胞的抑制率Fig 3 Inhibitory rates of different elution parts on HSC-T6 cells at 72 h
表3 不同酶解液的95%%乙醇洗脱部位作用24 h时对HSC-T6细胞的影响(±s,n=5)Tab 3 Effects of 95%%ethanol elution parts from different hydrolyzates on HSC-T6 cells at 24 h(±s,n=5)
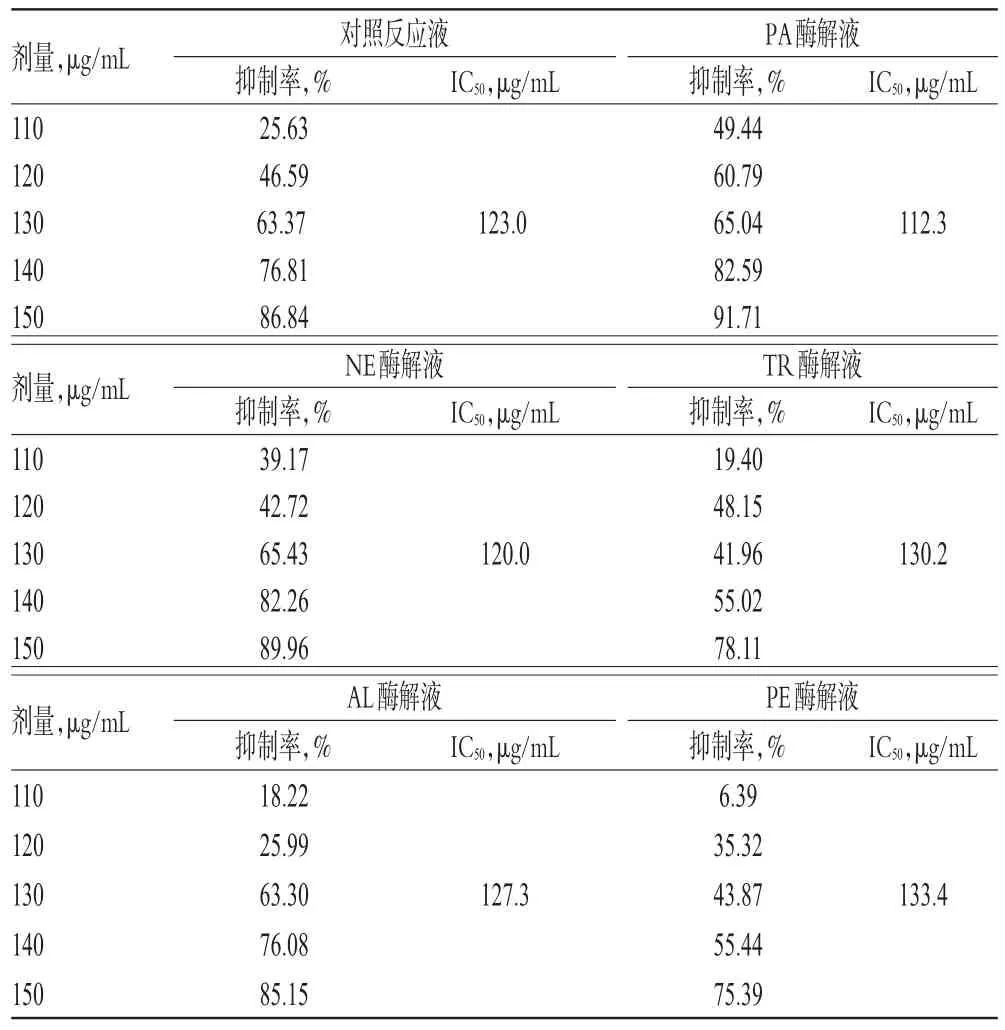
表3 不同酶解液的95%%乙醇洗脱部位作用24 h时对HSC-T6细胞的影响(±s,n=5)Tab 3 Effects of 95%%ethanol elution parts from different hydrolyzates on HSC-T6 cells at 24 h(±s,n=5)
IC50,μg/mL IC50,μg/mL 112.3剂量,μg/mL 110 120 130 140 150剂量,μg/mL 110 120 130 140 150剂量,μg/mL 110 120 130 140 150 IC50,μg/mL 123.0 IC50,μg/mL 120.0130.2对照反应液抑制率,%25.63 46.59 63.37 76.81 86.84 NE酶解液抑制率,%39.17 42.72 65.43 82.26 89.96 AL酶解液抑制率,%18.22 25.99 63.30 76.08 85.15 IC50,μg/mL IC50,μg/mL 127.3 PA酶解液抑制率,%49.44 60.79 65.04 82.59 91.71 TR酶解液抑制率,%19.40 48.15 41.96 55.02 78.11 PE酶解液抑制率,%6.39 35.32 43.87 55.44 75.39 133.4
表4 不同酶解液的95%%乙醇洗脱部位作用48 h时对HSC-T6细胞的影响(±s,n=5)Tab 4 Effects of 95%%ethanol elution parts from different hydrolyzates on HSC-T6 cells at 48 h(±s,n=5)
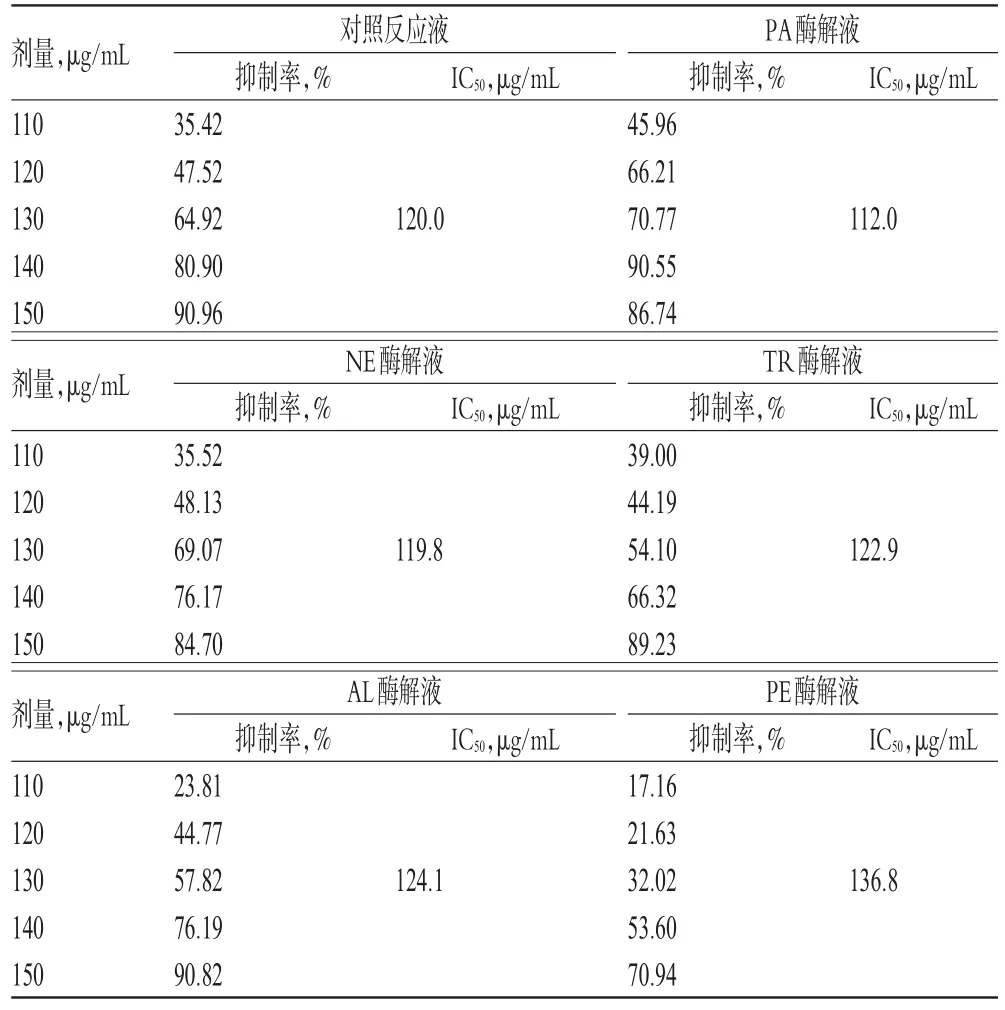
表4 不同酶解液的95%%乙醇洗脱部位作用48 h时对HSC-T6细胞的影响(±s,n=5)Tab 4 Effects of 95%%ethanol elution parts from different hydrolyzates on HSC-T6 cells at 48 h(±s,n=5)
剂量,μg/mL 110 120 130 140 150剂量,μg/mL 110 120 130 140 150剂量,μg/mL 110 120 130 140 150 IC50,μg/mL IC50,μg/mL 120.0112.0对照反应液抑制率,%35.42 47.52 64.92 80.90 90.96 NE酶解液抑制率,%35.52 48.13 69.07 76.17 84.70 AL酶解液抑制率,%23.81 44.77 57.82 76.19 90.82 IC50,μg/mL IC50,μg/mL 119.8122.9 IC50,μg/mL IC50,μg/mL 124.1 PA酶解液抑制率,%45.96 66.21 70.77 90.55 86.74 TR酶解液抑制率,%39.00 44.19 54.10 66.32 89.23 PE酶解液抑制率,%17.16 21.63 32.02 53.60 70.94 136.8
表5 不同酶解液的95%%乙醇洗脱部位作用72 h时对HSC-T6细胞的影响(±s,n=5)Tab 5 Effects of 95%%ethanol elution parts from different hydrolyzates on HSC-T6 cells at 72 h(±s,n=5)
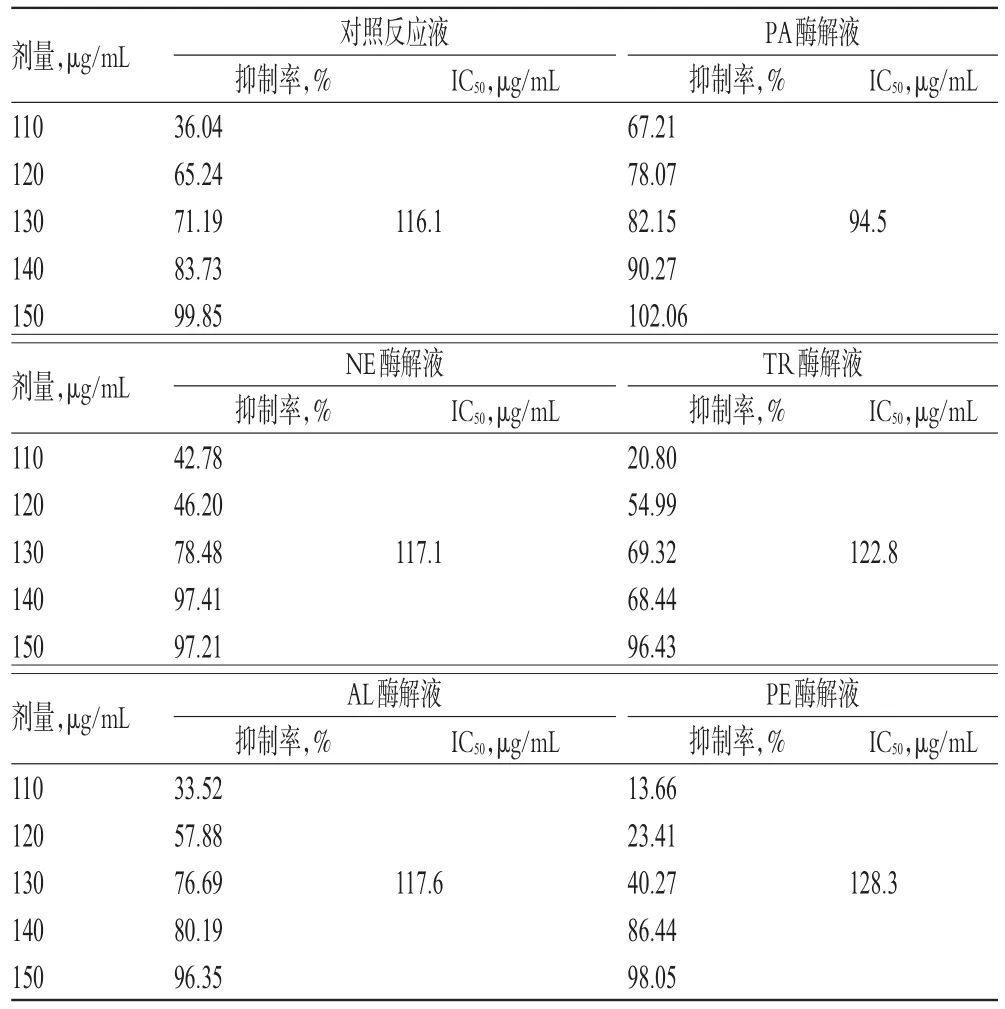
表5 不同酶解液的95%%乙醇洗脱部位作用72 h时对HSC-T6细胞的影响(±s,n=5)Tab 5 Effects of 95%%ethanol elution parts from different hydrolyzates on HSC-T6 cells at 72 h(±s,n=5)
剂量,μg/mL 110 120 130 140 150剂量,μg/mL 110 120 130 140 150剂量,μg/mL 110 120 130 140 150 IC50,μg/mL IC50,μg/mL 116.194.5对照反应液抑制率,%36.04 65.24 71.19 83.73 99.85 NE酶解液抑制率,%42.78 46.20 78.48 97.41 97.21 AL酶解液抑制率,%33.52 57.88 76.69 80.19 96.35 IC50,μg/mL IC50,μg/mL 117.1122.8 IC50,μg/mL IC50,μg/mL 117.6 PA酶解液抑制率,%67.21 78.07 82.15 90.27 102.06 TR酶解液抑制率,%20.80 54.99 69.32 68.44 96.43 PE酶解液抑制率,%13.66 23.41 40.27 86.44 98.05 128.3
3 讨论
酶解法辅助提取中药材中的活性成分是一种新兴的高效提取方法,是目前制备生物活性多肽的常用方法之一,可在不降低多肽活性的同时提高其得率[13,16]。王涛等[24]采用碱法、盐法和酶法对美洲大蠊蛋白质进行分离和提取,通过小鼠伤口愈合实验筛选出最优方法为胰蛋白酶提取法。罗廷顺等[22]研究发现,美洲大蠊醇提取物经PA酶解后分子量变小、分布变宽。但至今尚未见通过酶解工艺制备美洲大蠊脱脂膏中抗肝纤维化活性部位的研究报道。本研究分别采用TR、PE、AL、PA、NE这5种常用蛋白酶,对美洲大蠊脱脂膏进行酶解处理。TR主要来源于胰脏,作用于精氨酸、赖氨酸残基侧的肽键[25];PE主要来源于胃黏膜,主要作用于疏水性氨基酸(如苯丙氨酸、蛋氨酸、亮氨酸、色氨酸)[18];AL的主要酶切位点为丙氨酸、亮氨酸、酪氨酸和苯丙氨酸[18];PA属于巯基蛋白酶,可水解绝大多数肽键,但对不同肽键水解的速率相差较大,该酶对蛋白质或多肽中精氨酸、赖氨酸、苯丙氨酸的羧基形成的肽键非常敏感[26];NE作用底物广泛,反应条件温和[27]。
本研究首先采用茚三酮法和福林酚法测得不同蛋白酶对美洲大蠊脱脂膏的水解度,其大小排序依次为NE>PA>AL>TR>PE。其次,采用大孔树脂法分离纯化美洲大蠊酶解液,结果显示,不同酶解液的95%乙醇洗脱部位得率大小排序依次为PA>NE>AL>PE>TR,其中PA、NE、AL酶解液的95%洗脱部位得率较对照反应液分别提高了30.36%、16.07%、14.29%。再次,考察了不同酶解液的50%、60%、70%、95%乙醇洗脱部位对HSC-T6细胞的体外增殖抑制作用。肝星状细胞(HSC)是肝纤维化时产生细胞外基质(ECM)的主要细胞,已有研究表明,HSC活化为肌成纤维细胞并大量分泌ECM的过程是肝纤维化病理机制的关键环节[28]。因此,抑制HSC的活化和增殖能够抑制肝纤维化的发生。本研究结果显示,50%、60%、70%乙醇洗脱部位的体外抗肝纤维化作用较对照反应液洗脱物均未明显提高,个别洗脱部位甚至对HSC-T6细胞表现出促进生长的作用;而95%乙醇洗脱部位对HSC-T6细胞则表现出较好的体外抑制作用。
本研究发现,美洲大蠊脱脂膏水解蛋白酶的水解度与其获得的抗肝纤维化活性部位的得率及对HSC-T6细胞的体外抑制活性之间存在一定关联:PA、NE、AL对美洲大蠊脱脂膏的水解度较高,同时其纯化所得95%乙醇洗脱部位的得率也较高,对HSC-T6细胞抑制活性的IC50值也较小;PE几乎无水解作用,其纯化所得洗脱部位的得率相对较低,抑制活性的IC50值也较大。但上述3个评价指标之间并非呈绝对正相关,分析其原因可能是美洲大蠊中具有抗肝纤维化作用的并非单一化合物,而是多成分间协同作用的结果,并且可能存在一定的配比关系。因此,对美洲大蠊脱脂膏酶解效果的评价不能仅依据水解度,还需结合其纯化提取物的得率和活性进行综合评价。
综上,本研究确定PA作为美洲大蠊脱脂膏的酶解工艺的最佳水解酶,NE、AL效果次之但亦具有一定研究价值,PE、TR效果较差,不适用于该酶解工艺。本研究为酶解工艺的后续研究提供了基础,后期拟对PA酶解美洲大蠊脱脂膏制备抗肝纤维化活性部位的工艺进行优化。

