黄鳝醛酮还原酶对大肠杆菌非生物胁迫耐受性的影响
阚延泽 江翱 王全禾
摘要:醛酮还原酶是一类依赖NAD(P)H的氧化还原酶,在生物体内参与了糖代谢、酮代谢和物质运输等多种生理过程。为了解黄鳝醛酮还原酶在细胞逆境胁迫中的保护作用,采用液体培养和斑点展示法,比较含黄鳝醛酮还原酶Eakr的重组菌株和阴性对照菌株在NaCl、Cu2+和H2O2等非生物胁迫下的存活率和生长活力。结果表明,含重组醛酮还原酶Eakr的大肠杆菌在高渗透压、重金属和氧化胁迫下的生存率显著高于阴性对照,其生存活力也大大增强。提示黄鳝醛酮还原酶Eakr可能参与了细胞活性氧代谢和物质运输等多种生理过程。
关键词:醛酮还原酶;非生物胁迫;存活率;耐受性
中图分类号: S188+.3 文献标志码: A 文章编号:1002-1302(2019)01-0159-03
醛酮还原酶(aldo keto reductase,AKR)是一类通过与辅酶NAD(P)H结合将醛酮类物质还原为相应醇类的的氧化还原酶。它包括16 个家族,近200个成员,在酵母、植物、哺乳动物以及原核生物中均有报道 [1]。醛酮还原酶既参与了人类细胞对外源、内源性毒性物质的代谢过程,也导致了某些重要疾病的发生与发展[2]。人类醛酮还原酶AKR7A家族的成员不仅能够抵抗活性醛类物质氧化毒害的作用[3],而且还参与了活性氧代谢,是机体重要的防御酶[4-5];相反,胰脏肿瘤细胞中AKR1B10基因被抑制后可有效抑制肿瘤细胞癌变,提示AKR1B10可能参与了肿瘤形成的过程[6]。除此以外,AKRs还可以催化视黄醛还原成视黄醇,影响生物体视觉的形成[7],并且在维持膜电位、细胞内外渗透压平衡以及物质跨膜运输等方面扮演重要的角色[8]。植物和微生物中发现的醛酮还原酶似乎还是机体抵抗干旱、盐胁迫和重金属等非生物胁迫的重要因子[9-10]。目前,国内外对于鱼类醛酮还原酶功能的研究相对贫乏。代海艳等初步探讨了黄鳝醛酮还原酶的羰基解毒作用,发现该酶可有效降低丙酮醛和2,3-丁二酮等羰基化合物的毒害作用[11]。但对其是否参与了细胞重金属代谢、盐离子胁迫和活性氧代谢等过程尚不甚清楚。本研究拟通过对比含黄鳝醛酮还原酶Eakr菌株和空白质粒菌株,在高渗透压、重金属和氧化3种逆境胁迫处理下的存活率及生长活力差异,分析黄鳝醛酮还原酶在细胞非生物胁迫中的保护作用,为深入了解黄鳝醛酮还原酶的生物学功能提供参考资料。
1 材料与方法
1.1 试验菌株与试剂
供试菌株含pET-28a-Eakr重组质粒BL21菌株和 pET-28a空质粒BL21菌株,均由长江大学生物医药研究所保存。抗生素、CuSO4、NaCl和H2O2等均为国产分析纯。
1.2 方法
1.2.1 重组蛋白的诱导表达检测 该试验于2016—2017年在长江大学生物医药研究所动物基因组研究室完成,将实验室保存的pET-28a-Eakr重组质粒阳性克隆菌株在LB平板(含50 g/mL Kana)上划线,37 ℃过夜培养。在平板上挑取单菌落于LB液体培养基(含50 g/mL Kana)中,37 ℃ 200 r/min振荡培养。待培养D600 nm值至约0.6时,加入终浓度为 0.1 mmol/L 的IPTG,37 ℃诱导培养4 h。使用12%的SDS-PAGE电泳检测目的蛋白是否表达。
1.2.2 不同胁迫因子处理及存活率、生长活力展示 首先,用LB培养基将pET-28a-Eakr重组质粒菌株培养至D600 nm至约为0.6时,加入终浓度为0.1 mmol/L的IPTG诱导培养 4 h。取6个EP管,各加入1 mL诱导后菌液,同时加入NaCl,使NaCl终浓度分别为0、50、100、150、200、250 mmol/L,37 ℃ 150 r/min培养1 h。离心收集菌体,用灭菌水洗涤菌体后,使用1 mL新鲜LB重悬。取10 μL菌液进行101、102、103、104、105、106……倍梯度稀释。取50 μL稀释后的菌液,均匀涂在LB平板(含50 μg/mL Kana)上,于37 ℃培养箱中恒温培养 12 h。选择菌落数目在500 以内的平板,用菌落分析仪进行计数。根据稀释倍数,计算不同浓度NaCl处理后大肠杆菌的存活个数。存活率Sr=(非生物胁迫后菌落总数/空白对照菌落总数)×100%。
斑点展示法表征菌落生长活力:将不同胁迫条件处理后的菌液进行1倍、10倍、100倍、1 000倍稀释,取5 μL点在LB平板(含 50 μg/mL Kana)上,于37 ℃培養箱中培养,12 h后将平板放入菌落分析仪中拍照并保存。将含pET-28a空质粒菌株(WT)做以上相同处理,每个处理重复3次。
同样采用类似方法进行CuSO4、H2O2的液体培养和斑点形成展示。CuSO4胁迫处理终浓度为0、2、4、6、8、10 mmol/L,H2O2胁迫处理终浓度为0、1、2、4、8、16 mmol/L。
1.2.3 数据处理与分析 采用SPSS 20.0 进行数据处理和统计学分析,存活率均用“ x±s”表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 SDS-PAGE检测诱导表达结果
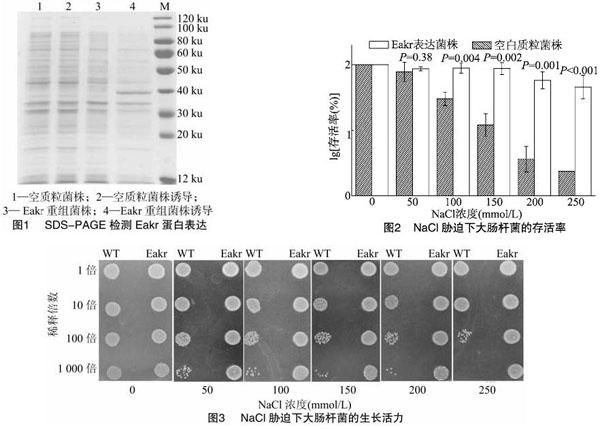
SDS-PAGE凝胶电泳检测结果显示,含pET-28a-Eakr BL21阳性菌株经诱导后可检测到分子量约为38 ku的特异条带,大小与预测Eakr分子量相符,空质粒菌株诱导后未检测到类似分子量蛋白表达。证明Eakr在大肠杆菌中实现了高效表达 (图1)。
2.2 非生物胁迫对Eakr表达菌生长的影响
将Eakr表达菌株和空白质粒菌株同时进行NaCl胁迫处理,通过菌落计数仪记录存活菌落数目,计算存活率并进行数据处理。高盐环境严重影响大肠杆菌的存活率,随着NaCl浓度的升高,空白质粒菌株的存活率显著降低,Eakr表达菌株存活率变化较小。当NaCl浓度≥100 mmol/L时,Eakr表达菌株和空白质粒菌株存活率差异显著。当NaCl浓度为 250 mmol/L 时Eakr表达菌株的存活率约为空白质粒菌株的20倍(图2)。斑点展示结果表明,不同浓度的NaCl胁迫对Eakr表达菌株生长影响较小,但对空白质粒菌株影响显著。Eakr表达菌株的生长活力明显优于空白质粒菌株。这与NaCl胁迫下存活率统计结果吻合。说明Eakr可以提高大肠杆菌对高渗透压胁迫的耐受性(图3)。
Cu2+胁迫试验发现,随着Cu2+浓度的不断升高,Eakr表达菌株和空白质粒菌株的存活率均有下降,但空白质粒菌株存活率下降得更为显著,且Eakr表达菌株的存活率均高于空白质粒菌株。当Cu2+浓度≥4 mmol/L时,Eakr表达菌株的存活率远高于空白质粒菌株的存活率,且差异极显著。在Cu2+浓度为10 mmol/L时,Eakr表达菌株的存活率为空白质粒菌株存活率的500倍(图4)。斑点展示结果进一步证实,不同浓度Cu2+胁迫下,Eakr表达菌株均比空白质粒菌株生长旺盛,当Cu2+浓度>8 mmol/L时,空白质粒菌株已无明显菌落,但Eakr表达菌株仍有部分存活,这与Cu2+胁迫下存活率统计结果一致(图5)。说明Eakr的表达可提高大肠杆菌对耐Cu2+胁迫的耐受性。
比较Eakr表达菌株和空白质粒菌株在不同浓度H2O2胁迫下的存活率发现,随着H2O2浓度的不断升高,Eakr表达菌株和空白质粒菌株的存活率均有下降,但空白质粒菌株存活率下降得更为显著,且Eakr表达菌株的存活率均高于空白质粒菌株。在H2O2浓度为16 mmol/L时,Eakr表达菌株的存活率为空白质粒菌株存活率的40倍(图6)。Eakr表达菌株和空白质粒菌株在培养基上的生长状态也存在明显差异,在不同浓度H2O2下Eakr表达菌株均比空白质粒菌株生长茂盛,在H2O2浓度≥8 mmol/L时空白质粒菌株已无明显菌落,但Eakr表达菌株的菌落基本完整(图7)。说明Eakr的表达可以显著提高大肠杆菌对氧化胁迫的耐受性。
3 讨论和结论
醛酮还原酶广泛分布于原核和真核生物中,具有多种生物学功能[12]。大部分AKR都能以醛类物质作为底物[13],是一类重要的解毒酶[14]。人类肝脏AKR7A可以代谢黄曲霉素等强致癌物质,在肝脏抗氧化过程中起到关键作用[4];蓝藻醛酮还原酶基因AKR3G1能够催化还原脂质氧化过程中产生的有毒羰基化合物[15];野生大麦表达外源基因拟南芥AKR4C9时,可以顯著提高对重金属铬和盐胁迫的耐受性[16];同时在大肠杆菌中表达醛酮还原酶基因ALDRXV4,显著提高了对高盐、高渗透压、重金属和醛类物质等非生物胁迫环境下
的耐受性[9];醛酮还原酶AKR17A1在大肠杆菌中表达,显著提高了大肠杆菌对镉、砷、干旱、盐及高温等非生物胁迫下的耐受性[17],以上研究均显示,醛酮还原酶在细胞非生物胁迫中起到关键保护作用。笔者的研究结果也证实,重组黄鳝醛酮还原酶Eakr赋予重组大肠杆菌较强的抗高渗透压、氧化胁迫及重金属伤害的能力。在Eakr的保护下,大肠杆菌在NaCl、Cu2+和H2O2胁迫中的生存率分别提高了20、500、40倍。这些结果提示,黄鳝体内的醛酮还原酶可能也是一种重要的机体抵御胁迫危害的保护酶。但Eakr在生物体内的具体作用及调控机制尚不明确,需要进一步深入研究。笔者的研究为鱼类醛酮还原酶的生物学功能研究提供了参考资料。
参考文献:
[1]Ellis E M. Microbial aldo-keto reductases[J]. FEMS Microbiology Letters,2002,216(2):123-131.
[2]Penning T M. The aldo-keto reductases (AKRs):Overview[J]. Chemico-Biological Interactions,2015,234:236-246.
[3]Lyon R C,Li D,Mcgarvie G,et al. Aldo-keto reductases mediate constitutive and inducible protection against aldehyde toxicity in human neuroblastoma SH-SY5Y cells[J]. Neurochemistry International,2013,62(1):113-121.
[4]Li D,Ferrari M,Ellis E M. Human aldo-keto reductase AKR7A2 protects against the cytotoxicity and mutagenicity of reactive aldehydes and lowers intracellular reactive oxygen species in hamster V79-4 cells[J]. Chemico-Biological Interactions,2012,195(1):25-34.
[5]Li D,Ellis E M. Aldo-keto reductase 7A5 (AKR7A5) attenuates oxidative stress and reactive aldehyde toxicity in V79-4 cells[J]. Toxicology in Vitro,2014,28(4):707-714.
[6]Zhang W,Li H,Yang Y,et al. Knockdown or inhibition of aldo-keto reductase 1B10 inhibits pancreatic carcinoma growth via modulating Kras-E-cadherin pathway[J]. Cancer Letters,2014,355(2):273-280.
[7]Ruiz F X,Moro A,Gallego O,et al. Human and rodent aldo-keto reductases from the AKR1B subfamily and their specificity with retinaldehyde[J]. Chemico-Biological Interactions,2011,191(1/2/3):199-205.
[8]Weng J,Cao Y,Moss N,et al. Modulation of voltage-dependent Shaker family potassium channels by an aldo-keto reductase[J]. Journal of Biological Chemistry,2006,281(22):15194-15200.
[9]Kumar D,Singh P,Yusuf M A,et al. The Xerophyta viscosa aldose reductase (ALDRXV4) confers enhanced drought and salinity tolerance to transgenic tobacco plants by scavenging methylglyoxal and reducing the membrane damage[J]. Molecular Biotechnology,2013,54(2):292-303.
[10]va C,Solti ,Oszvald M,et al. Improved reactive aldehyde,salt and cadmium tolerance of transgenic barley due to the expression of aldo-keto reductase genes[J]. Acta Physiologiae Plantarum,2016,38(4):1-10.
[11]代海艷,江 翱,李 伟. 黄鳝醛酮还原酶的羰基解毒作用初探[J]. 江苏农业科学,2017,45(1):150-152.
[12]Jez J M,Penning T M. The aldo-keto reductase (AKR) superfamily:an update[J]. Chemico-Biological Interactions,2001,130-132:499-525.
[13]Barski O A,Tipparaju S M,Bhatnagar A. The aldo-keto reductase superfamily and its role in drug metabolism and detoxification[J]. Drug Metabolism Reviews,2008,40(4):553-624.
[14]Mindnich R D,Penning T M. Aldo-keto reductase (AKR) superfamily:genomics and annotation[J]. Human Genomics,2009,3(4):362-370.
[15]Hintzpeter J,Martin H J,Maser E. Reduction of lipid peroxidation products and advanced glycation end-product precursors by cyanobacterial aldo-keto reductase AKR3G1-a founding member of the AKR3G subfamily[J]. FASEB Journal,2015,29(1):263-273.
[16]va C,Tóth G,Oszvald,et al. Overproduction of an Arabidopsis aldo-keto reductase increases barley tolerance to oxidative and cadmium stress by an in vivo reactive aldehyde detoxification[J]. Plant Growth Regulation,2014,74(1):55-63.
[17]Agrawal C,Sen S,Yadav S,et al. A novel Aldo-Keto reductase (AKR17A1) of Anabaena sp. PCC 7120 degrades the rice field herbicide butachlor and confers tolerance to abiotic stresses in E. coli[J]. PLoS One,2015,10(9):e0137744.石洪玥,陆 颖,卢正义,等. 不同盐度下5种中草药对2种水产动物致病菌的抑菌效果比较[J]. 江苏农业科学,2019,47(1):162-165.

