基于Wnt/β-catenin信号通路的艾拉莫德对白介素1β诱导的大鼠退变软骨细胞基质代谢的影响研究
彭杨茜子,孔瑞娜,张兰玲,赵东宝
本研究创新点:
本研究阐明艾拉莫德对白介素1β诱导软骨细胞基质代谢的影响,为今后研究艾拉莫德防治骨关节炎提供理论依据。关节软骨细胞的修复一直是骨关节炎疾病研究的热点,本研究揭示艾拉莫德可以通过调控Wnt/β-catenin信号通路,调控软骨细胞基质代谢,修复软骨损伤,为艾拉莫德增加抗骨关节炎的治疗作用。
骨关节炎(OA)是一种以关节软骨退行性变和继发骨质增生为特征的慢性关节疾病,其发病机制复杂。软骨细胞退变在OA发生、发展中起关键作用。近年来研究发现Wnt信号通路广泛存在于软骨细胞中,表现为异常活化的状态,从而影响软骨细胞的增殖和凋亡失衡[1]。Wnt/β-catenin信号通路是Wnt通路中最经典的信号通路,在Wnt/β-catenin信号通路中起着重要作用的蛋白有Wnt、β-catenin、Axin、Frz、糖原合成酶激酶3β(GSK-3β)及活化蛋白(APC)等。此通路下游基因和蛋白表达可影响关节软骨生长代谢,在OA发生、发展中起重要作用。艾拉莫德作为一种新的抗炎和免疫调节性质的小分子药物,不仅具有抗风湿药物(DMARDs)的免疫调节、抑制关节破坏功能,前期研究还证实艾拉莫德可以影响骨代谢[2-3],但尚未见艾拉莫德作用于软骨细胞相关机制的研究。本研究基于Wnt/β-catenin信号通路,从细胞、分子水平探讨艾拉莫德对白介素1β(IL-1β)诱导的大鼠OA软骨细胞基质代谢的影响及作用机制。
1 材料与方法
1.1 实验动物 2017年2—12月选取SPF级雄性2月龄健康Wistar大鼠10只,体质量约300 g,由上海市公共卫生临床中心实验动物中心提供。
1.2 主要试剂和仪器 RT2 First Strand Kit(QIAGEN)、Anti-β-catenin antibody〔艾博抗(上海)贸易有限公司〕、Anti-GSK-3βantibody〔艾博抗(上海)贸易有限公司〕、Anti-基质金属蛋白酶(MMP)-3 antibody〔艾博抗(上海)贸易有限公司〕、Anti-MMP-13 antibody〔艾博抗(上海)贸易有限公司〕、Anti-Ⅱ型胶原antibody〔艾博抗(上海)贸易有限公司〕、Anti-蛋白聚糖antibody〔艾博抗(上海)贸易有限公司〕、Anti-beta actin antibody〔艾博抗(上海)贸易有限公司〕、Trizol(美国英杰生命技术有限公司)、RNeasy mini kit(美国英杰生命技术有限公司)、Eclipse TE-2000U倒置显微镜〔尼康仪器(上海)有限公司〕、Labofuge 4008离心机〔赛默飞世尔科技(中国)有限公司〕、二氧化碳培养箱〔赛默飞世尔科技(中国)有限公司〕、Nanodrop 2000分光光度计〔赛默飞世尔科技(中国)有限公司〕、9700型实时荧光定量PCR仪(美国应用生物系统公司)。
1.3 方法
1.3.1 模型制备 将所有大鼠颈部脱臼处死后,取关节软骨组织,在超净工作台内以磷酸盐缓冲液(PBS)漂洗3次,刮取关节软骨层,剪切成约1 mm3碎块,放入0.25%胰蛋白酶37 ℃消化30 min,0.2%胶原酶37 ℃消化1 h,吸取上清用DMEM冲洗2次,1 500 r/min离心10 min,离心半径为10 cm,收集软骨细胞,以5×105个/瓶移入DMEM培养瓶(含10%胎牛血清),置于37 ℃、饱和湿度、5%CO2的细胞培养箱中。残余软骨颗粒继续消化,每1 h收集细胞1次,直至软骨组织块消化完全。将大鼠软骨细胞培养至第2代软骨细胞,予10 μg/L IL-1β的1%胎牛血清DMEM诱导处理24 h,获得退变软骨细胞模型。采用甲苯胺蓝染色法鉴定软骨细胞。
1.3.2 确定药物浓度 应用四甲基偶氮唑盐(MTT)法检测不同浓度的艾拉莫德、塞来昔布对大鼠软骨细胞活性的影响,从而确定药物浓度,具体方法参照MTT法试剂盒说明书,选择对细胞无明显毒性作用的0.3、3.0、30.0 μg/ml浓度梯度进行药物干预实验,软骨细胞经不同浓度药物处理72 h,最终确定药物浓度:艾拉莫德浓度梯度为10.0、1.0、0.1 μmol/L,塞来昔布浓度梯度为1.00、0.10、0.01 μmol/L。
1.3.3 干预及分组 将分离培养的软骨细胞分为12组:空白对照组、溶剂对照组、IL-1β组、艾拉莫德A组、艾拉莫德B组、艾拉莫德C组、塞来昔布A组、塞来昔布B组、塞来昔布C组、IL-1β+Dickkopf-1(DKK-1)组、艾拉莫德+DKK-1组、塞来昔布+DKK-1组。空白对照组不进行任何干预;除空白对照组外,其他组采用0.1%二甲基亚砜(DMSO)溶剂处理;除空白对照组、溶剂对照组外,其他组选用IL-1β诱导的退变软骨细胞模型;艾拉莫德A、B、C组分别采用10.0、1.0、0.1 μmol/L艾拉莫德处理;塞来昔布A、B、C组分别采用1.00、0.10、0.01 μmol/L塞来昔布处理;IL-1β+DKK-1组、艾拉莫德+DKK-1组、塞来昔布+DKK-1组均采用100 ng/ml的DKK-1处理;艾拉莫德+DKK-1组采用10.0 μmol/L艾拉莫德处理;塞来昔布+DKK-1组采用1.00 μmol/L塞来昔布处理。
1.3.4 指标测定 各组软骨细胞干预24 h后,培养0、12、24、48、72 h时,分别采用实时荧光定量反转录聚合酶链式反应(RT-qPCR)和Western blotting法检测各组β-catenin、MMP-13、Ⅱ型胶原a1(Col2a1)、GSK-3β mRNA和蛋白表达水平。
1.3.4.1 mRNA表达水平测定 从培养箱中取出细胞培养皿,弃去培养基,用预冷无菌PBS冲洗2次,采用Trizol法提取RNA,每10 cm平皿加入1 ml Trizol,室温放置5 min,并轻摇培养皿,用离心管吸取裂解液。用微量移液器吸取0.2 ml氯仿,轻摇混匀,室温放置5 min,4 ℃离心机,12 000 r/min离心15 min(离心半径为10 cm),用移液器吸取水相至新的离心管,重复上一步骤。加入0.5 ml异丙醇,轻摇混匀,室温放置10 min,4 ℃离心机,12 000 r/min离心15 min(离心半径为10 cm)后弃上清液,4 ℃预冷,加入1 ml的75%乙醇溶液〔含焦炭酸二乙酯(DEPC)水〕,7 500 r/min离心15 min(离心半径为10 cm)后弃上清液,重复上一步骤。根据沉淀的量加入20~100 μl的DEPC水融解RNA,-80 ℃保存备用。采用超微量分光光度计检测RNA浓度,选择测量RNA的界面,用DEPC水调整2次,擦镜纸擦净后加样本3 μl,出现数值后记录浓度和A260/A280值。采用凝胶电泳检测RNA完整性,1.2%琼脂糖凝胶电泳检测质量,出现两条电泳条带,即18S和28S rRNA,只要18S和28S rRNA带亮,且28S rRNA大约为18S rRNA的两倍,说明提取RNA未发生降解。按照试剂盒说明书合成cDNA,将制备好的cDNA进行RT-qPCR,RT-qPCR反应引物见表1。采用9700型实时荧光定量PCR仪进行扩增,反应条件:第一阶段95 ℃ 3 min;第二阶段95 ℃变性30 s、60 ℃退火34 s、72 ℃延伸60 s,共40个循环;第三阶段95 ℃15 s、60 ℃ 1 min、95 ℃ 15 s。各mRNA和内参分别进行RT-qPCR,每个样品重复3次,采用2-ΔΔCT法计算mRNA相对表达水平。
1.3.4.2 蛋白表达水平测定 采用Western blotting法测定蛋白表达水平。细胞消化离心后加入适量含蛋白酶抑制剂混合物的组织裂解液,冰上匀浆直至无可见组织块,冰上裂解20 min。悬液吸入离心管中,4 ℃离心机,12 000×g离心15 min,取上清液,-20 ℃保存备用。96孔板中加入不同浓度的蛋白标准品或按一定倍数稀释的样品10 μl,每个样品2个复孔,加入混合好的BCA反应液(A液:B液=50:1)200 μl,37 ℃孵育30 min。在570 nm波长检测光密度(OD)值,以标准品浓度和对应OD值绘制标准曲线,计算样品蛋白浓度。按照测定的蛋白浓度计算,取相同质量的总蛋白(每次实验20~50 μg),加入总体积1/5的5×蛋白上样缓冲液、总体积1/10的10×还原剂(DTT)、裂解液,各体积相等,混合均匀。100 ℃水浴10 min完全变性,冰上冷却后12 000×g离心15 min,取上清液进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶(PAGE)电泳,以80 V恒压电泳直至不同大小蛋白分子量分离可见,电压增加到120 V继续电泳直至上样缓冲液中的染料跑胶时停止。分离后转膜,浸入转膜缓冲液,以130 mA恒流半干转膜60 min,取出聚偏二氟乙烯(PVDF)膜,用TBST缓冲液漂洗1次,封闭液震荡封闭1 h。PVDF膜置于封闭液稀释的一抗中,4℃孵育过夜,用TBST缓冲液漂洗3次,10 min/次。PVDF膜置于封闭液稀释的辣根过氧化物酶(HRP)标记二抗中,室温孵育1 h,用TBST缓冲液漂洗3次,10 min/次。PVDF膜吸干多余液体,置于塑封膜上,滴加预先混合好的ECL发光底物,使液体覆盖均匀,盖上塑封膜,采用GeneGnome化学发光成像系统显示结果。

表1 RT-qPCR反应引物Table 1 RT-qPCR primer sequences
1.4 统计学方法 采用GraphPad Prism 5.0软件进行描述性统计学分析。
2 结果
2.1 IL-1β+DKK-1组与IL-1β组β-catenin mRNA、MMP-13 mRNA、Col2a1 mRNA表达水平比较 IL-1β组12、24、48、72 h的β-catenin mRNA表达水平高于0 h(见图1);MMP-13 mRNA表达水平12、24、48 h低于0 h,72 h时高于0 h(见图2);Col2a1 mRNA表达水平12、24、48 h低于0 h,72 h时高于0 h(见图3)。IL-1β+DKK-1组12、24、48、72 h的β-catenin mRNA表达水平均低于IL-1β组(见图1);IL-1β+DKK-1组0、12、24、48、72 h的MMP-13 mRNA表达水平均低于IL-1β组(见图2);IL-1β+DKK-1组12、24、48、72 h的Col2a1 mRNA表达水平均高于IL-1β组(见图3)。
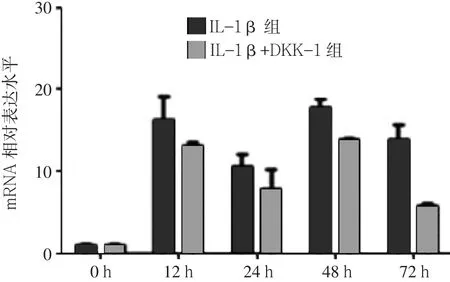
图1 IL-1β+DKK-1组与IL-1β组β-catenin mRNA表达水平Figure 1 Expression level of β-catenin mRNA inchondrocytes in IL-1β+DKK-1 group and IL-1βgroup
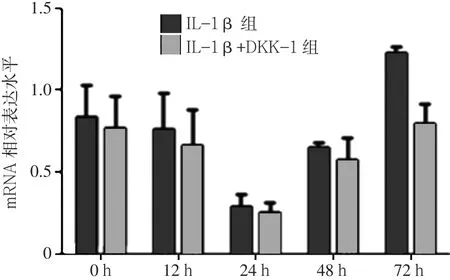
图2 IL-1β+DKK-1组与IL-1β组MMP-13 mRNA表达水平Figure 2 Expression levelof MMP-13 mRNA inchondrocytes in IL-1β+DKK-1 group and IL-1βgroup
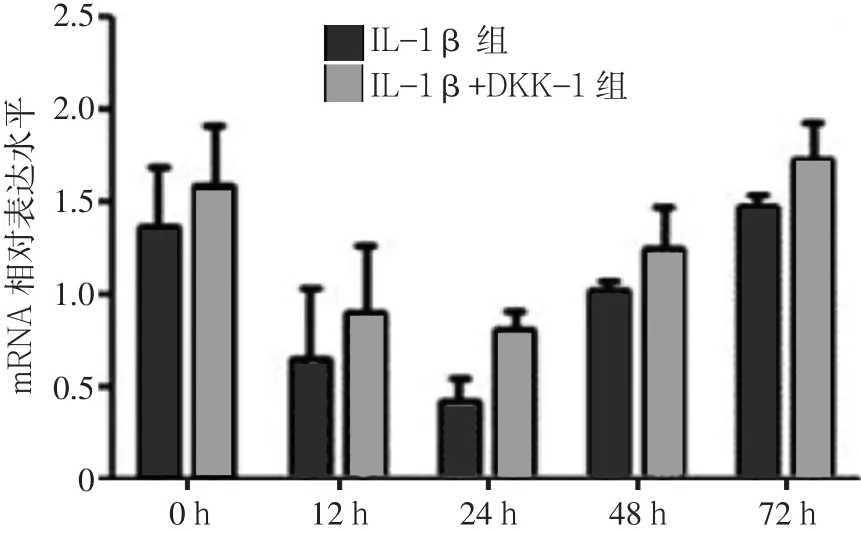
图3 IL-1β+DKK-1组与IL-1β组Col2a1 mRNA表达水平Figure 3 Expression level of Col2a1 mRNA inchondrocytes in IL-1β+DKK-1 group and IL-1βgroup
2.2 IL-1β+DKK-1组与IL-1β组β-catenin、MMP-13、Col2a1表达水平比较 IL-1β组0~48 h的β-catenin表达水平呈下降趋势,72 h β-catenin表达水平高于48 h;12 h的 MMP-13表达水平高于 0 h,12~72 h的MMP-13表达水平呈下降趋势;12 h的Col2a1表达水平高于0 h,12~72 h的Col2a1表达水平呈下降趋势;IL-1β+DKK-1组12、24、48、72 h的β-catenin 表达水平均低于IL-1β组;12、24、48、72 h的MMP-13表达水平均低于IL-1β组;12、24、48、72 h的Col2a1表达水平均高于IL-1β组(见图4)。
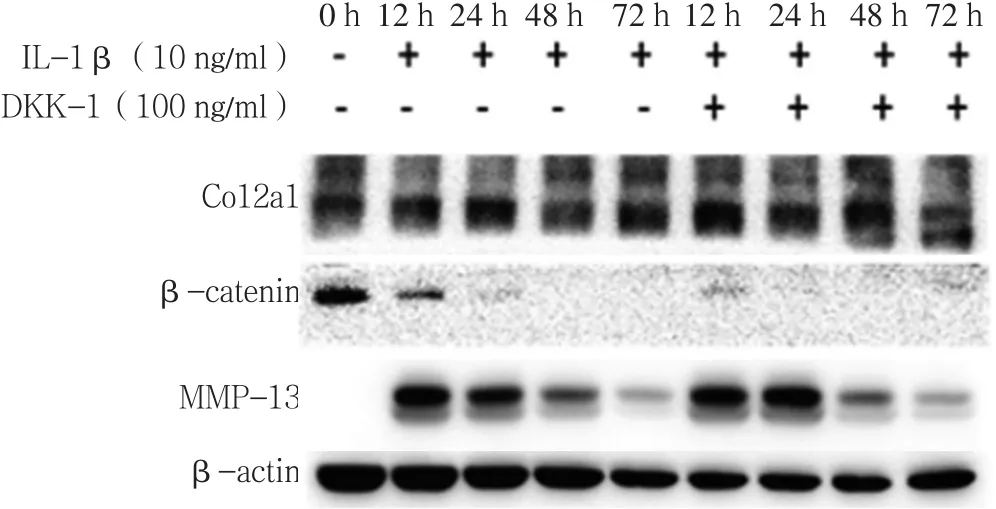
注:Col2a1=Ⅱ型胶原a1
2.3 不同药物组β-catenin mRNA、MMP-13 mRNA、Col2a1 mRNA、GSK-3βmRNA表达水平比较 加入试验药物艾拉莫德和塞来昔布24 h后,艾拉莫德A组、塞来昔布A组的β-catenin mRNA、MMP-13 mRNA表达水平均低于IL-1β组、IL-1β+DKK-1组,Col2a1 mRNA、GSK-3βmRNA表达水平均高于IL-1β组、IL-1β+DKK-1组。艾拉莫德+DKK-1组的β-catenin mRNA、MMP-13 mRNA表达水平均低于艾拉莫德A组,Col2a1 mRNA、GSK-3βmRNA表达水平高于艾拉莫德A组;塞来昔布+DKK-1组的β-catenin mRNA、MMP-13 mRNA表达水平低于塞来昔布A组,Col2a1 mRNA、GSK-3βmRNA表达水平高于塞来昔布A组(见图 5~8)。
2.4 不同药物组β-catenin、MMP-13、Col2a1、GSK-3β表达水平比较 加入艾拉莫德和塞来昔布24 h后,艾拉莫德A组、塞来昔布A组的β-catenin、MMP-13、Col2a1表达水平均低于IL-1β组、IL-1β+DKK-1组,GSK-3β表达水平高于IL-1β组、IL-1β+DKK-1组。艾拉莫德+DKK-1组的β-catenin、Col2a1、GSK-3β表达水平均高于艾拉莫德A组,MMP-13表达水平低于艾拉莫德A组;塞来昔布+DKK-1组的β-catenin、MMP-13、Col2a1 、GSK-3β表达水平均高于塞来昔布A组(见图9)。
3 讨论
OA是最常见的关节疾病,是成年人致残的主要原因,在关节病变中主要累及关节软骨,逐渐丧失软骨,并发生钙化、骨赘形成、软骨下骨重塑、滑膜轻中度炎症。目前的临床治疗药物多关注患者疼痛和功能恢复,而关于有无改善骨关节炎性细胞学特征方面研究较少。
目前,《骨关节炎诊疗指南(2018年版)》[4]根据病情不同程度建议:(1)行为干预,(2)对乙酰氨基酚,(3)非甾体消炎药包括环氧合酶(COX)-2抑制剂[5],(4)关节内注射透明质酸或糖皮质激素,(5)人工关节置换术。止痛药物包括阿片类药物和中枢作用药物如盐酸度洛西汀,但存在不良反应。
由于目前的治疗手段普遍疗效较差,未能满足目前的医疗需求,因此,临床上迫切需要靶点明确、疗效显著的治疗药物[6]。尽管促炎因子如IL-1β在体外可以模仿建立OA细胞模型,但抗细胞因子疗法并未被证实能有效治疗OA[7-8]。动物和细胞水平研究表明阻断MMP-13的表达能减轻软骨侵蚀[9-10],然而,直接抑制MMP等组织分解酶或信号通路的治疗可能有效,但存在不可预知的不良反应,临床应用受到限制[1,11]。
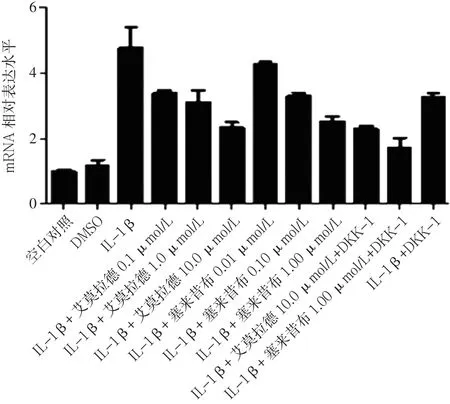
注:DMSO=二甲基亚砜
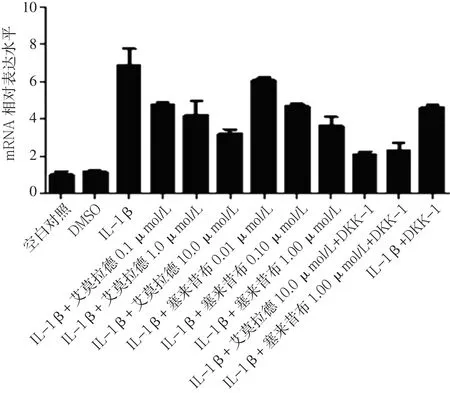
图6 不同药物组MMP-13 mRNA表达水平比较Figure 6 Expression levels of MMP-13 mRNA in chondrocytes in different groups after drug intervention
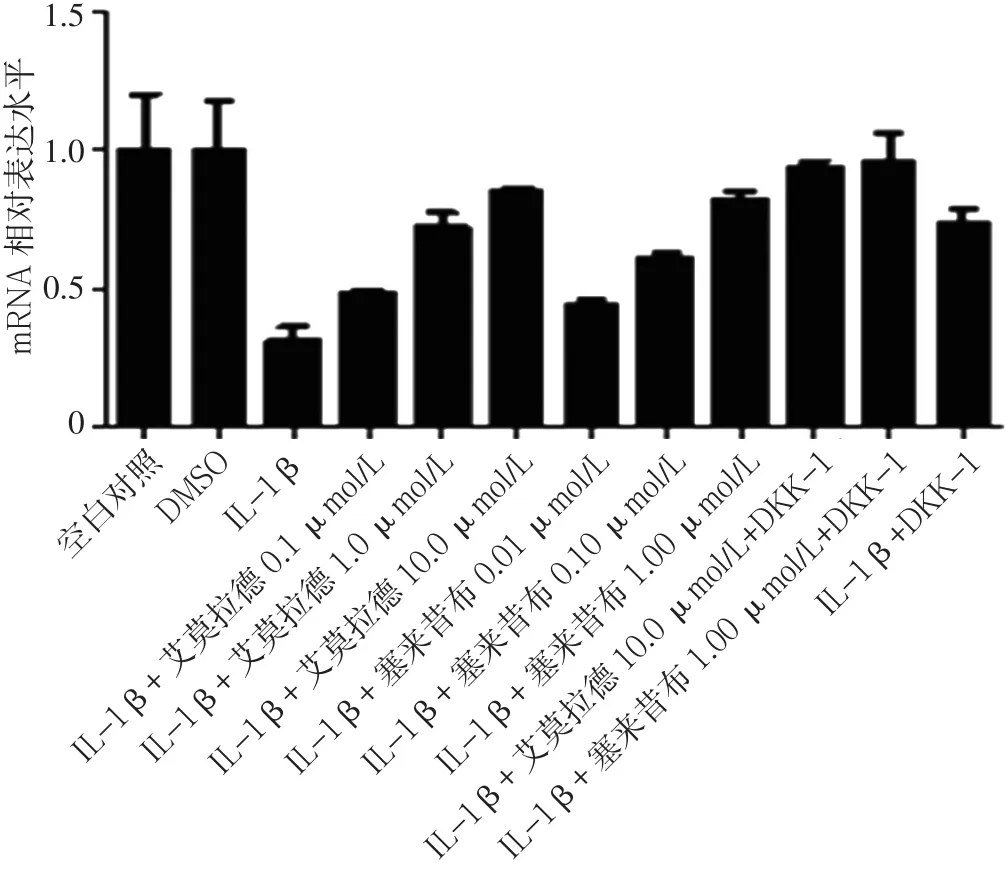
图7 不同药物组Col2a1 mRNA表达水平比较Figure 7 Expression levels of Col2a1 mRNA in chondrocytes in different groups after drug intervention
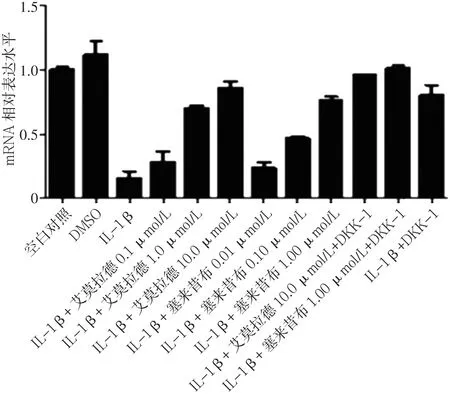
图8 不同药物组GSK-3βmRNA表达水平比较Figure 8 Expression levels of GSK-3βmRNA in chondrocytes in different groups after drug intervention
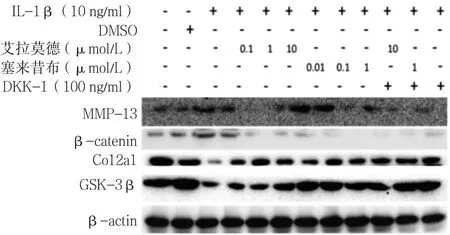
图9 不同药物组β-catenin、MMP-13、Col2a1、GSK-3β的表达Figure 9 Expression levels of β-catenin,MMP-13,Col2a1 and GSK-3βproteins in chondrocytes in different groups after drug intervention
Wnt/β-catenin信号通路在软骨和骨的发育和病理学中扮演重要角色。研究显示Wnt拮抗剂DKK-1和分泌型卷曲相关蛋白1(SFRP1)可以缓解关节软骨细胞肥大[2-3],全基因组关联研究已经确定了独特多态性编码SFRP1的FRZB基因与髋关节炎有关,可能通过抑制MMP,抑制血管内皮生长因子的产生,从而对OA软骨细胞产生一定的保护作用[12]。
骨硬化蛋白同样作为Wnt拮抗剂,最初确定为骨细胞特异性,目前发现在软骨和软骨组织中低水平表达。在OA患者和/或动物模型中,骨硬化蛋白作为抑制剂,可减少骨赘形成[13-14],但其也能导致半月板撕裂[15]。这些结果与Wnt配体在不同的组织中表达不一致有关[16],经典Wnt信号通路诱导或促进的Wnt3a/WISP1开关信号参与了转化生长因子β(TGF-β)/活化素受体样激酶1(ALK1)、Smad1/5/8[17]和机械负荷介导的骨硬化蛋白抑制[18]。此外,氯化锂可通过抑制GSK-3β使得β-catenin在胞内积聚,从而抑制手术引起的OA。
本研究结果提示IL-1β可以增强大鼠关节软骨细胞Wnt/β-catenin信号通路的表达,增加细胞基质合成和分解代谢能力。而DKK-1通过抑制Wnt/β-catenin信号通路减弱IL-1β对大鼠关节软骨细胞基质代谢的作用;大剂量艾拉莫德(10.0 μmol/L)和大剂量塞来昔布(1.00 μmol/L)均可以抑制IL-1β诱导的大鼠退变软骨细胞Wnt/β-catenin信号通路的表达,增加软骨细胞基质合成代谢,抑制软骨细胞分解代谢能力。而且这一作用在Wnt/β-catenin信号通路被抑制后仍存在,提示艾拉莫德和塞来昔布对IL-1β诱导的大鼠退变软骨细胞影响还存在其他作用机制,需要进一步研究。
本研究验证了IL-1β可诱导激活大鼠退变软骨细胞Wnt/β-catenin信号通路,加重软骨细胞损伤;Wnt/β-catenin信号通路抑制剂DKK-1阻断了这一作用;药物艾拉莫德、塞来昔布通过阻断Wnt/β-catenin信号通路,部分修复了软骨细胞合成和分解代谢功能,发挥了DKK-1类似的作用。软骨细胞退变过程主要反映了软骨细胞增殖和凋亡比例失衡,导致软骨组织损失难以恢复;所以还需要完善软骨细胞的增殖和凋亡能力检测,其不仅能体现软骨细胞损伤的严重程度,还可以验证药物对软骨细胞最终影响。本研究阐明了艾拉莫德对软骨细胞Wnt/β-catenin信号通路的调控作用,为今后研究艾拉莫德调节骨代谢作用开辟一条新途径。
作者贡献:孔瑞娜进行文章的构思与设计,研究的实施与可行性分析,数据收集;彭杨茜子进行数据整理,结果的分析与解释,撰写论文,论文的修订;张兰玲、赵东宝负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。

