联合肝脏分割和门静脉结扎的二步肝切除术术后早期复发原因的分析
金望迅 王兵 张云利 王新保 郭剑民 杜义安 杨建涛

[摘要] 目的 回顾性分析联合肝脏分割和门静脉结扎的二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy,ALPPS)后早期复发情况的原因。 方法 选取2014年6月~2016年6月接受ALPPS或射频消融辅助ALPPS(radiofrequency ablation assisted ALPPS,RALPPS)治疗的12例患者為研究对象。对患者的肝功能、Child-Pugh评分、病灶、肝脏分割程度、术后无病生存时间、总生存时间等指标进行回顾性分析。 结果 阶段-1 ALPPS后,FLR体积从(333.7±54.1)mL增加至(577.1±83.7)mL, 差异有统计学意义(P<0.001)。阶段-1和阶段-2之间的间隔为:完全性ALPPS为(10.0±1.6)d,部分性ALPPS为(31.3±5.2)d,差异有统计学意义(P<0.001)。术后90 d内死亡率为0%(0/12),Clavien-Dindo并发症分级为Ⅰ~Ⅲa。术后 3、6个月和12个月复发率分别为16.7%(2/12)、83.3%(10/12)和100.0%(12/12);平均DFS时间为(4.5±0.6)个月,平均生存时间为(9.0±0.7)个月,中位随访时间为11.0个月。 结论 ALPPS以及RALPPS术后患者易出现早期复发。手术创伤、部分性ALPPS过长的FLR再生时间、肝实质的不完全分割、肿瘤细胞的不完全消融等均可能是术后早期复发的原因。
[关键词] 门静脉栓塞;分期肝切除术;未来残余肝脏;肿瘤复发;ALPPS
[中图分类号] R735.7 [文献标识码] A [文章编号] 1673-9701(2019)16-0021-05
[Abstract] Objective To retrospectively analyze the causes of early recurrence after associating liver partition and portal vein ligation for staged hepatectomy (ALPSS). Methods 12 patients treated with ALPPS or radiofrequency ablation assisted ALPPS(RALPPS) during June 2014 to June 2016 were included. Liver function, Child-Pugh score, lesion, degree of liver segmentation, postoperative disease-free survival time, and overall survival time of patients were retrospectively analyzed. Results After ALPPS stage-1, the FLR volume increased from (333.7±54.1) mL to (577.1±83.7) mL, and the difference was statistically significant(P<0.001). The interval between stage-1 and stage-2 was(10.0±1.6) days for complete ALPPS and (31.3±5.2) days for partial ALPPS, and the difference was statistically significant (P<0.001). The mortality rate within 90 days after surgery was 0%(0/12), and the Clavien-Dindo complications were graded as Ⅰ-Ⅲa. The recurrence rates within 3, 6, and 12 months after surgery were 16.7% (2/12), 83.3% (10/12), and 100.0% (12/12) respectively;the mean DFS time was (4.5±0.6) months, and the mean survival time was (9.0±0.7) months, and the median follow-up time was 11.0 months. Conclusion Patients with ALPPS and RALPPS are prone to early recurrence. Surgical trauma, overlong FLR regeneration time after partial ALPPS, incomplete segmentation of liver parenchyma, and incomplete ablation of tumor cells may be the causes of early postoperative recurrence.
[Key words] Portal vein embolization; Staged hepatectomy; Future liver remnant; Tumor recurrence; ALPPS
大量肝切除术后未来残余肝脏(FLR)体积不足可引起术后肝功能衰竭(post-hepatectomy liver failure,PHLF)[1]。与门静脉栓塞术(portal vein occlusion, PVO)相比,联合肝脏分割和门静脉结扎的二步肝切除术(ALPPS)可更快地促进FLR再生并提高手术切除率[2-4],然而其肿瘤学预后却常被忽视。2014年6月~2016年6月,我科共有12例患者接受了ALPPS手术,回顾性分析显示所有患者术后出现早期复发。本文拟分析导致ALPPS术后早期复发的一些可能原因,并为改进该手术方式提供思路和参考,现报道如下。
1 资料与方法
1.1 一般资料
2014年6月~2016年6月,本科室共有12例患者接受ALPPS手术。纳入标准[2]:①年龄≤70岁;②无严重心肺肝肾等重要脏器功能不全;③Child-Pugh评分为5分或6分;④术前接受正电子发射计算机断层扫描(PET-CT)以排除远处转移;⑤经评估FLR体积不足,具体评估方法:患者术前接受肝脏薄层CT扫描,采集的图像经3D精确手术计劃和分析系统(杭州INCOOL医疗技术有限公司,中国杭州滨江区)计算FLR/总肝脏体积(total liver volume,TLV)比值;经评估FLR/TLV<30%的正常肝脏背景患者,FLR/TLV<40%的化疗后患者,FLR/TLV<50%的肝纤维化患者被认为FLR不足;⑥完整完成ALPPS的2个阶段手术,即阶段-1进行患侧肝脏门静脉结扎以及肝脏实质的分割,阶段-2完成肝脏切除;⑦对于接受过术前全身化疗的患者,其恢复期为2周或以上;⑧术前详细告知手术方案以及手术风险,并签署手术知情同意书。观测和分析的指标包括患者的性别、年龄、体重指数(body mass index,BMI)、肝功能、Child-Pugh评分、病灶情况、肝脏分割的方法和程度、并发症、无病生存时间和生存时间等。
1.2 手术方法
阶段-1 ALPPS步骤如下:患者接受全身麻醉后,行右侧肋缘下切口进腹,探查整个腹腔以排除肿瘤种植;超声检查评估肝脏质地及可能存在的转移病灶,评估门静脉血流方向,探查可能的肝外门静脉侧支循环。解剖肝门后,游离出门静脉右支以及肝IV段门静脉并进行结扎;沿左肝内叶以及左肝外叶之间进行肝脏分割。接受完全性ALPPS的患者,其肝脏使用电刀完全离断,直至暴露肝后下腔静脉前壁;接受部分性ALPPS的患者,其肝脏使用HabibR(HabibR4X双极切除装置,AngioDynamics,14 Plaza Drive,Latham,NY 12110)沿分割平面凝固约50%~80%的肝脏实质(radiofrequency ablation assisted ALPPS,RALPPS)。阶段-1术后每7~10 d进行CT扫描以监测FLR的再生情况;一旦FLR达到安全水平,即进行阶段-2术,步骤如下:麻醉以及切口选择同阶段-1手术,注意无瘤原则,仔细解剖,避免胆管的损伤以及出血。
1.3 术后管理和随访
术后48 h内使用抗生素预防切口感染,并给予胃肠外营养。根据Clavien-Dindo分类法记录并分析并发症[5]。根据50-50标准定义肝切除术后肝功能衰竭[6]。术后第一年每月随访一次,之后每3个月随访一次。随访检查项目包括体格检查、血常规、血生化、肿瘤标志物水平、胸腹部计算机断层扫描或磁共振成像。如怀疑有复发,必要时进行活检;一旦确认复发或转移,患者将再次接受MDT讨论,并给予合适的全身或局部治疗。
1.4 统计学方法
使用SPSS19.0统计软件(SPSS Inc.,Chicago,IL,USA)进行数据分析。计量资料以(x±s)表示,采用t检验或双样本Wilcoxon秩和(Mann-Whitney)检验来,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
12例患者中,女3例,男9例,平均年龄(51.4±9.0)岁,BMI为(22.6±1.4)kg/m2;肝脏肿瘤构成:结肠癌肝转移8例,原发性肝癌3例,肝内胆管细胞癌1例;肿瘤平均直径为(8.2±1.2)cm,其中6例患者肿瘤为多发,6例患者为单发;5例患者肿瘤累及肝内血管。术前情况:8例患者有既往腹部手术史,2例有肝脏肿瘤射频史,5例患者术前接受过化疗;Child-Pugh分级:A级11例,B级1例。超声检查提示所有患者的门静脉入肝血流均为向肝血流。Clavien-Dindo的并发症分级为Ⅰ~Ⅲa,所有患者均顺利出院。围手术期一般情况见表1、2。
2.2 FLR再生情况
阶段-1 ALPPS后,FLR体积从(333.7±54.1)mL增加至(577.1±83.7)mL,FLR/TLV从(27.3±4.2)%增加至(39.7±4.8)%(P<0.001)。完全性ALPPS组以及部分性ALPPS组FLR再生速度分别为(19.9±5.4)mL/d和(8.9±2.7)mL/d(P=0.020)。阶段-1 ALPPS和阶段-2 ALPPS之间的时间间隔为:完全性ALPPS为(10.0±1.6)d,部分性ALPPS为(31.3±5.2)d(P<0.001)。见表3。
2.3 患者无病生存时间以及总生存时间
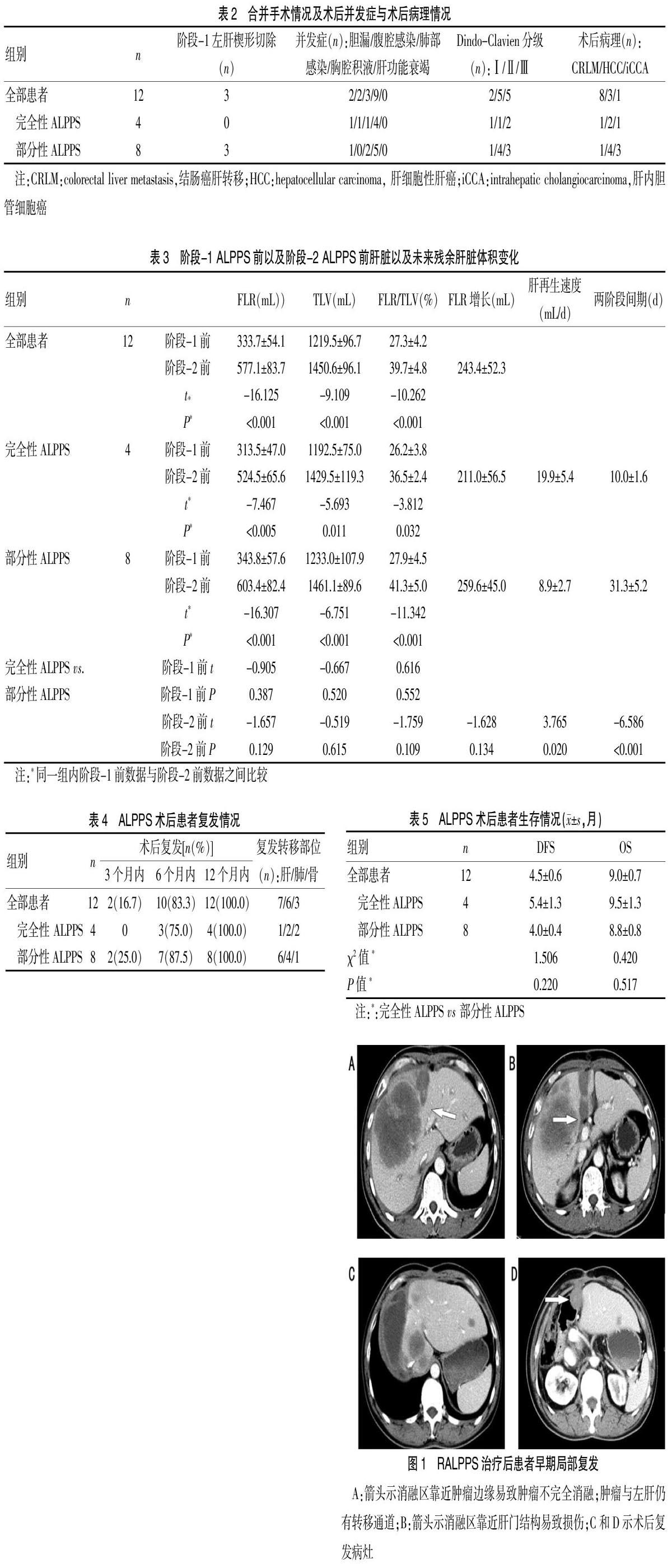
患者术后3个月、6个月和12个月复发率分别为16.7%(2/12),83.3%(10/12)和100.0%(12/12);Kaplan-Meier生存分析显示,12例患者的整体平均DFS时间为(4.5±0.6)个月;完全性ALPPS组以及部分性ALPPS组平均DFS时间分别为(5.4±1.3)个月以及(4.0±0.4)个月(P=0.220)。12例患者的整体平均OS时间为(9.0±0.7)个月;完全性ALPPS组以及部分性ALPPS组的平均OS时间分别为(9.5±1.3)个月及(8.8±0.8)个月(P=0.517),中位随访时间为11.0个月。见表4、5。复发及转移情况见图1~3。
3讨论
FLR不足是限制巨大肝癌患者进行肝切除术的主要原因;ALPPS可以快速促进FLR再生而提高切除率,然而其肿瘤学预后并未得到充分的评估。在本研究中,我们发现大多数接受ALPPS的患者在术后(4.5±0.6)个月内出现局部复发或远处转移,平均生存时间约9.0个月,这些结果与Adam,Calvien等[7-9]的报道相似。本文拟就ALPPS术后早期复发的一些可能因素进行分析。
包括ALPPS在內的手术操作可以促进肿瘤进展。首先,手术切除肿瘤时可促进肿瘤细胞的分散,并向血液和淋巴系统迁移[10]。虽然在进行ALPPS时强调不接触肝脏肿瘤,或通过射频消融进行离断(RALPPS)以减少对肿瘤的刺激和挤压,但是手术过程仍可以促进肿瘤细胞的分散和迁移。其次,原发肿瘤的切除可以促进远处隐匿的微小肿瘤病灶的生长[11]。第三,肿瘤患者处于免疫抑制状态,手术可以进一步加重机体的免疫抑制并促进肿瘤增殖[12,13]。Longbottom ER等[14]发现,大手术后患者的IL-6显著增加并出现免疫抑制;外周血液中自然杀伤(NK)细胞的活性和Tγδ淋巴细胞的百分比在大手术后显著降低[15,16]。此外,与手术相关的因素包括失血和输血、低体温、麻醉剂的使用等均可引发神经内分泌反应和免疫抑制,促进肿瘤的转移和进展[17]。ALPPS术在短时间内要进行2次创伤巨大的手术,无疑可以促进肿瘤的进展。
ALPPS术后入肝血流的改建可能促进了肿瘤的进展。由于肝动脉缓冲机制的存在[18],荷瘤侧门静脉的结扎可导致该侧肝动脉血流的增加,这极有可能会促进肿瘤的生长;因此,我们认为在阶段-1 ALPPS后将肿瘤留在原位而不切除是非常危险的。患侧门静脉的结扎会导致FLR一侧门静脉血流显著增加,如果此时FLR中存在微小的转移病灶,就会快速增殖[19,20]。我们的回顾性研究发现,有些患者在术后早期出现了多发的肝脏肿瘤病灶,而这些病灶极有可能是微小病灶快速进展所致(图1)。Dold等[21]在实验中发现,切除70%和90%肝脏后,残余肝组织内氧分压(pO2)显著下降,缺氧诱导因子-1α(HIF-1α)表达增加并促进了肿瘤的生长。在以后的研究中,应评估ALPPS后肝脏组织的血流量、营养供应、供氧和耗氧量以及相关生长因子(如HIF-1α等)的表达,并明确上述因素对肿瘤生长的影响。
热消融离断肝脏以及部分性ALPPS可能会促进肿瘤的转移。虽然使用热消融分割肝脏可以减少创伤,但是消融仍有可能促进肿瘤侵袭。消融离断肝脏时非常靠近肿瘤,可导致肿瘤周边区域的不完全消融,促进炎症介质的分泌并使肿瘤进展;这些炎症介质包括增殖细胞核抗原(PCNA)、基质金属蛋白酶9(MMP-9)、白细胞介素-6(IL-6)、肝细胞生长因子(HGF)和血管内皮生长因子(VEGF)等[22]。CT扫描(图1、图2)显示RALPPS操作过程中消融带非常靠近病灶,术后复发病灶沿分割平面分布,表明RALPPS有助于肿瘤在局部的复发和种植。部分性ALPPS(分割50%~80%的肝实质)保留着两侧肝脏之间的连接,并可能促进肿瘤通过肝内的血道转移(图1,图3);这一假设得到以下研究结果的支持:经动脉化疗栓塞联合PVO可以有效地阻断肿瘤从栓塞侧到未栓塞侧的转移[23]。本研究发现在促进FLR再生方面,完全性ALPPS为(10.0±1.6)d,部分性ALPPS为(31.3±5.2)d(P<0.001);部分性ALPPS需要更长的时间促进FLR再生,也使肿瘤有更多的生长和转移时间;因此需要采取一些可能的技术来改进部分性ALPPS,并在以后的研究中验证其效果(图3)。
该回顾性研究发现ALPPS及RALPPS可能促进了肿瘤的扩散,但是我们不能仅仅只看到该手术的缺点而忽略了其优势。对于ALPPS这种有革新意义的手术方式,我们需要在动物实验的基础上,不断对其进行改进,使其不仅能够快速有效地促进FLR的再生,而且能够降低肿瘤的复发和转移,最终改善患者的生存。
[参考文献]
[1] Clavien PA,Petrowsky H,DeOliveira ML,et al. Strategies for safer liver surgery and partial liver transplantation[J].N Engl J Med,2007,356:1545-1559.
[2] Tustumi F,Ernani L,Coelho FF,et al. Preoperative strategies to improve resectability for hepatocellular carcinoma:A systematic review and meta-analysis[J].HPB (Oxford),2018,20(12):1109-1118.
[3] Lauber DT,Tihanyi DK,Czigány Z,et al. Liver regeneration after different degrees of portal vein ligation[J].J Surg Res,2016,203:451-458.
[4] Giglio MC,Giakoustidis A,Draz A,et al. Oncological outcomes of major liver resection following portal vein embolization:A systematic review and meta-analysis[J].Ann Surg Oncol,2016,23:3709-3717.
[5] Clavien PA,Barkun J,De Oliveira ML,et al. The clavien-dindo classification of surgical complications:Five-year experience[J]. Ann Surg,2009,250:187-196.
[6] Balzan S,Belghiti J,Farges O,et al. The "50-50 criteria" on postoperative day 5:An accurate predictor of liver failure and death after hepatectomy[J].Ann Surg,2005, 242:824-828,discussion 828-829.
[7] Oldhafer KJ,Donati M,Jenner RM,et al. ALPPS for patients with colorectal liver metastases:Effective liver hypertrophy,but early tumor recurrence[J]. World J Surg,2014,38:1504-1509.
[8] Adam R,Imai K,Castro Benitez C,et al. Outcome after associating liver partition and portal vein ligation for staged hepatectomy and conventional two-stage hepatectomy for colorectal liver metastases[J]. Br J Surg,2016, 103:1521-1529.
[9] Olthof PB,Huiskens J,Wicherts DA,et al. Survival after associating liver partition and portal vein ligation for staged hepatectomy(ALPPS) for advanced colorectal liver metastases:A case-matched comparison with palliative systemic therapy[J]. Surgery,2017,161:909-919.
[10] Benish M,Ben-Eliyahu S. Surgery as a double-edged sword:A clinically feasible approach to overcome the metastasis-promoting effects of surgery by blunting stress and prostaglandin responses[J]. Cancers(Basel),2010,2:1929-1951.
[11] Biki B,Mascha E,Moriarty DC,et al. Anesthetic technique for radical prostatectomy surgery affects cancer recurrence:A retrospective analysis[J]. Anesthesiology,2008,109:180-187.
[12] Shakhar G,Ben-Eliyahu S. Potential prophylactic measures against postoperative immunosuppression:Could they reduce recurrence rates in oncological patients?[J].Ann Surg Oncol,2003,10:972-992.
[13] Goldfarb Y,Ben-Eliyahu S. Surgery as a risk factor for breast cancer recurrence and metastasis:Mediating mechanisms and clinical prophylactic approaches[J]. Breast Dis,2006-2007,26:99-114.
[14] Longbottom ER,Torrance HD,Owen HC,et al. Features of postoperative immune suppression are reversible with interferon gamma and independent of interleukin-6 pathways[J]. Ann Surg,2016,264:370-377.
[15] Gryglewski A,Szczepanik M. The effect of surgical stress on postoperative Tαβ and Tγδ cell distribution[J].Immunol Invest,2017,46:481-489.
[16] Vallejo R,Hord ED,Barna SA,et al. Perioperative immunosuppression in cancer patients[J].J Environ Pathol Toxicol Oncol,2003,22(2):139-146.
[17] Lo KK,Bey EA,Patra B,et al. Hemoglobin-based oxygen carrier mitigates transfusion-mediated pancreas cancer progression[J].Ann Surg Oncol,2013,20(6):2073-2077.
[18] Kollmar O, Corsten M, Scheuer C, et al. Portal branch ligation induces a hepatic arterial buffer response, microvascular remodeling, normoxygenation, and cell proliferation in portal blood-deprived liver tissue[J].Am J Physiol Gastrointest Liver Physiol,2007,292:G1534-1542.
[19] Al-Sharif E,Simoneau E,Hassanain M.Portal vein embolization effect on colorectal cancer liver metastasis progression:Lessons learned[J]. World J Clin Oncol,2015, 6:142-146.
[20] Kollmar O,Corsten M,Scheuer C,et al. Tumour growth following portal branch ligation in an experimental model of liver metastases[J].Br J Surg,2010,97:917-926.
[21] Dold S,Richter S,Kollmar O,et al. Portal hyperperfusion after extended hepatectomy does not induce a hepatic arterial buffer response(HABR) but impairs mitochondrial redox state and hepatocellular oxygenation[J]. PLoS One, 2015,10:e0141877.
[22] Ke S,Ding XM,Kong J,et al. Low temperature of radiofrequency ablation at the target sites can facilitate rapid progression of residual hepatic VX2 carcinoma[J].J Transl Med,2010,8:73.
[23] Okabe K,Beppu T,Masuda T,et al.Portal vein embolization can prevent intrahepatic metastases to non-embolized liver[J]. Hepato Gastroenterology,2012,59:538-541.
(收稿日期:2019-01-14)

