探究盐溶液酸碱性实验的反思与优化
胡 坤
(陕西省白河高级中学 陕西 白河 725800)
选修4探究盐水溶解的酸碱性实验,一般做法是用广泛pH试纸测出酸碱性。但在实际学考中还必须知道大致pH值相对大小,以便探究或印证“越弱越水解,越稀越水解”的规律。一般做法往往只能测出盐溶液大致的pH值,对于理科班来说还不够。因此很有必要对该实验进行反思改进。
温度恒定时盐水解时溶液酸碱性主要受水解程度和浓度的影响。为了同时印证“越弱越水解,越稀越水解”的规律,选择合适的浓度很重要。由于盐的水解程度一般都不大,故采取精度更高的数码酸度计测pH值,更好的区分不同盐水解性差异。考虑到实验中7种盐的溶解度,方便类比,都从1mol/L的浓度开始稀释。
实验用品:
仪器:百灵达牌袖珍pH计 广泛pH试纸 25ml量筒 烧杯
药品:1mol/L NaCl溶液 、1mol/L Na2CO3溶液、1mol/L NaHCO3溶液、1mol/L NH4Cl溶液、1mol/L Na2SO4溶液、1mol/LCH3COONa溶液、1mol/L(NH4)2SO4溶液、自制蒸馏水
实验环境:室温10℃,蒸馏水pH值为6.85,实验室自来水pH值为7.82。
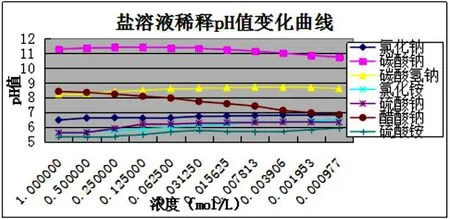
实验过程:用蒸馏水配制并逐倍稀释1mol/L的各盐溶液,分别用百灵达牌袖珍pH计和广泛pH试纸两种方法测量pH值并记录对比。最后绘制pH值变化曲线(下图)。原实验数据未呈现。
盐水解pH值计算近似公式:10℃ Kw=0.292×10-14pKw≈13.465 纯水pH= 6.73
一元弱酸强碱盐 pH=1/2(pKw+ pKa + lgC盐)
一元弱碱强酸盐 pH=1/2(pKw- pKb - lgC盐)
盐溶液极稀时水的电离占优势,盐溶液pH≈6.73(溶剂水的pH)
表1(计算所需常数)

表2(计算不同浓度盐溶液pH值)

实验结合理论计算可以发现,稀释过程中两者数据变化趋势基本吻合。通过分析总结可得出以下信息:
(1)盐水解较微弱,故溶剂水和盐溶液浓度对盐溶液pH值有一定影响。
(2)部分水解盐溶液pH值差别在1以内,广泛PH试纸无法满足要求。可考虑改用数码pH计或精密PH试纸测量。
(3)受pH计探头结构及测量原理局限,强酸强碱盐的溶液pH值一般不等于7。
(4 )为了使7种盐溶液的pH值有一定的区分度,浓度最好0.125mol/L至0.00781mol/L之间。本着节约环保的理念,浓度配小仍符合实验要求。总之不是越浓越好,越浓区分度越好。
(5)碳酸钠和碳酸氢钠溶液稀释曲线初始段可以说明越稀越水解。稀释初始阶段pH值有增大,显示水解作用优于稀释作用。
(6)类比碳酸钠、碳酸氢钠和醋酸钠可以明显的总结盐水解的另一条规律“越弱越水解”。
(7)稀释过程中曲线变化平缓说明水解盐溶液本身是一种较好的缓冲溶液,对稀释具有一定的缓冲作用。
(8)通过实验和理论计算,使人能更好的理解理论与实践的辩证关系。两者可以互相促进,最终推动科技不但发展前进。
总之《探究盐溶液的酸碱性》实验,若改用蒸馏水,控制好浓度,采用广泛PH试纸可以很好地满足高中化学选修4模块业考试要求;若改用蒸馏水,控制好浓度,采用pH计(或精密PH试纸)测量并能绘制7种盐溶液稀释pH值变化曲线图,会帮助学生深刻领悟盐水解规律,激发实验兴趣,培养学科探究能力。同时更好地为学生创设真实的化学实验情景,再现微观世界的动态平衡,平衡之间的对立与统一。

