多环芳烃胁迫菜心叶片上下表皮对其生理特性的影响
李朋欣 龙明华 乔双雨 唐璇 张会敏 梁勇生

摘要:以菜心为试验材料,设定对照(CK)与低、中、高4个不同的多环芳烃(polycyclic aromatic hydrocarbons,简称PAHs)浓度:0.0(CK)、0.3、0.6、0.9 mg/L,分别胁迫菜心叶片上表皮(A1处理)和下表皮(A2处理),比较不同浓度的PAHs及胁迫部位对菜心生理特性的影响。结果表明,A1、A2处理均使菜心株高降低,且随着处理浓度的增加,株高逐渐降低,A1处理比A2处理降低得更多。A1处理在高浓度PAHs处理下的叶绿素含量达到最大值,A2处理在低浓度PAHs处理下的叶绿素含量达到最大值。A1、A2处理的丙二醛(MDA)含量增加,且在中、高浓度下,A2处理比A1处理的MDA含量增加得更多。A1处理的可溶性蛋白含量有所增加,A2处理的中、低浓度可溶性蛋白含量有所减少,但与对照组相比无明显差异。A1、A2处理的过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)活性均降低,且A2处理比A1处理的APX活性降低得更为明显,A1、A2处理的过氧化氢酶(CAT)活性均增高。由结果可知,在不同浓度的PAHs和不同胁迫部位处理下,菜心的株高均降低,叶表比叶背处理降低得更多;用0.0~0.9 mg/L PAHs处理叶表和叶背,对菜心叶片叶绿素含量均有促进作用。中、高浓度PAHs处理叶背比处理叶表的MDA含量增加得更多。PAHs处理对菜心可溶性蛋白含量无明显影响。总体看出,在PAHs处理下,POD、APX活性降低,CAT活性提高,且处理叶背的APX活性降低得更为明显。
关键词:多环芳烃;菜心;上表皮;下表皮;生理特性
中图分类号: TQ450.1+2文献标志码: A
文章编号:1002-1302(2019)09-0175-04
多环芳烃(polycyclic aromatic hydrocarbons,简称PAHs)是一类分子中包含2个及2个以上苯环的碳氢化合物的总称,是有机物在没有充分燃烧的条件下产生的,它是当前自然环境污染与食品污染的罪魁祸首之一[1-3]。1979年美国环境保护局发布的129种优先监测的污染物中,就有16种是PAHs[4-7]。PAHs在环境中难以降解,由于它们具有半挥发性、脂溶性特点,因而可以通过大气沉降作用经过植物叶片进入植物体内或者进入土壤中被植物根系吸收,并在植物体内迁移、代谢和积累,进而通过食物链危害人们的身体健康[8]。疏水性较强且亨利系数>10-4的有机污染物易从土壤中挥发至空气中,进而通过叶面吸收进入植物体内[9]。叶片对大气中PAHs的吸收主要是通过蜡状叶表面对大气沉降物中颗粒态PAHs的摄取或者叶片角质层和气孔对气态PAHs的吸收进行的[10-11]。Howsam等研究发现,植物叶片中的脂肪含量与叶表皮的蜡质对亲脂性PAHs的富集具有重要影响[12]。
目前,国内外的研究多集中在PAHs的环境行为方面,关于PAHs对蔬菜影响的研究较少。菜心(Brassica campestris L. ssp. chinensis var. utilis Tsen et Lee)在我国华南地区分布较广,本试验拟研究不同浓度PAHs胁迫菜心叶片上表皮、下表皮对菜心生理特性的影响,分析上表皮、下表皮吸收PAHs量的不同而导致菜心生理特性的差异,以期为评估菜心叶片上表皮、下表皮分别吸收PAHs后的生理特征响应变化提供一些基础数据,从而为菜心乃至蔬菜PAHs污染物的防治提供理论依据。
1 材料与方法
1.1 试验材料
采用广州市爱普农农业科技有限公司研制的超纯种501柳叶油绿甜菜心品种为供试材料。选用广州大观农化科技有限公司生产的泥炭作为基质。营养液配方参考华南农业大学研究得出的叶菜类营养液配方[13]。PAHs混合液选用16种PAHs中的5种:萘(NAP)、菲(PHE)、荧蒽(FLA)、苯并(a)蒽(BaA)、苯并(a)芘(BaP)。10 mg/L PAHs混合液的配制方法如下:用精确度为0.1 mg的电子天平分别称取 0.002 0 g 萘、菲、荧蒽、苯并(a)蒽、苯并(a)芘,加入丙酮进行充分溶解并定容至1 L,将配制好的PAHs混合液装入棕色瓶中密封保存,并放入4 ℃冰箱中保存备用,使用时稀释成0.3、0.6、0.9 mg/L浓度的溶液,以蒸馏水为对照。
1.2 试验方法
2017年2月22日将超纯种501柳叶油绿甜菜心播种于广西大学农学院蔬菜基地的温室大棚中,采用穴盘育苗。待菜心幼苗长至2叶1心时,定植于上口直径15 cm、下口直径13 cm、高16 cm的塑料花盆中,每盆种3株,采用盆栽基质栽培,浇灌营养液。以后每7 d浇灌1次营养液,其他管理措施与常规栽培措施相同。3月31日用不同浓度的PAHs混合液分别对菜心叶片上表皮(A1处理)和下表皮(A2处理)进行涂抹处理。隔2 d处理1次,共处理3次,每个处理设3个重复。
1.3 指标测定
最后1次处理完成后,第3天进行株高的测定。之后采集菜心的地上部分带回实验室,用清水清洗叶片表面并用滤纸吸干表面的水分。根据所测定生理指标的需要,分别称取叶片鲜样并用锡箔纸包好,用液氮迅速冷却后,置于-40 ℃冰箱中保存备用。
叶绿素含量采用丙酮提取法[14]测定,可溶性蛋白含量采用考马斯亮蓝G-250染色法[14]测定,丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法[15]测定,过氧化物酶(POD)活性采用氧化愈创木酚法[15]测定,过氧化氢酶(CAT)活性采用紫外分光光度法[15]測定,抗坏血酸过氧化物酶(APX)活性采用Nakano等的方法[16]测定。每个处理重复测定3次。
1.4 数据分析
试验数据采用Excel 2003进行计算并制图,根据制作的折线图进行数据结果的分析。
2 结果与分析
2.1 PAHs胁迫对菜心株高的影响
由图1可以看出,随着PAHs处理浓度的增加,菜心的株高逐渐降低,A1处理组的株高在不同PAHs浓度下分别比对照组(CK)下降了5.36%、6.92%、7.59%,A2处理组的株高分别下降了5.01%、5.16%、6.92%,说明PAHs胁迫浓度越高,对株高的抑制作用越强,A1处理组的株高比A2处理组下降得更多,说明用PAHs处理上表皮比处理下表皮对菜心株高的抑制作用更强。处理组与对照组相比株高均明显下降,各处理组间无明显差异。
2.2 PAHs胁迫对菜心叶绿素含量的影响
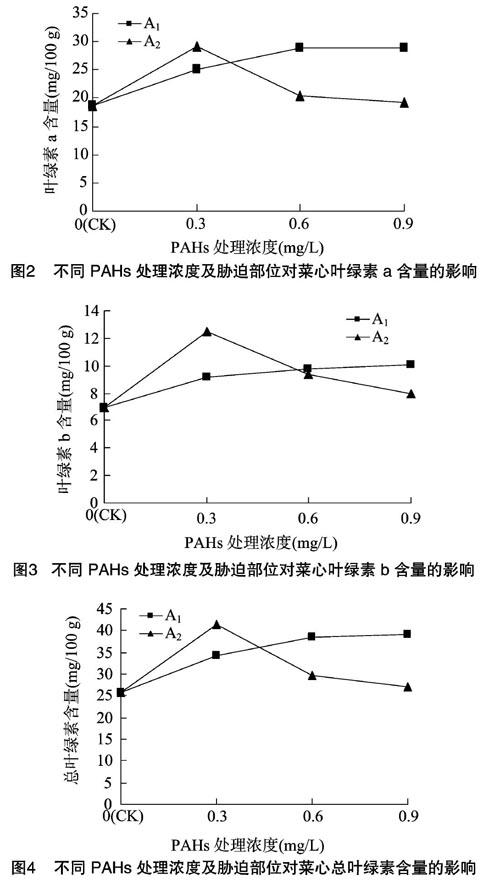
由图2、图3、图4可以看出,菜心叶片中的叶绿素a含量比叶绿素b含量高;随着PAHs处理浓度的增加,A1处理组的叶绿素a、叶绿素b、总叶绿素含量都有上升的趋势,在用 0.9 mg/L PAHs处理时,叶绿素a、叶绿素b、总叶绿素含量达到最大值,分别比对照组升高了55.07%、44.19%、52.05%,并且在中浓度和高浓度处理之间无明显差异。A2处理组的叶绿素a、叶绿素b、总叶绿素含量都呈现先上升后下降的趋势,在 0.9 mg/L PAHs处理下,叶绿素含量仍高于对照组,在 0.3 mg/L PAHs处理下,叶绿素含量达到最大值,分别比对照组升高了55.76%、79.63%、62.19%。以上结果说明,用 0.3~0.9 mg/L PAHs处理菜心叶片上表皮、下表皮,对菜心叶片叶绿素的含量都有促进作用。
2.3 PAHs胁迫对菜心丙二醛含量的影响
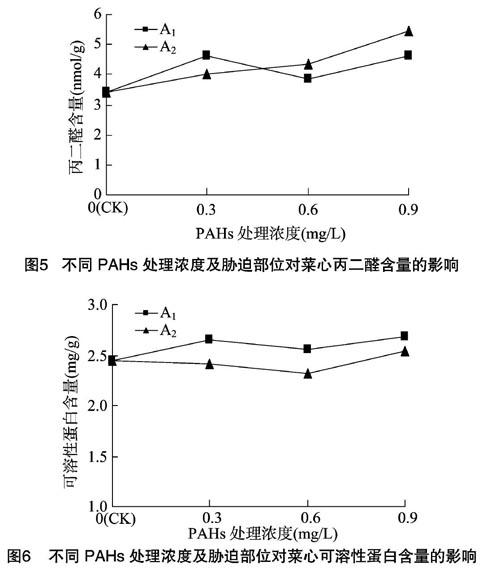
丙二醛是膜脂过氧化作用最重要的产物之一,其含量在一定程度上反映了膜系统的受损程度及植物的抗逆性。由图5可以看出,与对照组相比,A1处理组的丙二醛含量增加,且低浓度PAHs处理组明显高于对照组,比对照组提高了 35.67%。随着PAHs浓度的增加,A2处理组的丙二醛含量逐渐增加,高浓度PAHs处理组的丙二醛含量比对照组提高了59.06%。以上结果表明,在不同胁迫部位和不同PAHs浓度处理下,菜心叶片的丙二醛含量都增加了,可见用低浓度PAHs处理叶片上表皮和用高浓度PAHs处理叶片下表皮会对叶片的膜系统产生较大伤害。
2.4 PAHs胁迫对菜心可溶性蛋白含量的影响
植物體内的可溶性蛋白大多是参与各种代谢活动的酶类,其含量是反映植物总体代谢活动的重要指标之一。由图6[CM(25*8]可以看出,与对照组相比,A1处理组的可溶性蛋白含量均
有增加,低、高浓度PAHs处理的可溶性蛋白含量分别比对照组提高了8.61%、9.84%。A2处理组的低、中浓度PAHs处理的可溶性蛋白含量低于对照组,0.6 mg/L PAHs组较对照下降了5.32%。由以上结果可知,用PAHs处理菜心叶片上表皮,可以使菜心叶片的可溶性蛋白含量增加,从而使植物总体代谢活动增强。
2.5 PAHs胁迫对菜心POD活性的影响
由图7可以看出,A1、A2处理组的POD活性与对照组相比都有所下降。当A1处理组的PAHs浓度分别为0.3、0.6、0.9 mg/L时,POD活性分别比对照组下降了46.17%、45.87%、50.18%,低、中浓度处理组之间差异不明显。A2处理组中的PAHs浓度为0.6 mg/L处理组的POD活性最低,比对照组下降了47.27%,而高浓度PAHs处理组的POD活性比对照组下降了29.50%,说明用PAHs胁迫菜心叶片上表皮、下表皮后,均使菜心的POD活性降低。与其他处理组相比,用 0.9 mg/L PAHs处理菜心叶片下表皮后,POD活性有所提高。
2.6 PAHs胁迫对菜心CAT活性的影响
由图8可以看出,A1的低浓度、高浓度PAHs处理组的CAT活性均明显高于对照组,分别比对照组提高了 42.22%、34.41%,与对照组相比,中浓度PAHs处理组的CAT活性略微上升,但是差异不明显。A2处理组的CAT活性先升高后下降,在0.6 mg/L PAHs处理下的CAT活性达到最大值,比对照组提高了65.80%,且在此浓度下,A1、A2处理组间的CAT活性差异最明显。分析以上结果可知,用低浓度和高浓度PAHs胁迫菜心叶片上表面,可以使叶片的CAT活性增强;用0.6 mg/L PAHs胁迫菜心叶片下表面,对菜心CAT活性的促进作用最强。
2.7 PAHs胁迫对菜心APX活性的影响
由图9可以看出,A1、A2处理组的APX活性明显低于对照组,且A2处理组比A1处理组的APX活性下降得更多。A1的中浓度PAHs处理的APX活性最低,比对照组降低了49.30%,低、高浓度PAHs处理之间差异不明显。A2处理组中,低浓度PAHs处理的APX活性最低,比对照组下降了63.38%,随着处理浓度的增加,APX活性有升高的趋势。
3 结论与讨论
植物叶片的表皮可以分为上表皮和下表皮,植物叶片表皮由角质层覆盖,起着保护叶片和降低水分挥发损失的作用,一般上表皮具有比下表皮更厚的角质层。角质层由角质和覆盖于角质上的蜡质共同构成[17]。植物的角质层在化学组成上主要是一些脂肪物质,这些囤积于叶片表面的脂肪物质是挥发半挥发性有机污染物进入植物体内的主要途径[18]。由此可知,植物叶片上表皮含有的脂肪物质比下表皮的多,叶片上表皮吸收的挥发、半挥发性有机污染物比下表皮的多。植物叶片上也分布着较多的气孔,一般而言阳生植物叶片的下表皮上有较多的气孔,有机污染物也可以通过气孔途径进入植物体内[17]。大多数挥发、半挥发性有机污染物主要通过角质层被吸收进入植物叶片中,通过气孔吸收的量微不足道[19-20]。Barber等研究发现,角质层较难穿透,且气孔密度较高时,气孔的吸收途径相对重要;而当角质层极易穿透时,气孔的作用几乎为零[21]。
本研究分析了用不同浓度PAHs胁迫菜心叶片上下表皮对菜心生理特性的影响。结果表明,PAHs胁迫对菜心株高有一定的抑制作用,随着浓度的增加,菜心株高逐渐降低。处理叶片上表皮比处理叶片下表皮對菜心株高的降低作用更大,可能是由于菜心叶片上表皮比下表皮含更多的脂肪,吸收的PAHs较多,因而对株高的抑制作用更强。用高浓度PAHs处理叶片上表皮和用低浓度PAHs处理叶片下表皮对菜心叶片叶绿素a、叶绿素b、总叶绿素含量均有明显的促进作用,当处理叶片下表皮的PAHs浓度在0.3 mg/L以上时,叶绿素含量有下降趋势,而叶片上表皮处理组的叶绿素含量仍然升高,说明在一定的PAHs浓度范围内,处理上表皮比处理下表皮使菜心叶片叶绿素含量增加得更多。
用不同浓度PAHs处理菜心叶片上表皮和下表皮,均使菜心叶片内的MDA含量增加,导致叶片膜脂过氧化,并且用PAHs处理菜心叶片下表皮时,随着处理浓度的增加,膜脂过氧化增强,膜受损伤的程度增强。可溶性蛋白具有较强的亲水胶体性质,能够影响细胞的保水力,植物可以通过可溶性蛋白的主动积累来降低渗透势,进行渗透调节[22]。在菜心叶片上表皮、下表皮分别受到PAHs胁迫后,处理叶片上表皮的菜心可溶性蛋白含量有所增加,处理下表皮的则相反。可能由于上表皮细胞受到胁迫后,细胞渗透势增强,可溶性蛋白含量增加而降低了其渗透势。
当植物处于逆境条件时,会导致活性氧在体内的过量积累,从而对植物造成伤害。而植物体为了保护自身免受活性氧的伤害,形成了内源保护系统,包括植物细胞膜的酶保护系统、非酶抗氧化剂[23]。本研究表明,菜心叶片上表皮、下表皮受到PAHs胁迫后,叶片中的POD、APX活性均降低,并且处理下表皮比处理上表皮后APX活性降低得更明显,原因可能是在逆境环境下,菜心叶片中的POD、APX作用于PAHs胁迫产生的H2O2,将其转化为其他活性较低的物质,从而使植株能够正常生长,且下表皮受到PAHs胁迫后,APX发挥保护机体的作用更加明显。用PAHs处理菜心叶片上表皮和下表皮均使CAT活性提高,且处理下表皮的CAT活性先升高后降低,说明用0.0~0.6 mg/L PAHs处理菜心下表皮对CAT的活性有一定的促进作用,而高浓度PAHs使CAT蛋白受到了破坏或产生了抑制作用。
参考文献:
[1]申进朝,多克辛,王 伟,等. 土壤中16种多环芳烃测定的准确度控制指标研究[J]. 环境科学与技术,2012,35(12):142-145.
[2]李春丽,李 杰,明 红. 三重四极杆气质联用法(TSQ8000)测定食品包装材料中16种多环芳烃[J]. 中国食品,2013(7):74-77.
[3]张朝青,邢 雁,余 雷. 高效液相色谱法测定水源中苯并芘的方法研究[J]. 广东化工,2014,41(8):151-152,146.
[4]Baran S,Bielińska J E,Oleszczuk P. Enzymatic activity in an airfield soil polluted with polycyclic aromatic hydrocarbons[J]. Geoderma,2004,118(3):221-232.
[5]Blasco M,Domeo C,Nerín C. Use of lichens as pollution biomonitors in remote areas:comparison of PAHs extracted from lichens and atmospheric particles sampled in and around the Somport Tunnel (Pyrenees)[J]. Environmental Science & Technology,2006,40(20):6384-6391.
[6]孙治军,马 丽,张 民,等. 山东主要果园土壤的粘土矿物组成及其吸附特性[J]. 水土保持学报,2007,21(3):57-60.
[7]Oleszczuk P,Baran S. Polycyclic aromatic hydrocarbons content in shoots and leaves of willow (Salix viminalis)cultivated on the sewage sludge-amended soil[J]. Water Air and Soil Pollution,2005,168(1/2/3/4):91-111.
[8]殷 婧,夏忠欢,周彦池,等. 临汾市售蔬菜中多环芳烃污染特征及致癌风险分析[J]. 生态毒理学报,2016,11(3):265-271.
[9]Ryan J A,Bell R M,Davidson J M,et al. Plant uptake of non-ionic organic chemicals from soils[J]. Chemsphere,1988,17(1):2299-2323.
[10]Paterson S,Mackay D,Tam D,et al. Uptake of organic chemicals by plants:a review of processes,correlation and models[J]. Chemsphere,1990,21(3):297-331.
[11]Lehndorff E,Schwark L. Biomonitoring of air quality in the Cologne conurbation using pine needles as a passive sampler - Part Ⅱ:polycyclic aromatic hydrocarbons (PAH)[J]. Atmospheric Environment,2004,38(23):3793-3808.
[12]Howsam M,Jones K C,Ineson P. PAHs associated with leaves of three deciduous tree species.Ⅰ- Concentrations and profiles[J]. Environmental Pollution,2000,108(3):413-424.
[13]刘士哲. 现代实用无土栽培技术[M]. 北京:中国农业出版社,2001:176.
[14]张志良,瞿伟菁,李小芳. 植物生理学实验指导[M]. 北京:高等教育出版社,2009:69.
[15]路文靜,李奕松. 植物生理学实验教程[M]. 北京:中国林业出版社,2012.
[16]Nakano Y,Asada K. Hydrogen peroxide is scavenged by ascorbate-apecific peroxidase in spinach chloroplasts[J]. Plants and Cell Physiolog,1981,22(5):867-880.
[17]Kipopoulou A M,Manoli E,Samara C. Bioconcentration of polycyclic aromatic hydrocarbons in an industrial area[J]. Environmental Pollution,1999,106(3):369-380.
[18]杨振亚. 植物吸收积累多环芳烃的过程、机理及预测模型[D]. 杭州:浙江大学,2006.
[19]Riederer M. Estimating partitioning and transport of organic chemicals in the foliage/atmosphere system:discussion of a fugacity-based model[J]. Environ Sci Technol,1990,24(2):829-837.
[20]McLachlan M S,Welsch-Pauch K,Tolls J. Field validation of a model of the uptake of gaseous SOC in Lolium multiflorum (rye grass)[J]. Environ Sci Technol,1995,29(5):1998-2004.
[21]Barber J L,Kurt P B,Thomas G O,et al. Investigation into the importance of the stomatal pathway in the exchange of PCBs between air and plants[J]. Environ Sci Technol,2002,36(2):4282-4287.
[22]汪月霞,索 标,赵会杰,等. Na2CO3胁迫对芦荟幼苗叶片叶绿体保护酶和渗透调节物质的影响[J]. 西北植物学报,2010,30(11):2184-2190.
[23]潘瑞炽. 植物生理学[M]. 北京:高等教育出版社,1958:182.

