1株耐高温纤维素酶产生菌的分离与鉴定
吴孔阳 李婉婉 杨同香 杜如月 杨娆

摘要:从环境样品中筛选得到1株耐高温纤维素酶产生菌A13。形态及生理生化特征测定结果表明,A13菌株与芽孢杆菌属(Bacillus)中地衣芽孢杆菌(Bacillus licheniformis)的特征基本一致。测定了该菌株的16S rDNA序列并根据16S rDNA构建了系统发育树,在系统发育树中,A13菌株与地衣芽孢杆菌形成一个类群,序列同源性为90%。最终确定该菌株为地衣芽孢杆菌。
关键词:耐高温;产纤维素酶菌株;分离;形态学鉴定;分子生物学鉴定;系统发育树
中图分类号: S182文献标志码: A
文章编号:1002-1302(2019)09-0312-03
当煤、石油等不可再生资源逐渐短缺甚至枯竭时,资源便成了全球共同面临的重大问题。纤维素是最丰富的有机物质,是地球上最广泛最丰富的自然资源和可再生资源之一[1],每年纤维素的产量都高达2 000亿t,但是纤维素难以被分解利用,不仅不能更好地为人类所用,反而还会造成浪费甚至导致环境污染。自1906年纤维素酶在蜗牛消化道内被发现以来,学术界开始普遍采用微生物去降解纤维素[2]。纤维素酶不是单一成分的酶,而是一类复杂的复合物,是由多种酶协同起作用的多酶体系,能够将纤维素降解为葡萄糖[3],因此在纤维素酶的作用下降解纤维素不仅可以为全球的能源供应作出贡献,同时还能有效解决废弃物处理等一系列问题[4]。
纤维素酶产生菌得到学术界的广泛研究,仅被记录在Swiss Protein数据库中的纤维素酶氨基酸序列就已经达到649条,基因序列共有433条[5],但是从微生物中筛选出的产纤维素酶菌株的产酶能力低且热稳定性较差,真正高产的微生物菌株相对较少,纤维素酶的生产依旧处于高成本低产量的状态,纤维素酶产生菌的选育依然是今后研究的一个重要方向。本研究拟从环境样品中分离筛选产纤维素酶菌株,并对其进行形态学和分子生物学鉴定,以期能够得到1株耐高温的产纤维素酶菌株,为相关基础研究提供相应的参考。
1 材料与方法
1.1 材料
1.1.1 样品 试验用样品采集自生活污泥堆肥。
1.1.2 培养基
纤维素分离培养基:酵母粉5.0 g/L,羧甲基纤维素钠(CMC-Na)10.0 g/L,蛋白胨10.0 g/L,NaCl 5.0 g/L,琼脂20.0 g/L,MgSO4 0.2 g/L,KH2PO4 1.0 g/L,115 ℃ 灭菌30 min。葡萄糖蛋白胨水培养基:蛋白胨 0.5 g/L,K2HPO4 0.2 g/L,葡萄糖0.5 g/L,pH值7.2~7.4。吲哚产生试验培养基:牛肉膏3.0 g/L,NaCl 5.0 g/L,胰蛋白胨10.0 g/L,pH值7.0~7.2,121 ℃灭菌20 min。柠檬酸盐利用试验培养基:MgSO4 0.2 g/L,柠檬酸钠2.0 g/L,(NH4)2HPO4 1.0 g/L,琼脂15.0 g/L,NaCl 5.0 g/L,1%溴百里香酚蓝水溶液10.0 g/L,pH值6.8~7.0,115 ℃灭菌20 min。
1.1.3 主要试剂
葡萄糖、四水酒石酸钠、3、5-二硝基水杨酸、苯酚、无水亚硫酸钠、羧甲基纤维素钠、无水乙醇、刚果红、NaCl、溴甲酚紫指示剂、甲基红、乙醚、吲哚等均为国产分析纯。
1.2 方法
1.2.1 菌株分离
用电子天平准确称取5 g采集的样品加入到烧杯中,同时向烧杯中加入45 mL无菌水,然后把烧杯放置于沸水中水浴处理10 min,将处理过的烧杯放在130 r/min的摇床培养箱中振荡培养30 min,取20 μL振荡培养后的悬液,用移液枪涂布到新的纤维素分离培养基中,最后将培养基倒置于37 ℃恒温培养箱中培养18~22 h。待培养基中长出菌落后,将培养基以及所需试验材料放置于超净工作台中,在紫外灯下照射20 min,然后用无菌牙签挑取适量的菌株,分别点接到新的纤维素分离培养基上,并为各菌株编号,将点接过菌株的纤维素分离培养基倒置于37 ℃恒温培养箱中持续培养 18~22 h。待培养基中长出菌落后,把适量的刚果红溶液(1 mg/mL)倒入培养基中,要保证刚果红溶液能够完全盖住培养基表面,将培养基静置染色1 h后倒出刚果红溶液,再用蒸馏水进行反复清洗,直至流出的液体无红色为止,最后用适量NaCl溶液(1 mol/L)浸泡洗脱30 min,倒出NaCl溶液。
观察菌株周围能否产生透明圈,以菌株产生的透明圈直径和菌落直径的比值作为初步判断纤维素分解能力的指标,并将比值较大的菌株单独重新点接到新的纤维素分离培养基上,持续培养18~22 h,之后同样进行刚果红溶液染色、NaCl溶液浸泡洗脱等步骤,最后用游标卡尺准确测量菌株周围透明圈的直径和菌落直径,并计算两者的比值。
1.2.2 菌株的鉴定
对经过筛选得到的产纤维素酶菌株进行形态学观察和一系列生理生化鉴定,在参照《伯杰氏细菌系统鉴定手册》[6-7](中文第8版)和《常见细菌系统鉴定手册》的基础上,对菌株进行鉴定。
把菌株接种到葡萄糖蛋白胨水培养基中,然后将培养基放置于37 ℃、160 r/min的摇床培养箱中振荡培养18~22 h,待液体培养基中出现浑浊后,取1.5 mL培养液于离心管进行离心,用于提取菌株的基因组DNA。以所提取到的基因组DNA为模板,采用细菌通用引物27F和1492R,利用PCR扩增技术扩增16S rDNA。
扩增的基本程序为:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火40 s,72 ℃延伸90 s,30个循环;72 ℃延伸 10 min[8]。取5 μL扩增后的PCR产物置于PCR管中,随后进行1%的琼脂糖凝胶电泳检测,之后将PCR扩增产物送往北京中科希林生物科技有限責任公司进行DNA测序。在NCBI上通过Blast程序对测序结果进行基因同源性的分析,并构建系统发育树作进一步分析。
1.2.3 酶活性测定
根据国际单位制,将单位时间内1 mL酶液水解底物所能生成1 μmol葡萄糖的酶量称为1个酶活性单位,以U/mL表示[9]。参考文献[10]绘制葡萄糖标准曲线,测定纤维素酶活性大小,取0.5 mL离心后的上清液作为粗酶液,加入含有0.625%羧甲基纤维素钠、pH值为4.4的缓冲液2 mL,置于50 ℃水浴锅中酶解0.5 h,然后加入 2.5 mL 二硝基水杨酸(DNS)显色液于沸水浴中加热5 min,待冷却后在540 nm处测吸光度。纤维素酶活性计算公式:
纤维素酶活性=m×1/V×n。
式中:m表示葡萄糖含量,mg;V表示所用酶液量,mL;n表示酶液的稀释倍数。
2 结果与分析
2.1 菌株的筛选结果
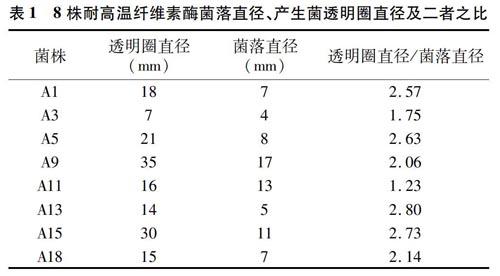
本试验从堆肥样品中得到耐高温菌株共18株,记为 A1~A18,最终筛选出能产纤维素酶的菌株共14株,将分离出来的菌株进行刚果红染色,其中产生透明圈直径与菌落直径比值较大的菌株有8株(表1)。透明圈直径与菌落直径的比值越大,说明菌株产纤维素酶的活力就越强。由表1可知,A13菌株透明圈直径与菌落直径的比值最大,其产纤维素酶的活力最强,菌株A13刚果红染色结果如图1所示,最终选择菌株A13进行后续试验。
2.2 酶活性测定
利用DNS法测定不同浓度的葡萄糖溶液在540 nm处的吸光度,绘制葡萄糖标准曲线,其标准曲线为y=0.397 4x+0.010 8,r2=0.997 9,表明D540 nm与葡萄糖浓度之间呈现较好的线性关系,因此可以通过该方程和酶活性计算公式得出菌株A13的纤维素酶活性,达到9.27 U/mL。
2.3 菌株鉴定
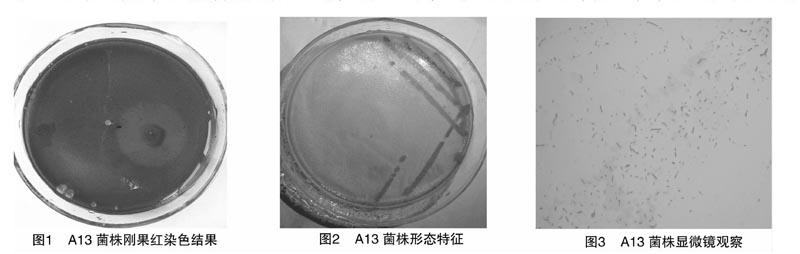
2.3.1 菌株的形态鉴定
耐高温纤维素酶菌株A13在平板上的形态特征见图2,在光学显微镜下的观察结果见图3,菌落特征及革兰氏染色的情况见表2。
2.3.2 生理生化鉴定结果
对所筛选得到的菌株A13进行甲基红试验、乙酰甲基甲醇试验、吲哚试验和柠檬酸盐利用试验等一系列生理生化鉴定,结果见表3,通过对菌株形态特征及其所具有生理生化特征的鉴定,并对照《伯杰氏细菌鉴定手册》(中文第8版)和《常见细菌系统鉴定手册》,初步将菌株A13鉴定为芽孢杆菌属。
2.3.3 菌株的系统发育分析
以菌株A13的基因组DNA作为模板对16SrDNA进行PCR扩增,在琼脂糖凝胶电泳图上观察到1条大小为1 500 bp左右的特异性条带(图4)。将PCR扩增产物送至测序公司进行DNA测序,并将所得序列提交到NCBI网站上进行同源DNA序列的比对分析。结果(图5)表明,菌株A13的16S rDNA序列与地衣芽孢杆菌[Bacillus licheniformis strain K1(KU922430.1)]等具有90%的相似程度,菌株A13与Bacillus licheniformis的遗传距离最近,结合菌株A13形态学特征、生理生化特征以及系统发育树分析结果,将菌株A13鉴定为地衣芽孢杆菌。
3 结论与讨论
纤维素酶可用于降解天然纤维素,是将资源合理利用的一种方式[11]。随着科技的发展,纤维素酶在各行各业中的市场需求量增大,例如在饲料、酿酒、制药、食品、造纸、纺织、环保、石油开采等行业中,纤维素酶都具有举足轻重的地位。但是由于纤维素酶发酵活力较低、生产成本高以及耐热性不高等原因,纤维素酶并不能被普遍应用于所需的生产实践中,进而使纤维素酶的发展受到了一定的限制。因此有必要进一步寻找更多成本低、催化性能高的纤维素酶。王巍杰等通过响应面法优化地衣芽孢杆菌发酵树叶饲料时的纤维素酶活性,最终优化后酶活性达到6.73 U[12]。余祖华等通过摇瓶发酵优化地衣芽孢杆菌B. LY02产纤维素酶的条件,产酶活性达到了0.683 5 U/mL[13-14]。
本试验初步分离得到14株具有产纤维素酶能力的菌株,经测定最终筛选出1株酶活性最高的菌株A13,结合菌株的形态特征、生理生化特征以及对系统发育树的分析结果,最终将菌株鉴定为地衣芽孢杆菌,其酶活性为9.27 U/mL,后期通过诱变选育和发酵条件优化有望进一步提高其产纤维素酶活力。
参考文献:
[1]Lynd L R,Weimer P J,van Zyl W H,et al. Microbial cellulose utilization:fundamentals and biotechnology[J]. Microbiology and Molecular Biology Reviews:MMBR,2002,66(3):506-577.
[2]穆春雷,武晓森,李术娜,等. 低温产纤维素酶菌株的筛选,鉴定及纤维素酶学性质[J]. 微生物学通报,2013,40(7):1193-1201.
[3]李素芬,霍贵成. 纤维素酶的分子结构组成及其功能[J]. 中国饲料,1997(13):12-14.
[4]王洪媛,范丙全. 三株高效秸秆纤维素降解真菌的筛选及其降解效果[J]. 微生物学报,2010,50(7):870-875.
[5]顾方媛,陈朝银,石家骥,等. 纤维素酶的研究进展与发展趋势[J]. 微生物学杂志,2008,28(1):83-87.
[6]任世英,邵 奎,李 雯,等. 一株耐高温纤维素酶产生菌的分离和鉴定[J]. 工业微生物,2016,46(4):19-24.
[7]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.[HJ1.74mm]
[8]龚丽琼,邓朝霞,黄祖新,等. 高温大曲中筛选产纤维素酶的耐高温芽孢杆菌[J]. 福建师范大学学报(自然科学版),2012,28(3):106-112.
[9]陈红漫,杨会颖,蔡金涛,等. 一株耐热纤维素酶产生菌的筛选及酶学特性[J]. 生物技术,2010,20(4):58-61.
[10]江国忠. 高产纤维素酶枯草芽孢杆菌的筛选、应用及其产酶条件研究[D]. 南昌:南昌大学,2010.
[11]刘洁丽,王 靖. 生物产纤维素酶研究进展[J]. 化学与生物工程,2008,25(12):9-12.
[12]王巍杰,王胜春,尹 丹. 响应面法优化地衣芽孢杆菌发酵树叶饲料提高纤维素酶活力的研究[J]. 饲料工业,2012,33(17):11-14.
[13]余祖華,丁 轲,侯 奎,等. 产纤维素酶地衣芽孢杆菌B.LY02摇瓶发酵条件优化[J]. 河南科技大学学报(自然科学版),2016,37(4):76-80.
[14]余祖华,丁 轲,侯 奎,等. 产纤维素酶地衣芽孢杆菌的诱变选育及其产酶条件优化[J]. 中国畜牧兽医,2016,43(4):1006-1011.

