水稻富亮氨酸重复类受体蛋白激酶OsRPK1响应外源生长素的作用研究
邹禹 刘园园 张培江 钱宝云 张炜

摘要:为明确水稻富亮氨酸重复类受体蛋白激酶OsRPK1响应外源生长素的作用机制,首先分析外源生长素2,4-D 对OsRPK1转基因水稻根部表型的影响;其次,异源表达OsRPK1胞外富亮氨酸重复LRRs,检测H3-IAA竞争结合融合蛋白GST-LRRs后的放射性活度以及利用等温滴定量热(ITC)法分析IAA与融合蛋白GST-LRRs相互作用的微热量变化。结果表明,在正常生长条件下,OsRPK1过表达能够抑制水稻侧根的生长;0.01 μmol/L 2,4-D處理 4 d 后发现,OsRPK1抑制表达植株侧根的数量比野生型多112%(P<0.01),而OsRPK1过表达植株侧根生长受到极显著抑制(P<0.001);0.1 μmol/L 2,4-D处理10 d后,抑制表达植株不定根的数量相对于野生型多18.2%(P<0.05),而过表达植株不定根的生长受到显著抑制(P<0.01);大肠杆菌BL21(DE3)诱导表达获得了包涵体形式的GST-LRRs融合蛋白,通过复性、纯化获得可溶性融合蛋白;H3-IAA竞争结合融合蛋白GST-LRRs以及IAA溶液滴定融合蛋白的微热量分析都表明OsRPK1与外源生长素未发生直接作用。
关键词:水稻富亮氨酸重复类受体蛋白激酶OsRPK1;原核表达;外源生长素;融合蛋白GST-LRRs
中图分类号:S511.01;Q55文献标志码: A
文章编号:1002-1302(2019)08-0046-06
植物类受体蛋白激酶(receptor-like protein kinase,RLKs)是一类包含胞外结构域(extracellular domain)、单次跨膜域(signle-pass transmembran domain)和胞内激酶域(cytoplasmic protein kinase domain)的蛋白分子[1]。在植物中类受体蛋白激酶家族非常庞大,拟南芥中至少有610个成员,水稻中几乎是拟南芥的2倍,其中胞外富亮氨酸重复类受体蛋白激酶(leucine-rich repeat receptor like protein kinase,LRR-RLKs)是植物类受体蛋白激酶家族中数量最大的亚族,该亚族在拟南芥中发现了239个成员,水稻中有309个成员,并在植物生长发育、激素信号转导以及抗逆胁迫中发挥重要作用[2]。在植物长期进化过程中LRR-RLKs的胞内激酶域保守性较高,而胞外LRRs具有特异性,如LRRs基序的数量、长度及位置存在差异性,这可能是赋予LRR-RLKs识别不同胞外信号或配体,通过跨膜域将信号传递至胞内,引起细胞的生理生化反应。
鉴定LRR-RLKs胞外LRRs识别的配体对于充分理解该类激酶的生物学功能具有重要的意义,但目前为止,只有少数植物LRR-RLKs的配体是明确的。现已发现的这些配体包括内源或外源的肽类和小分子激素,LRR-RLKs通过胞外LRRs识别配体,继而调节植物的生长发育、免疫等,更好地适应体内外环境的变化[3-4]。如水稻受体蛋白激酶基因Xa21是白叶枯病广谱抗性基因,胞外23个LRRs识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)的病程识别蛋白,诱导Xa21胞内激酶自磷酸化,产生一系列细胞反应,提高水稻对白叶枯病的抗性[5-6]。油菜素内酯(brassinosteroid,BR)受体BRI1(brassinosteroid-insensitive 1)胞外的LRRs能形成岛状结构,该结构对识别BR具有重要的作用。BAK1(BRI-associated kinase 1)也是一个LRR型受体蛋白激酶,膜外含有亮氨酸拉链、5个LRRs和1个富含脯氨酸的结构域,大量试验已证明BAK1与BRI1形成异源二聚体,作为BRI1受体伴侣参与BR信号转导[7-9],所以BR是BRI1的配体。FLS2是植物抗菌免疫至关重要的LRR-RLKs,胞外含有28个LRRs能够识别配体细菌鞭毛蛋白(flagellin) N端保守的22个氨基酸(Flg22),使植物产生防卫反应[10-11]。CLV3是一个调控拟南芥茎顶端分生区发育的多肽配体,能够与受体CLV1(胞外富含LRRs的受体蛋白激酶)、CLV2(胞外含有LRRs,但胞内不含激酶域)、RPK2(receptor-like protein kinase 2)[12-13]结合完成信号传递。最近我国科学家揭示了一类含有磺酸化修饰的13个氨基酸的小肽激素RGF是根分生组织生长因子,其受体是5个位于膜上的LRR-RLKs RGFRs,RGFRs识别RGF肽激素信号调控根干细胞,维持根的正常生长发育、形态建成以及向重力生长[14]。为了更广泛地了解这类受体蛋白激酶,寻找这类蛋白激酶胞外LRR结合的配体还有大量工作需要完成。
生长素是调控植物生长发育重要的植物激素[15],现研究最多的生长素受体是运输抑制剂响应蛋白(transport inhibitor resisrant 1,TIR1)和生长素结合蛋白(auxin binding protein,ABP1)。1997年Ruegger等发现了TIR1[16],随后被证明确定为生长素受体蛋白[17-18],但TIR1主要介导胞内的生长素信号转导。ABP1可能参与胞外的细胞信号转导,在过去几十年中一直作为候选的生长素受体受到关注,最近研究在拟南芥中发现2个新的abp1突变体不显示任何明显的发育缺陷、生长素相关的生理反应以及影响生长素相关的基因表达,认为ABP1并不是拟南芥生长发育和生长素信号途径所必需的[19],所以识别外源生长素的受体至今仍未发现。LRR-RLKs的胞外LRR基序能够识别外源植物激素油菜素内酯BR、胞内分泌性蛋白或肽类激素等,从而参与植物的生长发育和抗逆性。本研究前期利用蛋白质组学方法从水稻根部鉴定出一个新的具有激酶活性的富亮氨酸重复类受体蛋白激酶OsRPK1,主要受外源生长素2,4-D(2,4-二氯苯氧乙酸)和IAA(吲哚乙酸)诱导表达,并且OsRPK1能影响部分生长素极性运输相关基因[20]和部分生长素信号转导途径基因表达(数据未发布),而不影响生长素合成重要基因OsYUCCA1表达。为了进一步阐明OsRPK1参与外源生长素的作用机制,首先利用OsRPK1过表达与抑制表达转基因水稻观察对外源生长素敏感性以及侧根、不定根生长的影响;其次异源表达OsRPK1胞外LRRs,在体外分析OsRPK1的LRRs是否识别及结合生长素,为进一步研究OsRPK1的可能配体以及参与的信号转导机制提供参考。
1材料与方法
1.1试验材料
大肠杆菌感受态DH5α、BL21(DE3)购自生工生物工程(上海)股份有限公司,原核表达载体pGEX-4T-1为笔者所在实验室保存。RNA提取试剂盒、反转录试剂盒、高保真PrimeSTAR GXL DNA聚合酶、限制性内切酶购自大连TaKaRa公司,T4 DNA聚合酶购自新英格兰(NEB)公司,异丙基硫代半乳糖苷(IPTG)购自赛默飞世尔科技公司,蛋白Marker购自北京百泰克生物技术有限公司,GST结合树脂购自金斯瑞生物科技有限公司,2,4-D、IAA购自Sigma公司,H3-IAA购自American Radiolabeled Chemicals公司。
日本晴(Oryza.Sativa L.spp.japonica cv.Nipponbare)水稻种子及T3代OsRPK1过表达株系O1、O7与抑制表达株系A5、A7种子由南京农业大学生命科学学院实验室保存。观察OsRPK1[STBZ]转基因植株与日本晴在外源生长素2,4-D处理下的侧根和不定根的表型参照文献[21-23],并稍有改动。选取籽粒饱满的日本晴和转基因水稻种子,除去稻壳、表面消毒杀菌后移入1/2 MS固体培养基中,待萌发后再分别移至含有0、0.01、0.10 μmol/L 2,4-D的1/2 MS固体培养基中,28 ℃ 光照培养箱分别培养4、10 d,其中光照度为 600 μmol/(m2·s),光照条件为白天14 h和黑夜10 h,相对湿度为75%,對水稻侧根、不定根进行观察、拍照以及统计,采用GraphPad Prism6.0软件进行数据处理,以***(P<0.001)、**(P<0.01)、*(P<0.05)表示不同程度的差异显著性。
1.2融合表达载体的构建
根据在线网站SMART(http://smart.embl-heidelberg.de/)分析水稻类受体蛋白激酶OsRPK1(NCBI登录号:XP_015640180)的蛋白质结构域,确定胞外富亮氨酸重复序列LRRs的位置并设计2条引物用于扩增该区域:上游引物 P1-LRR-F:TAA[ZZ(Z]GGATCC[ZZ)]CAGACCAACGCCCAGGACG(划线为BamHⅠ酶切位点),下游引物P1-LRR-R:TAA[ZZ(Z]GCGGCC[ZZ)]GCGCCACCAAGAGCAACTGCCAAG(划线为NotⅠ酶切位点),引物由上海英骏生物有限公司合成。水稻根部总RNA提取以及反转录合成cDNA参照TaKaRa产品说明书,利用高保真PrimeSTAR GXL DNA聚合酶以cDNA为模板进行PCR扩增。PCR反应程序:95 ℃预变性10 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min,循环扩增35次;72 ℃ 充分延伸10 min。扩增产物用1.0%琼脂糖凝胶电泳分析后将目的片段回收、纯化,目的片段与pGEX-4T-1空载体分别用BamHⅠ和NotⅠ双酶切,酶切产物回收后用T4 DNA连接酶于16 ℃连接4 h,连接产物转化大肠杆菌DH5α感受态细胞,37 ℃培养过夜后挑取单菌落进行PCR扩增、酶切和测序验证。
1.3富亮氨酸重复序列LRRs体外原核表达
将构建成功的pGEX-LRRs质粒转化BL21(DE3)感受态细胞,PCR鉴定阳性克隆并接种于5 mL LB(含有 50 μg/mL 卡那霉素)新鲜液体培养基中,37 ℃、200 r/min振荡培养至D600 nm=0.8,加入终浓度为0.8 mmol/L IPTG,摇床振荡诱导培养4 h;吸取1 mL菌液,12 000 r/min离心5 min后弃上清,加入80 mL磷酸缓冲液重悬后,再加入20 μL 5倍上样缓冲液混匀,沸水中处理5 min使蛋白变性。12 000 r/min 离心10 min后取上清液于12%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定。
1.4包涵体的复性和纯化
将活化的含有pGEX-LRRs质粒的BL21(DE3)表达菌株按1 ∶100接种于1 L LB新鲜液体培养基中(含有 50 μg/mL 卡那霉素),37 ℃、200 r/min振荡培养至D600 nm= 0.8,加入0.8 mmol/L IPTG后继续诱导培养4 h,12 000 r/min离心5 min收集菌体;弃上清液,加入50 mL缓冲液(含有 20 mmol/L Tris-HCl,500 mmol/L NaCl,pH值为8.5)重悬菌体,用超声裂解法破碎大肠杆菌,12 000 r/min离心15 min收集沉淀;用含有1% TritonX-100和2 mol/L尿素的缓冲液洗涤沉淀3次后,12 000 r/min离心15 min收集包涵体沉淀,用含有8 mol/L尿素和1 mmol/L二硫苏糖醇(DTT)的缓冲液充分溶解包涵体沉淀,温室放置1 h,12 000 r/min离心15 min收集上清液;将上清液缓缓加入含有0.4 mol/L L-精氨酸和2 mmol/L DTT的缓冲液中,不断搅拌溶液直至沉淀溶解,4 ℃静置过夜,使得变性蛋白能够完全复性;12 000 r/min离心15 min,收集上清液。上清液装入透析袋中,利用磷酸缓冲液透析过夜去除复性液中的变性剂;复性后的蛋白液利用Sephacryl-S200柱纯化,冻干浓缩存于-80 ℃冰箱中待用。
1.5融合蛋白GST-LRRs与外源生长素体外结合试验
吸取200 μL GST结合树脂于1.5 mL离心管中,磷酸缓冲液清洗6次后吸取10 μg GST-LRRs融合蛋白至GST结合树脂中,轻轻混匀,温室孵育3 h;磷酸缓冲液再清洗6次,除去未结合的融合蛋白;加入100 nmol/L H3-IAA于4组含有融合蛋白的GST树脂中,每组再依次加入0、0.1、1.0、10.0 μmol/L IAA,每组3次重复;用磷酸缓冲液补至体积为 1 mL,置于室温孵育30 min;300 r/min离心1 min后,轻轻倒除磷酸缓冲液,用磷酸缓冲液清洗3次;加入100 μL ddH2O重悬GST结合树脂后倒入5 mL离心管中,并用3 mL闪烁液冲洗GST结合树脂,收集GST结合树脂于5 mL离心管;避光置于温室1 h后用Beckman液闪仪读数。
1.6等温滴定量热法(isothermal titration calorimetry,ITC)测定GST-LRRs和外源生长素相互作用
等温滴定量热试验采用MicroCal公司的VP-ITC进行测定,数据处理利用Origin 7.0软件,参照文献[24]。将 1 mL 5 μmol/L GST-LRRs融合蛋白注入至样品池中,微量滴定注射器吸取100 μL IAA溶液,以上溶液皆用pH值5.5磷酸缓冲液稀释配制;以1 mL pH值5.5磷酸缓冲液做参比,并注入参照池中。设置反应温度为20 ℃,将IAA溶液滴定到GST-LRRs融合蛋白溶液中,每次滴加10 μL,滴加次数共20次,平衡时间200 s,间隔300 s,搅拌速度为500 r/min。
2结果与分析
2.1外源生长素2,4-D处理后的OsRPK1转基因水稻根部表型分析
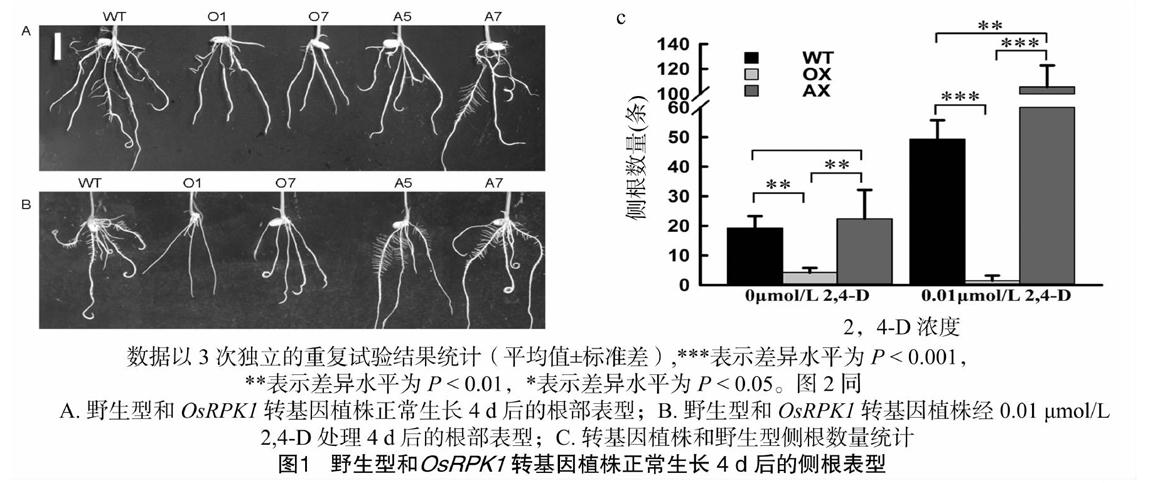
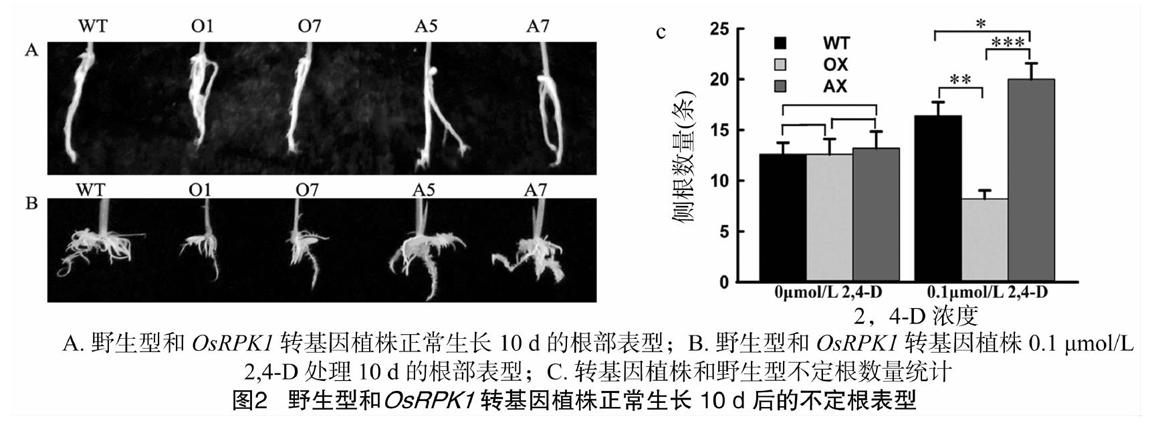
水稻萌发后移至1/2 MS固体培养基中生长4 d后,OsRPK1抑制表达植株AX(表示A5、A7)与野生型侧根数量无显著差异(P>0.05),而OsRPK1过表达植株OX(表示O1、O7)的侧根数量相对于野生型显著减少(P<0.01)(图1-A);生长10 d后,OsRPK1过表达植株OX、OsRPK1抑制表达植株AX和野生型的不定根数量基本一致(图2-A)。进一步观察0.01 μmol/L 2,4-D处理4 d以后的侧根变化,OsRPK1抑制表达植株AX侧根的数量比野生型多112%(P<0.01)(图1-B),而OsRPK1过表达植株OX侧根的发生受到显著抑制(P<0.001)(图1-C)。0.1 μmol/L 2,4-D 处理10 d以后,抑制表达植株AX的不定根数量相对于野生型WT多18.2%,差异显著(P<0.05)(图2-C),而过表达植株OX的不定根发生受到显著抑制,与野生型相比差异极显著(P<0.01)(图2-C)。以上结果表明,在水稻中OsRPK1表达量的改变能影响水稻侧根的发生,外源生长素2,4-D处理情况下,OsRPK1[STBZ]负调控水稻侧根和不定根的发生,这暗示了OsRPK1[STBZ]可能参与生长素生理反应来调节水稻根部的生长发育。
2.2原核表达载体pGEX-LRRs的构建
设计特异性引物扩增OsRPK1胞外富亮氨酸重复序列LRRs,PCR产物经1%琼脂糖凝胶电泳分离后显示大小为 1 600 bp 左右,与预期值1598 bp相符(图3-A)。回收目的片段和原核表达载体pGEX-4T-1,分别用NotⅠ和BamHⅠ进行双酶切,T4连接酶连接后构建重组质粒pGEX-LRRs,重组质粒转化DH5α菌株,筛选阳性单克隆后提取质粒进行 NotⅠ 和BamHⅠ双酶切验证,酶切产物是1 600 bp左右的LRRs片段和pGEX-4T-1线性化载体,结果显示酶切产物大小与理论值相符(图3-B)。阳性克隆进行DNA测序鉴定,测序结果与NCBI数据库中的序列一致,无碱基突变或缺失,说明pGEX-LRRs原核表达载体构建成功。
2.3富亮氨酸重复序列LRRs体外原核表达
将重组质粒pGEX-LRRs转化BL21(DE3)菌株感受态,尝试在不同温度、不同浓度IPTG条件下诱导融合蛋白表达,选定37 ℃、0.1 mmol/L IPTG诱导4 h作为蛋白表达条件,表达得到的蛋白通过SDS-PAGE进行检测(图4),第1泳道为未加IPTG诱导的阴性对照,2泳道为加0.1 mmol/L IPTG诱导后的表达蛋白,且蛋白大小与目的蛋白大小(81.7 ku)相吻合,说明融合蛋白GST-LRRs在BL21(DE3)表达菌株中成功表达。进一步分析,如图5所示,1泳道为IPTG诱导蛋白表达后菌液经离心收集的上清液,上清液里未检测到融合蛋白,说明GST-LRRs融合蛋白在大肠杆菌中以不溶性的、无活性的包涵体形式存在。为了得到有活性的可溶性融合蛋白,首先对其进行变性溶解,然后再将其复性,4泳道是复性后获得的高纯度的GST-LRRs融合蛋白,此蛋白可以满足后续试验的要求。
2.4融合蛋白GST-LRRs与外源生长素相互作用分析
利用100 nmol/L H3-IAA和0、0.1、1.0、10.0 μmol/L不同浓度的IAA竞争结合10 μg融合蛋白GST-LRRs,用磷酸缓冲液洗脱未被结合的H3-IAA和IAA,Beckman液闪仪读取与融合蛋白结合的H3-IAA放射性活度。结果如图6所示,只有100 nmol/L H3-IAA时,和GST-LRRs结合后,放射性活度测得为918.6 d.p.m,随着未被同位素标记的IAA浓度(0.1、1.0、10.0 μmol/L) 的递增与100 nmol/L H3-IAA竞争结合GST-LRRs,放射性活度分别测得为870.5、840.3、1 027.6 d.p.m,IAA竞争H3-IAA结合融合GST-LRRs后放射性活度无显著性差异(P>0.05),说明IAA竞争结合 GST-LRRs也未改变GST-LRRs与H3-IAA的结合量,这些结果表明融合蛋白GST-LRRs未与生长素发生直接结合。
等温滴定量热ITC法通过类似化学滴定的方法,分析2個物质之间相互作用的微热量变化以研究分子相互作用,广泛用于检测蛋白质与小分子相互作用[25-27]。图7-A显示的是连续等温线5 μmol/L IAA溶液滴定至100 μmol/L GST-LRRs融合蛋白溶液后的补偿功率变化。使用数据分析软件Origin 7.0对原始数据进行积分和标准化处理,如图 7-B 所示,得到反应热随摩尔比的变化函数图呈散点状,说明IAA不能结合GST-LRRs融合蛋白。ITC法得到理想的试验数据,需要反应的亲和常数K值在103~108,而IAA和GST-LRRs可能是由于两者的亲和常数太低,热量未被仪器检测到,从而得不到两者相互作用的信息。
3结论与讨论
植物在不同生长发育阶段会受到外界环境胁迫和体内细胞间信号的影响,LRR-RLKs的胞外LRR结构域能够首先识别和接受来自胞外的信号,通过跨膜结构域将胞外信号传递至胞内,引起细胞的生理生化反应。OsRPK1在前期被鑒定为一个新的具有激酶活性、定位于细胞膜的典型的 LRR-RLK,并且分析OsRPK1在植物激素处理下的表达模式表明,OsRPK1主要受生长素2,4-D和IAA诱导表达,并且 2,4-D诱导效果要比IAA稍显著[20]。生长素是调节植物生长发育的一类重要的植物激素,在植物根部发育过程中发挥重要作用[28-29]。为了进一步研究OsRPK1与生长素的相关性,鉴于2,4-D诱导OsRPK1表达的效果比IAA稍显著,并且2,4-D 化学性质也比IAA稳定,所以本研究选用2,4-D作为外源生长素,观察外源生长素对OsRPK1表达量改变后水稻根部表型的影响。
水稻根系主要由大量的不定根及侧根组成。外源生长素可促进侧根的发生,但浓度过高则抑制侧根原基的露出,Zhang等研究2,4-D对水稻侧根长度的影响,利用不同浓度的2,4-D处理野生型和OsWRKY31过表达水稻,发现 0.01 μmol/L 的 2,4-D 处理萌发后水稻侧根的发生在6 d时表型显著[21];Inukai等研究crl1突变体时发现,0.01~0.10 μmol/L 的2,4-D对突变体侧根的发生影响显著[22]。因此,本研究结合前人研究结果选择0.01 μmol/L的2,4-D作为观察侧根发生的作用浓度,结果表明0.01 μmol/L的2,4-D 处理4 d后,转基因植株的侧根数量相对于野生型差异显著。正常生长情况下,OsRPK1过表达转基因植株相对于野生型的侧根生长受到显著抑制(P<0.01),在0.01 μmol/L 2,4-D处理4 d后的OsRPK1抑制表达植株侧根的数量与野生型相比多112%(P<0.01),而OsRPK1过表达植株侧根生长受到极显著抑制(P<0.001)。Wang等研究OsCAND1[STBZ]对水稻不定根发生的影响,认为0.1 μmol/L 2,4-D处理7 d的水稻Oscand1[STBZ]突变体与野生型不定根的数量差异最为显著[23]。本研究利用0.1 μmol/L 2,4-D处理水稻,发现10 d时水稻不定根差异明显,抑制表达植株不定根的数量相对于野生型多18.2%(P<0.05),而过表达植株不定根的生长受到极显著抑制(P<0.01)。这些表型和已报道的一些生长素相关的突变体表型极为相似,如生长素上调小RNA基因SAUR39负调控生长素合成和转运,过表达SAUR39转基因水稻表现出侧根的发生受到抑制[30];OsAGAP(ARF-GTP酶激活蛋白)能够调节生长素内流和根部发育,OsAGAP会破坏水稻中生长素的极性运输,影响主根和侧根的发育,OsAGAP过表达水稻幼苗侧根发生比野生型水稻慢约2 d,OsAGAP转基因水稻幼苗在萌发后12 d的侧根数约为野生型的50%,不定根的数量也明显增多[31];在生长素信号转导途径中,Aux/IAA 发挥着非常重要的作用,Kitomi等研究也表明,Osiaa13突变体的侧根数量受到明显的抑制[32]。OsRPK1能影响部分生长素极性运输相关基因[20]和部分生长素信号转导途径基因表达。这些结果表明,OsRPK1可能参与了生长素信号途径或极性运输途径调节水稻根部的生长发育。
大量研究已表明生长素运输抑制剂响应蛋白(TIR1)是生长素胞内受体蛋白[17-18],介导胞内的生长素信号转导,但识别外源生长素的受体至今仍未发现。OsRPK1作为一个典型的LRR-RLK,其胞外富亮氨酸重复LRRs可能与外源生长素相互作用,胞内的激酶结构域通过磷酸化作用将信号传递给下游生长素响应蛋白,从而调节水稻侧根和不定根的生长。因此本研究将OsRPK1蛋白的LRRs通过原核系统异源表达,在体外观察OsRPK1的LRRs结构域是否与生长素结合。同位素H3标记的IAA与未被同位素标记的IAA竞争结合试验可以判断一个蛋白是否与生长素结合[17-18],同时利用等温滴定微量热(ITC)法测定两者在体外作用的微热量变化,试验结果都表明GST-LRRs并未与外源生长素结合。
现有的研究表明LRR-RLKs受体激活的机制主要有2类:一类以油菜素内酯受体BRI1和鞭毛蛋白受体FLS2为代表,通过配体的“胶联”作用结合共受体形成异源二聚体来激活受体[7-11];另一类是以植物磺化肽激素受体PSKR为代表,主要通过配体别构诱导受体构象变化来介导受体与其共受体SERK相互作用激活受体[14,33]。在这2种不同的受体激活模式中,涉及的受体和共受体均是LRR型类受体蛋白激酶。更有趣的是现已发现的共受体几乎都是SERK蛋白,一个共受体如何促进不同配体的特异性结合和激活不同的LRR型受体蛋白激酶尚不清楚[34]。最近科学家在拟南芥中使用高敏感、高通量相互作用分析法,研究了4万个潜在的细胞表面受体胞外结构域的相互作用,构建了由567个相互作用组成的LRR的细胞表面相互作用网络[35]。由此可见,LRR-RLKs在植物生长发育过程中功能行使的机制是多样化的,且不同的LRR-RLKs在配体识别过程中扮演的角色也有区别,有的LRR-RLKs直接与配体结合,有的只是作为共受体与受体结合来帮助受体识别配体。虽然在体外试验中未证明融合蛋白GST-LRRs与外源生长素直接结合,一方面可能是因为原核表达系统异源表达,缺乏蛋白翻译后加工修饰,可能导致表达的蛋白没有生物学活性,体外试验不能够完全模拟体内环境。另一方面可能是OsRPK1作为复杂的细胞表面互作网络的一员,发挥作用需要结合其他蛋白或复合物才能和外源生长素直接或间接作用,这也将是以后研究OsRPK1参与生长素信号途径和极性运输途径需要重点解决的问题。
参考文献:
[1]查笑君,馬伯军,潘建伟,等. 植物富亮氨酸重复类受体蛋白激酶的研究进展[J]. 浙江师范大学学报(自然科学版),2010,33(1):7-12.
[2]Liu P L,Du L,Huang Y,et al. Origin and diversification of leucine-rich repeat receptor-like protein kinase (LRR-RLK) genes in plants[J]. BMC Evolutionary Biology,2017,17(1):47.
[3]Hohmann U,Lau K,Hothorn M. The structural basis of ligand perception and signal activation by receptor kinases[J]. Annual Review of Plant Biology,2017,68(1):109-137.
[4]Song W,Han Z F,Wang J Z,et al. Structural insights into ligand recognition and activation of plant receptor kinases[J]. Current Opinion in Structural Biology,2017,43:18-27.
[5]Lee S W,Han S W,Sririyanum M,et al. A typeⅠ-secreted,sulfated peptide triggers XA21-mediated innate immunity[J]. Science,2013,342(6155):850-853.
[6]Song W Y,Wang G L,Chen L L,et al. A receptor kinase-like protein encoded by the rice disease resistance gene,Xa21[J]. Science,1995,270(5243):1804-1806.
[7]Nam K H,Li J M. BRI1/BAK1,a receptor kinase pair mediating brassinosteroid signaling[J]. Cell,2002,110(2):203-212.
[8]Oh M H,Clouse S D,Huber S C. Tyrosine phosphorylation of the BRI1 receptor kinase occurs via a post-translational modification and is activated by the juxtamembrane domain[J]. Frontiers in Plant Science,2012,3:175.
[9]Oh M H,Wang X F,Kota U,et al. Tyrosine phosphorylation of the BRI1 receptor kinase emerges as a component of brassinosteroid signaling in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(2):658-663.
[10]Gomez-Gomez L,Bauer Z,Boller T. Both the extracellular leucine-rich repeat domain and the kinase activity of FSL2 are required for flagellin binding and signaling in Arabidopsis[J]. Plant Cell,2001,13(5):1155-1163.
[11]Sun Y D,Li L,Macho A P,et al. Structural basis for flg22-induced activation of the Arabidopsis FLS2-BAK1 immune complex[J]. Science,2013,342(6158):624-628.
[12]Gish L A,Clark S E. The RLK/pelle family of kinases[J]. Plant Journal,2011,66(1):117-127.
[13]Kinoshita A,Betsuyaku S,Osakabe Y,et al. RPK2 is an essential receptor-like kinase that transmits the CLV3 signal in Arabidopsis[J]. Development,2010,137(22):3911-3920.
[14]Song W,Liu L,Wang J Z,et al. Signature motif-guided identification of receptors for peptide hormones essential for root meristem growth[J]. Cell Research,2016,26(6):674-685.
[15]Lavy M,Estelle M. Mechanisms of auxin signaling[J]. Development,2016,143(18):3226-3229.
[16]Ruegger M,Dewey E,Hobbie L,et al. Reduced naphthylphthalamic acid binding in the tir3 mutant of Arabidopsis is associated with a reduction in polar auxin transport and diverse morphological defects[J]. Plant Cell,1997,9(5):745-757.
[17]Dharmasiri N,Dharmasiri S,Estelle M. The F-box protein TIR1 is an auxin receptor[J]. Nature,2005,435(7041):441-445.
[18]Kepinski S,Leyser O. The Arabidopsis F-box protein TIR1 is an auxin receptor[J]. Nature,2005,435(7041):446-451.
[19]Gao Y B,Zhang Y,Zhang D,et al. Auxin binding protein 1 (ABP1) is not required for either auxin signaling or Arabidopsis development[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(7):2275-2280.
[20]Zou Y,Liu X Y,Wang Q,et al. OsRPK1,a novel leucine-rich repeat receptor-like kinase,negatively regulates polar auxin transport and root development in rice[J]. Biochimica et Biophysica Acta (BBA) - General Subjects,2014,1840(6):1676-1685.
[21]Zhang J,Peng Y C,Guo Z. Constitutive expression of pathogen-inducible OsWRKY31 enhances disease resistance and affects root growth and auxin response in transgenic rice plants[J]. Cell Research,2008,18(4):508-521.
[22]Inukai Y,Sakamoto T,Ueguchi-Tanaka M,et al. Crown rootless1,which is essential for crown root formation in rice,is a target of an auxin response factor in auxin signaling[J]. Plant Cell,2005,17(5):1387-1396.
[23]Wang X F,He F F,Ma X X,et al. OsCAND1 is required for crown root emergence in rice[J]. Molecular Plant,2010,4(2):289-299.
[24]Lewis E A,Murphy K P. Isothermal titration calorimetry[J]. Methods in Molecular Biology,2005,305(3):1-16.
[25]Frazier R A,Papadopoulou A,Green R J. Isothermal titration calorimetry study of epicatechin binding to serum albumin[J]. Journal of Pharmaceutical and Biomedical Analysis,2006,41(5):1602-1605.
[26]Singh S K,Kishore N. Thermodynamic insights into the binding of Triton X-100 to globular proteins:a calorimetric and spectroscopic investigation[J]. The Journal of Physical Chemistry B,2006,110(19):9728-9737.
[27]齊心洁,王玥,王彦晟,等. 等温滴定量热法在蛋白质-配体相互作用中的应用[J]. 生物技术通报,2017,33(5):40-49.
[28]Peret B,De Rybel B,Casimiro I,et al. Arabidopsis lateral root development:an emerging story[J]. Trends in Plant Science,2009,14(7):399-408.
[29]Peret B,Li G W,Zhao J,et al. Auxin regulates aquaporin function to facilitate lateral root emergence[J]. Nature Cell Biology,2012,14(10):991-998.

