942例颅内动脉瘤患者血管内治疗围术期出血并发症分析及防治
蒋业清 黄磊葛亮鲁刚 狄若愚 万海林 张磊 万军 张晓龙
颅内动脉瘤的人群发病率约为3%[1],破裂后将导致高致残率(50%)和高致死率(35%)[2]。目前血管内治疗是颅内动脉瘤的主要治疗方式之一[3],然而围术期的出血并发症及其严重不良预后始终是困扰介入医师的主要难题[4-5],其发生原因及防治措施仍不清晰,以往研究文献较少。本文对我院收治的942例患者(1 055个颅内动脉瘤)的诊治情况进行分析,重点探讨其出血性并发症的发生情况及其防治措施。
资料与方法
一、一般资料
收集2011年1月至2019年4月复旦大学附属华山医院收治并行血管内治疗的942例颅内动脉瘤患者,其中男366例,女576例;年龄15~84(55.9±11.0)岁。纳入标准:(1)颅内动脉瘤;(2)年龄14~90 岁;(3)动脉瘤直径≥7 mm;(4)动脉瘤直径<7 mm且存在以下情况者[6]:①患者有蛛网膜下腔出血(SAH)家族史或个人史;②动脉瘤形态不规则;③随访观察中动脉瘤瘤体增大;④多发动脉瘤;⑤动脉瘤位置不在颈内动脉眼动脉段及其以下;⑥患者焦虑强烈要求治疗。本组942例患者共有1 055个动脉瘤,其中未破裂动脉瘤806个,破裂动脉瘤249个;单发动脉瘤803个,多发动脉瘤139例(252个),其中2枚89例(178个),3枚12例(36个),仅治疗1枚动脉瘤,其余动脉瘤随访38例(38个)。
二、治疗方法
所有患者术前均行DSA造影证实后在全麻下行血管内治疗术。治疗前制定详细的手术策略,准备手术所需器材如导管、弹簧圈及支架等。窄颈小动脉瘤多采用单纯弹簧圈栓塞治疗,宽颈小动脉瘤多采用支架辅助弹簧圈栓塞治疗,大型或巨大型动脉瘤多在双微导管技术的基础上辅以支架栓塞治疗。治疗主要采用MicroPlex弹簧圈系统、LVIS支架(美国MicroVention公司)、Neuroform3支架(美国Stryker公司)和Solitaire AB系列支架(美国eV3公司)。本组1 055个动脉瘤中单纯栓塞364个,支架辅助栓塞611个,单纯支架贴覆17个,闭塞载瘤动脉63个。
三、围术期用药
(一)尼莫地平用药指征
(1)术前合并高血压者,可静脉给药同时监测血压。(2)无高血压者,避免常规给药造成灌注不足加重。(3)合并意识障碍加重,考虑为血管痉挛所致者,尽早手术栓塞动脉瘤避免再次出血,且术中足量、分次给予尼莫地平可明显缓解血管痉挛相关的意识障碍[7]。(4)蛛网膜下腔出血合并严重血管痉挛者,术后应复查血管造影并经动脉分次、足量灌注尼莫地平,直至痉挛缓解,术中注意监测血压。(5)导引导管相关血管痉挛,回撤导管后,经导引导管给予尼莫地平,复查无血管痉挛后再进行下一步操作。(6)远端分支动脉支架植入后,可能存在支架对局部血管刺激、变形,导致痉挛、血栓形成,同时经动脉给予替罗非班及尼莫地平。(7)破裂急性期动脉瘤应用尼莫地平以动脉内给药为主(尼莫同原液1∶4或1∶5稀释后分次灌注,同时注意血压变化,请麻醉师及时配合提前处理)。
(二)替罗非班
1.用药指征:术前所有患者常规不加用抗血小板聚集药物。预防性给药:首次剂用量10 μg/kg经导引导管缓慢推注。使用时机:术中一般与全身肝素化同时使用。
抢救性用药:(1)术中血栓事件后给予替罗非班加肝素化[8],如药效不敏感,可根据术者经验反复给药[替罗非班5 μg/(kg·30min)],同时用微导丝机械碎栓或Solitaire支架取栓直至血栓完全消失或大部分溶解,回至病房用替罗非班继续静脉维持72 h同时桥接双抗48 h。(2)术后血栓事件:醒麻醉后即刻查体,若神经科体征较术前明显加重,可行Dyna CT明确无出血后给予肝素化,如症状无明显改善,急诊行脑血管造影明确血管有无血栓形成,按术中血栓形成处理[9]。
2.术后常规头颅CT:所有治疗患者术后即刻均行急诊头颅平扫检查,确认有无颅内出血,如有可疑出血,常规2~4 h后复查头颅CT,如高密度部位密度明显下降,考虑造影剂渗出;如高密度持续存在,考虑出血可能,中和肝素,替罗非班减量或停止。头颅CT提示无出血后:(1)对于未破裂窄颈动脉瘤单纯栓塞且无弹簧圈突出至载瘤动脉者,不给予肝素化及术后抗血小板聚集药物;(2)支架辅助栓塞或单纯栓塞存在弹簧圈突出至载瘤动脉时,常规给予10 μg/kg替罗非班静脉维持48~72 h,后采用双联抗血小板聚集药物治疗与替罗非班桥接24 h(拜阿司匹林 100 mg/d,氯吡格雷75 mg/d)。
(三)肝素的应用
1.出血高危因素:(1)近期破裂出血或远隔部位出血;(2)动脉瘤极不规则;(3)多发子瘤或假性动脉瘤;(4)动脉入路存在严重病变造成导管系统极不稳定,如栓塞微导管难以稳定,考虑可能存在刺破动脉瘤风险者;(5)微小动脉瘤。
2.缺血高危因素:(1)潜在高凝状态:长期应用皮质醇或雌激素、恶性肿瘤、脱水状态、止血药过量应用、低血容量等;(2)近端血管狭窄、严重硬化迂曲;(3)近端血管易痉挛,且应用尼莫地平后不能缓解;(4)重要分支邻近或发自动脉瘤(如脉络膜前动脉瘤,大脑中动脉分叉部动脉瘤,基底动脉穿支动脉瘤等);(5)拟采用 Y 型支架技术;(6)远端分支血管动脉瘤采用支架辅助栓塞;(7)同时采用3套以上导管系统者。
3.使用原则:根据以上所提不同出血、缺血因素权衡肝素化的时机,原则上在出血高危操作后行全身肝素化。对于因动脉瘤本身原因的出血高危患者,可在成篮或大部栓塞确切后给予肝素化;对于导管系统相关及操作相关的缺血高危患者,可提前给予肝素化。
4.使用剂量:普通肝素首剂1250 U/15 kg静脉注射,1 h后给半量,2 h后1/4量,以后每隔1 h至最低1 ml稀释液(1 250 U)维持。
5.使用时机:原则上不常规术前给予全身肝素化,手术尽量做到简单快速,可减少肝素使用,将药物的不良反应降至最低。肝素应用应综合考虑动脉瘤的术中破裂风险和操作相关的血栓风险,个体化应用。远端分支血管动脉瘤支架辅助栓塞后分支血管变形明显者,形成血栓的机制可能与反复操作相关血管痉挛、动脉管径小有关,需肝素化、替罗非班及尼莫地平同时应用。
(四)双联抗血小板聚集药物
术后1周查血栓弹力图,若拜阿司匹林及氯吡格雷血栓弹力图抑制率均过低时,更换西洛他唑100 mg/次,2次/d,若抑制率过高且有出血征象时氯吡格雷减量至50 mg/d及联合拜阿司匹林100 mg/d继续观察症状,必要时可服用单抗,如无上述情况,常规双抗3个月后根据血栓弹力图结果决定改单抗至复查,再根据DSA复查结果及患者动脉硬化狭窄程度决定是否继续采用抗血小板聚集药物[10]。
四、随访
根据术后即刻改良Raymond分型[11-13]决定随访时间,第1次随访:RaymondⅢb型者于术后3个月内复查,Ⅰ、Ⅱ或Ⅲa型者于术后6个月~1年复查;第2次随访根据第1次复查结果确定,若动脉瘤情况稳定,一般2~5年复查一次。随访内容:(1)旋转DSA(包括动态减影图像和3D双重建图像);(2)原手术工作角度行DSA造影对比并结合旋转DSA观察动脉瘤复发与否及程度;(3)旋转非减影图像多角度观察弹簧圈是否有压缩变形情况。
五、并发症
症状性并发症定义为任何可导致术后改良Rankin量表(mRS)评分增加的并发症。预后良好为术后6个月mRS评分<2分,预后不良为术后6个月mRS评分≥2分且较术前mRS评分增加。术中破裂出血定义为有明确造影剂外渗且CT阳性。
结 果
本组942例患者共发生出血并发症12例(1.27%),包括术中出血9例、术后出血3例。9例术中出血患者均预后良好,出院前mRS评分未增加,无致死及致残。3例术后出血患者,出现症状后即刻行头颅CT明确为大量蛛网膜下腔出血,最终均经积极抢救无效死亡。
一、术中出血
9例术中出血患者中,因弹簧圈损伤瘤腔致动脉瘤破裂6例(0.64%),微导管损伤瘤腔致动脉瘤破裂2例(0.21%),微导丝损伤远端小分支导致出血1例(0.11%)。
1.弹簧圈损伤瘤腔:6例动脉瘤的瘤腔形态均不规则且伴子瘤,其中4例为破裂动脉瘤。2例出血发生在成篮时,4例发生在成篮后盘圈时,均表现为弹簧圈突出至动脉瘤轮廓之外,“冒烟”提示有造影剂外渗,明确出血诊断。处理:继续填塞该枚弹簧圈并继续迅速填塞瘤腔止血确切,术后即刻行头颅CT提示少量蛛网膜下腔出血,经对症治疗后6例患者均完全恢复后出院(图1)。
2.微导管损伤瘤腔:2例均为未破裂动脉瘤患者。一例大脑前动脉A1段起始部朝向下方的微小动脉瘤在支架微导管到位过程中将本已到位栓塞微导管移位损伤动脉瘤腔,另一例右侧大脑中动脉瘤分叉部动脉瘤,拟行Y型支架辅助栓塞术,在Headway-21支架微导管塑形后使用溜冰技术通过瘤腔时,微导管损伤瘤腔出血(图2)。处理:(1)前动脉A1段起始部动脉瘤由于微导管到位困难,动脉瘤破裂出血后,压迫该侧颈内动脉结合麻醉控制性降压并以弹簧圈填塞颈内动脉暂不解脱,将微导丝置于瘤腔内电凝止血(Solitaire解脱器),将动脉瘤栓塞止血确切;大脑中动脉瘤采用术中迅速压迫该侧颈内动脉结合麻醉控制性降压,回撤突出至瘤腔外的微导管快速以大圈成篮填塞动脉瘤腔(部分弹簧圈填塞至假性动脉瘤),止血确切后,继续致密填塞瘤腔。(2)A1段及大脑中动脉瘤止血栓塞确切后均等待1 h确认颅内血管无血栓及出血后结束手术。(3)术后腰椎穿刺引流血性脑脊液,术后密切复查CT明确脑室有无积血及出血吸收情况,术后第2天行脑血管造影并血管内给予尼莫地平以缓解血管痉挛。
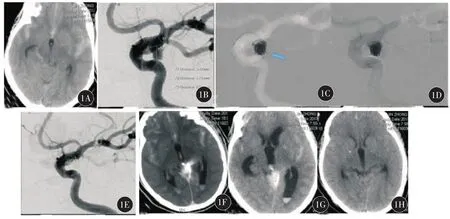
1A:术前头颅CT提示蛛网膜下腔出血;1B:左侧后交通动脉瘤;1C:术中弹簧圈刺破动脉瘤壁;1D:"冒烟"示造影剂外渗;1E:迅速继续填塞动脉瘤腔后造影未见造影剂外渗;1F:术后即刻头颅CT提示侧脑室内少量积血;1G:术后1 d头颅CT提示蛛网膜下腔出血消失,侧脑室仍有少量积血,脑室系统稍扩大;1H:经脱水降颅压治疗后,术后2 d头颅CT提示脑肿胀及脑室扩大较前改善,患者轻度头痛,神经科查体阴性。
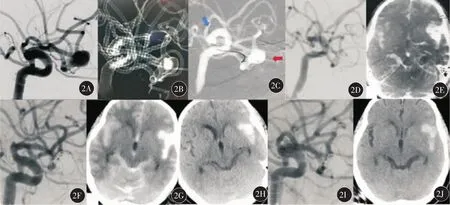
图2 典型病例2(女性,71岁,左侧大脑中动脉动脉瘤)微导管损伤瘤腔出血术中及术后表现
3.微导丝损伤远端小血管分支导致出血:1例复发中动脉巨大夹层动脉瘤,在支架经Floopy-300通过前一支架时,微导丝远端刺破远端小分支,迅速在微导丝导引下将微导管置于出血分支内造影确认出血自行停止,将微导管保留在分支内防止再次出血,继续栓塞动脉瘤后复查分支无再出血,患者术后头颅CT提示少量SAH,经对症治疗后mRS评分无增加(图3)。
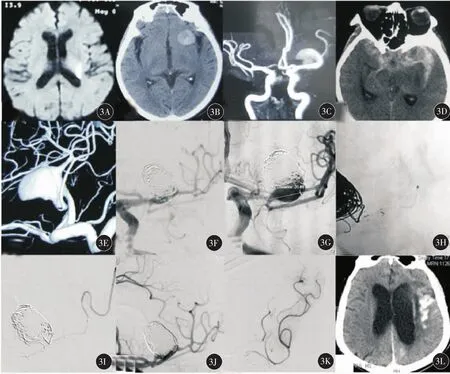
图3 典型病例3(女性,79岁)左侧丘脑脑梗后发现左侧大脑中动脉分叉部巨大夹层梭形动脉瘤支架辅助栓塞及复发再次治疗前后
二、术后出血
942例患者中术后出血3例(0.32%),其中破裂前交通动脉瘤1例、未破裂颈眼动脉瘤及大脑中动脉M1段巨大夹层动脉瘤各1例(图4-6)。破裂前交通动脉瘤(术后Raymond IIIa型),未破裂颈眼动脉瘤(术后Raymond I型),均在术后全身肝素化抗凝后出血,考虑破裂原因可能与非致密栓塞瘤腔及术后抗凝有关。第3例大脑中动脉动脉瘤患者于术后第2天情绪激动后出血,考虑出血原因可能与术后血压急剧波动有关。3例患者出现症状后即刻行头颅CT明确大量蛛网膜下腔出血,最终均抢救无效死亡。
讨 论
一、术中出血
既往文献报道颅内动脉瘤术中破裂出血率为0.5%~14.6%,出血后的致残或致死率高达 63%[4,14]。Kawabata等[15]报道未破裂颅内动脉瘤术中出血率为1.4%,并回顾既往文献的颅内未破裂动脉瘤术中破裂率为0.9%~2.4%,致残率及致死率分别为0.22%及0.15%;小动脉瘤(直径<5 mm)及前交通动脉瘤的术中破裂率更高,且微导管相关术中出血较导丝及弹簧圈所致的严重SAH更常见。Brisman等[16]分析了600个颅内动脉瘤的情况,术中出血率为1%,其中致残率0.2%,无致死病例。但在ATENA研究中,术中破裂发生率为2.6%,出血后致残率及致死率分别为27.8%及16.7%[17]。本研究分析了942例颅内动脉瘤患者情况,术中出血率极低,仅为0.96%,无一例致死或致残,考虑原因为术者的学习曲线,以及得益于本中心高效及时的预防及处理措施。

图4 病例(女性,63岁,破裂前交通动脉瘤)行支架辅助栓塞治疗前后

图5 病例2(女性,51岁,未破裂左侧颈眼动脉瘤)行双微导管栓塞治疗前后

图6 病例3(男性,38岁,右侧大脑中动脉M1段巨大夹层动脉瘤)行球囊闭塞试验后闭塞载瘤动脉栓塞治疗前后
(一)术中出血预防措施
1.旋转造影及三维重建选择多个工作角度,包括栓塞动脉瘤工作角度、支架到位及释放工作角度、暴露危险子瘤或薄弱点工作角度,如巨大动脉瘤内涡流明显,伴有偷流现象者,需行延迟相旋转造影(根据常规造影所显示流出道显示时间)以明确局部血流动力学特征及显示流入道、流出道的解剖关系。工作角度需要高帧数造影,至少每秒6帧,尽量在同一工作角度上满足以下所有要求:(1)栓塞动脉瘤工作角度:显示载瘤动脉及瘤颈的关系,为避免在栓塞微导管到位过程中避免损伤动脉瘤;(2)支架到位及释放工作角度:显示载瘤动脉、动脉瘤颈部及远端着陆血管,有利于支架的准确定位及释放,避免在推送支架输送系统时损伤远端分支;(3)暴露危险子瘤或薄弱点工作角度:清晰显示瘤颈与动脉瘤的关系,及动脉瘤薄弱点位置(子瘤);(4)工作角度动脉瘤及载瘤动脉的精确测量有利于选择合适的弹簧圈成篮,减少瘤颈部及瘤腔内反复操作。
2.当微导丝导引微导管到达远端分支后常规行微导管造影明确有无分支出血。
3.无论使用支架与否,术前不常规应用抗血小板聚集药物及肝素化,以降低术中出血的致死率。
4.如导引导管接近动脉瘤或近期破裂动脉瘤,造影剂用量可适当减少到原来的2/3,以防止动脉瘤破裂。
(二)术中破裂出血处理措施
1.若已行全身肝素化,应立即中和肝素,麻醉控制性降压,尽快栓塞动脉瘤破裂出血部位,加强脱水(甘露醇及速尿)。
(1)弹簧圈损伤瘤腔:如果弹簧圈刺破瘤腔,应继续迅速填塞出血部位,稳定无造影剂外渗后,可再上另一个微导管栓塞近端,将瘤体或瘤颈致密填塞。继续栓塞时要尽量减少造影剂注射量。一期手术避免置入支架,必要时二期手术,术中及时填塞瘤腔,一般出血量较少,止血确切后抗血小板聚集药物可继续使用。
(2)微导丝损伤细小分支:首先明确出血血管,如微导管能超选至该分支,则可选择填塞柔软小圈或Onyx胶闭塞该细小分支;如微导管到位困难者,可通过微导丝到达破裂部位,给予电凝止血。
(3)微导管损伤瘤腔:术中出血量较大,如动脉瘤位于前循环,术中迅速压迫该侧颈内动脉,同时麻醉师行控制性降压,迅速填塞动脉瘤腔;如微导管到位容易首选弹簧圈填塞,如微导管到位困难,可给予微导丝电凝止血。避免使用复杂技术错失早期最佳止血时机。
2.术后等待1 h确切止血,如有血栓及出血事件及时处理,并评估脑灌注循环时间及侧支代偿后方可结束手术。
3.术后给予腰穿引流血性脑脊液(15~20 ml),密切随访复查CT明确出血变化情况,术后第2天根据意识恢复情况复查血管造影,必要时于动脉内给予尼莫地平缓解血管痉挛。
4.术后即刻行Dyna CT明确脑室形态及积血情况,如有明显脑室积血建议急诊行脑室外引流[15-16]。
5.术后常规给予甘露醇、白蛋白脱水及止血等对症治疗。
二、术后出血
既往多数文献提示早期破裂再出血的发生率为1.0%~3.6%[5,18-19]。术后出血一般较凶猛,出血量大,症状重,患者预后差[18]。潘奇等[20]研究17例术后早期再出血患者,得出动脉瘤的真假性、术前动脉瘤的破裂次数、术中造影有明显的脑血管痉挛及动脉瘤的栓塞程度为术后早期再出血的影响因素,同时指出术后抗凝治疗可能会增加再出血的概率。本研究中有3例术后出血患者均病情危重,未能行造影检查,最终抢救无效死亡,考虑可能与瘤腔栓塞不全、术后抗凝治疗及术后血压急剧波动有关。如患者生命体征允许,可急诊行脑血管造影下栓塞出血动脉,必要时行去骨瓣减压术。
综上所述,在经验丰富的中心,颅内动脉瘤的血管内治疗是安全可靠的。术前不常规应用抗血小板聚集药物及肝素化可降低术中出血导致的致死率,及时识别及处理,多数患者预后良好。术后出血发生率低,但预后差,病死率高。术前充分评估危险因素,术中致密填塞瘤腔,术后慎用抗凝治疗,可改善出血患者的预后。

