绿茶、红茶和茯砖茶水提物对肠道微生物体外发酵特性的影响
侯爱香,颜道民,孙静文,郑旭,李赛丹*,肖润花,贝爽
绿茶、红茶和茯砖茶水提物对肠道微生物体外发酵特性的影响
侯爱香1,3,颜道民2,孙静文4,郑旭1,李赛丹4*,肖润花4,贝爽4
1. 湖南农业大学食品科学技术学院,湖南 长沙 410128;2. 湖南农业大学国际学院,湖南 长沙 410128;3. 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;4. 湖南农业大学东方科技学院,湖南 长沙 410128
为探究不同茶样的水提物与肠道微生物的互作效应,以健康大学生粪便为菌源,采用体外厌氧发酵模式,结合传统培养技术和气相色谱法,研究绿茶、红茶和茯砖茶的水提物24 h体外发酵过程中pH值、短链脂肪酸、肠道微生物的变化,并计算益生元指数PI(Prebiotic Index)和B/E值()。结果表明绿茶、红茶和茯砖茶水提物均会引起发酵液的pH大幅下降,其中茯砖茶组的pH下降幅度最大。同时,3种茶叶水提物都能显著增加短链脂肪酸的产量,其中绿茶对乙酸、丙酸、异丁酸、异戊酸、戊酸和总短链脂肪酸的提高效果最佳,而茯砖茶对丁酸的提高幅度最大。3种茶叶水提物都能调节肠道微生物的结构组成,促进双歧杆菌的增长,抑制拟杆菌、肠杆菌和梭状芽孢杆菌的生长;其中茯砖茶组对双歧杆菌的促进作用最大,对肠杆菌和梭状芽孢杆菌的抑制效果最明显,绿茶组对拟杆菌的抑制效果最大;但绿茶组和红茶组都能促进乳杆菌的增殖,茯砖茶组却表现出抑制作用。另外通过分析PI值和B/E值,发现绿茶、红茶和茯砖茶组都具有良好的益生作用,4 h阶段茯砖茶组的益生元指数PI值最大,发酵8、12、24 h阶段绿茶组益生元指数PI值最大;而整个发酵过程茯砖茶组的B/E均保持最大。本研究为不同茶叶在青年消费市场中的进一步扩大推广提供了基础数据和科学依据。
绿茶;红茶;茯砖茶;体外发酵;短链脂肪酸;肠道微生物
人体肠道栖居着大量微生物,它们在肠道中形成了一个极其复杂的生态系统,越来越多的研究[1-2]表明肠道微生物与人体健康密切相关。人体肠道菌群失调或紊乱会导致各种疾病如糖尿病、高血压、心脑血管疾病、代谢综合征、肠胃炎症、抑郁症甚至自身免疫性疾病等的发生[3-5]。膳食是影响人体肠道健康最重要的因素之一,而肠道菌群参与膳食营养素的消化吸收、能量的供给、酶的形成和代谢产物的合成等多个过程,一方面它能提高膳食因子的生物活性和生物利用率,另一方面肠道菌群又反过来直接影响宿主免疫系统发育,调节新陈代谢、影响健康[6-7]。随着人类微生物组(Human Microbiome Project,HMP)和人体肠道元基因组研究计划(Metagenomics of the Human Intestinal Tract,MetaHIT)等项目研究的持续推进,人们对肠道微生物的关注越来越多。大量研究从肠道微生物的角度关注食品甜味剂、食品乳化剂、益生元、微量元素、功能性成分、多酚类化合物等膳食因子对机体的影响,肠道微生物与膳食因子互作已成为人类阐释膳食因子调控健康研究的热点和着眼点[8-9]。
茶叶中含有茶蛋白、茶多酚、茶多糖和咖啡碱等多种功效成分,具有降血糖、降血脂、降血压、抗血栓,增强机体免疫力、抗氧化、抗菌和抗辐射等多种生理功能,作为保健食品和药品具有广阔的开发前景[10]。青年人作为饮料消费的主体人群,与40岁以上人群比较,其饮用茶的频次相对较低[11]。而大量调查显示,年轻群体未来总体饮茶意愿较高,对饮品的健康要求较高,茶叶青年人的消费市场开发潜力较大[12-14]。如何引导青年群体茶叶消费意愿,催发茶叶在大健康产业中蓬勃发展意义深远。为此,借鉴文献[15]食品与肠道微生物互作研究的新模式,旨在通过人体肠道微生物体外发酵模型,分析发酵过程中不同茶叶水提物引起肠道微生物体外发酵体系中pH值、主要肠道菌群和SCFAs的变化情况,并结合益生元指数PI值和肠道定殖能力指标B/E值的改变,从而探究青年人肠道菌群与绿茶、红茶和茯砖茶水提物的体外互作效应,借此为以后学者们进一步研究不同茶营养与保健作用提供基础数据,为茶叶在青年消费市场中的进一步扩大推广提供科学依据。
1 材料与方法
1.1 材料与试剂
红茶、绿茶和茯砖茶由湖南省白沙溪茶厂股份有限公司提供;Wilkins-Chalgren琼脂来自青岛高科技工业园海博生物技术有限公司;Enterococcus琼脂购自北京陆桥技术有限责任公司;紫红胆盐葡萄糖琼脂培养基、BBL琼脂培养基和MRS琼脂培养基均购自广东环凯微生物科技有限公司;乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸均购自美国Sigma公司;拟杆菌矿物盐琼脂按照配方[16]自制:葡萄糖15.0 g·L-1,磷酸二氢钾4.0 g·L-1,磷酸氢二钠2.0 g·L-1,硫酸铵0.5 g·L-1,氯化钠9.0 g·L-1,氯化镁0.15 g·L-1,氯化钙0.01 g·L-1,氯化锰0.05 g·L-1,氯化钴0.05 g·L-1,半胱氨酸0.8 g·L-1,碳酸氢钠1.5 g·L-1,氯高铁血红素0.01 g·L-1,VB120.005 g·L-1,七水合硫酸铁0.001 g·L-1,萘啶酮酸0.01 g·L-1,万古霉素0.002 5 g·L-1,琼脂20.0 g·L-1;含氮基础培养基[17]:1 L纯净水含有蛋白胨2 g,酵母粉2 g,NaCl 0.1 g,K2HPO40.04 g,MgSO4·7H2O 0.01 g,CaCl2·7H2O 0.01 g,NaHCO32 g,氯化血红素0.05 g,L-半胱氨酸0.5 g,胆汁酸盐0.5 g,吐温-80 2 mL,VK 10 μL,0.25 mg·mL-1刃天青4 mL,pH 6.7。试验用水均是超纯水,培养基均经过高压蒸汽灭菌。
1.2 仪器设备
JY92-ⅡB超声波细胞粉碎机,宁波科生仪器厂;TG16-WS高速台式离心机,长沙湘仪离心机仪器有限公司;循环水式多用真空泵SHB-Ⅲ,郑州长城科工贸有限公司;旋转蒸发仪RE-52,上海亚荣生化仪器厂;YQX-Ⅱ厌氧培养箱,上海跃进医疗器械厂;恒温生化培养箱SPX-250BS-Ⅱ,上海博迅实业有限公司医疗设备厂;pH计FE20PLus,梅特勒-托利多仪器(上海)有限公司;高压蒸气灭菌锅SP500,日本YAMATO;C-43圆底立式培养袋,日本三菱瓦斯化学株式会社;C-1厌氧产气袋,日本三菱瓦斯化学株式会社;安捷伦7890A气相色谱仪,安捷伦科技有限公司。
1.3 试验方法
1.3.1 茶水提物的制备
将绿茶、红茶、茯砖茶粉碎,称取茶末各10 g,按料液比1∶50加入蒸馏水,70℃保温浸提30 min,超声波辅助二次浸提10 min,然后以5 000 r·min-1的转速离心10 min,取上清液并抽滤,之后将茶水置于旋转蒸发仪浓缩,最后真空冷冻干燥成冻干粉。
1.3.2 不同茶水提物与肠道微生物体外厌氧发酵
采集3位健康女大学生志愿者的新鲜粪便(采样对象3个月内未服用抗生素,无肠胃病史,且非生理期),再将3份粪样混合均匀,按10%的浓度在pH为7的生理盐水中稀释,过滤得肠道菌群悬液。将肠道菌群悬液按10%的接种量,分别加入Control组(含氮基础培养基)、GR-T组(含氮基础培养基加1%绿茶水提物)、BL-T组(含氮基础培养基加1%红茶水提物)和FD-T组(含氮基础培养基加1%茯砖茶水提物),在37℃恒温条件下进行静态厌氧发酵,所有试验进行3次生物学重复。分别于0、4、8、12、24 h取样,用于检测pH值、短链脂肪酸和主要肠道微生物。
1.3.3 pH值的检测
采用pH计直接计数法。
1.3.4 短链脂肪酸的检测
样品处理:将发酵液在转速为10 000 r·min-1的离心机上离心20 min,取上清液,按9∶1的比例加入25%偏磷酸,静置反应3 h后,通过0.22 µm的纤维滤纸,除去肉眼可见杂质,于冰箱保存。
SCFAs采用气相色谱外标法测定,用乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸作标准曲线。将6种短链脂肪酸标准样品分别配置成不同浓度的标准溶液(10~60 mmol·L-1),上机分析得到标准曲线。以3倍的信噪比(SAN)计算6种短链脂肪酸的检出限。
气相色谱测定条件:用氢火焰检测器(FID),载气为N2,分流比50∶1,流速为0.8 mL·min-1,用DB-FFAP色谱柱;升温程序:初始温度60℃,以20℃·min-1升到220℃保持1 min;燃烧炉温度为280℃,进样口温度为250℃,进样量为1 μL。
1.3.5 主要肠道微生物类群计数
在严格的厌氧环境中,采用10倍梯度稀释法,选择合适的稀释度吸取100 μL稀释液均匀涂布于不同的选择培养基上,装入厌氧袋,其中乳酸杆菌、肠球菌和大肠杆菌在37℃厌氧培养24~48 h,总厌氧菌和双歧杆菌在37℃厌氧培养48~96 h。
1.4 数据分析
1.4.1 益生元指数计算
益生元指数(Prebiotic Index,PI)是通常评价人体肠道菌群是否正常与平衡的一个重要指标,Palframan等[18]采用的PI计算方法为众多研究者所采纳。PI计算公式如下:
PI=(Bif/Total)-(Bac/Total)+(Lac/Total)-(Clos/Total)
式中,Total是指取样时发酵液中总肠道菌数量(以总厌氧菌数代替)/初始总肠道菌数;Bif是指取样时发酵液中双歧杆菌数量/初始双歧杆菌数;Lac是指取样时发酵液中乳酸杆菌数量/初始乳杆菌数;Bac是指取样时发酵液中拟杆菌数量/初始拟杆菌数;Clos是指取样时发酵液中梭状芽孢杆菌数量/初始梭状芽孢杆菌数。
1.4.2 B/E值的计算
B/E值为肠道内双歧杆菌和肠杆菌数量的比值。早在上个世纪的70年代,Van Der Waaij等[19]荷兰学者就将其作为肠道菌群定殖能力的指标,一定程度上反映肠道菌群结构。
1.4.3 数据统计与分析
试验均设计了3个生物学重复,每个样品进行3次独立样品的测定,结果以±s表示,并运用SPSS 21.0软件的单因素分析方法(ANOVA)进行显著性分析;数据图通过Origin 2017软件完成。
2 结果与分析
2.1 不同时间段发酵液pH值的变化
pH值是反映肠道微生物与绿茶、红茶和茯砖茶水提物体外互作环境体系酸碱度的指标,肠道微生物通过代谢营养物质,产生不同的有机酸、短链脂肪酸等代谢产物,会改变肠道微生物发酵环境的酸碱度,不同发酵体系的pH值测定结果如表1所示。
由表1可以得出,随着发酵时间的延长,各发酵体系的pH都呈现下降趋势,且变化曲线的趋势大致相同,各试验组在发酵的前8 h内pH普遍下降较快,随后下降速度逐渐趋于平缓。密闭发酵环境中,前期底物充足,肠道微生物生长速度快,活性高,代谢产生较多酸性物质,如有机酸、短链脂肪酸等,pH下降快;随着营养物质慢慢被消耗,肠道微生物生长和代谢水平下降,其pH的变化幅度不大,保持在较低水平。另外通过24 h体外发酵,空白对照组的pH下降约1.0左右,添加绿茶、红茶和茯砖茶的发酵液分别下降约2.2、2.1、2.3左右。因此说明饮用绿茶、红茶和茯砖茶均会较大程度迅速降低肠道内的pH,调节肠道微生态环境,从而通过酸性环境调节肠道菌群的结构组成。
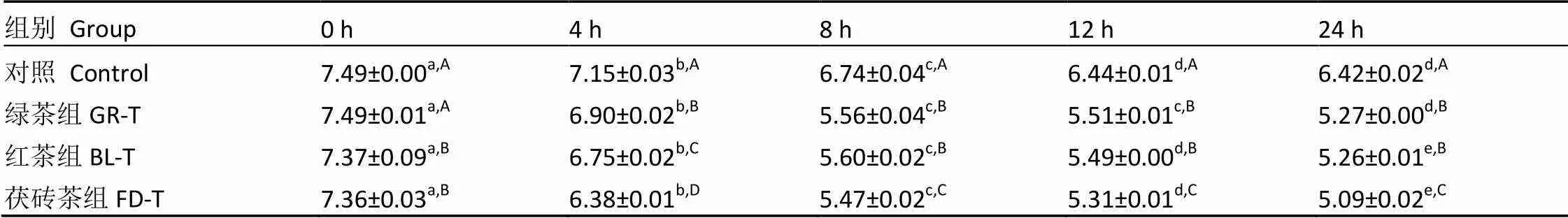
表1 各发酵体系不同发酵时间的pH
注:不同小写字母表示同行的数据差异显著,<0.05;不同大写字母表示同列的数据差异显著,<0.05
Note: Mean value with different lowercase letters in the same row was significantly different (<0.05). Mean value with different uppercase letters in the same column was significantly different (<0.05)
2.2 不同时间段发酵液中短链脂肪酸的变化
本文采用气相色谱法测定不同时间段各样品中短链脂肪酸的含量,以外标法定量,发现6种短链脂肪酸都可以被气相色谱柱有效的分离,各酸的标准品气相色谱图如图1所示,乙酸的保留时间分别为10.852 min,丙酸为11.437 min,异丁酸为11.618 min,丁酸为12.039 min,异戊酸为12.314 min和戊酸为12.794 min,各短链脂肪酸区分清楚,该方法可以用于后续发酵体系中样品的检测。
短链脂肪酸是肠道微生物菌群发酵过程中重要的代谢产物,本研究测定了乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸6种主要的短链脂肪酸,涵盖了肠道微生物代谢的短链脂肪酸的基本种类。表2为发酵过程中对照组和3个试验组的6种短链脂肪酸乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸和总短链脂肪酸的含量统计表。
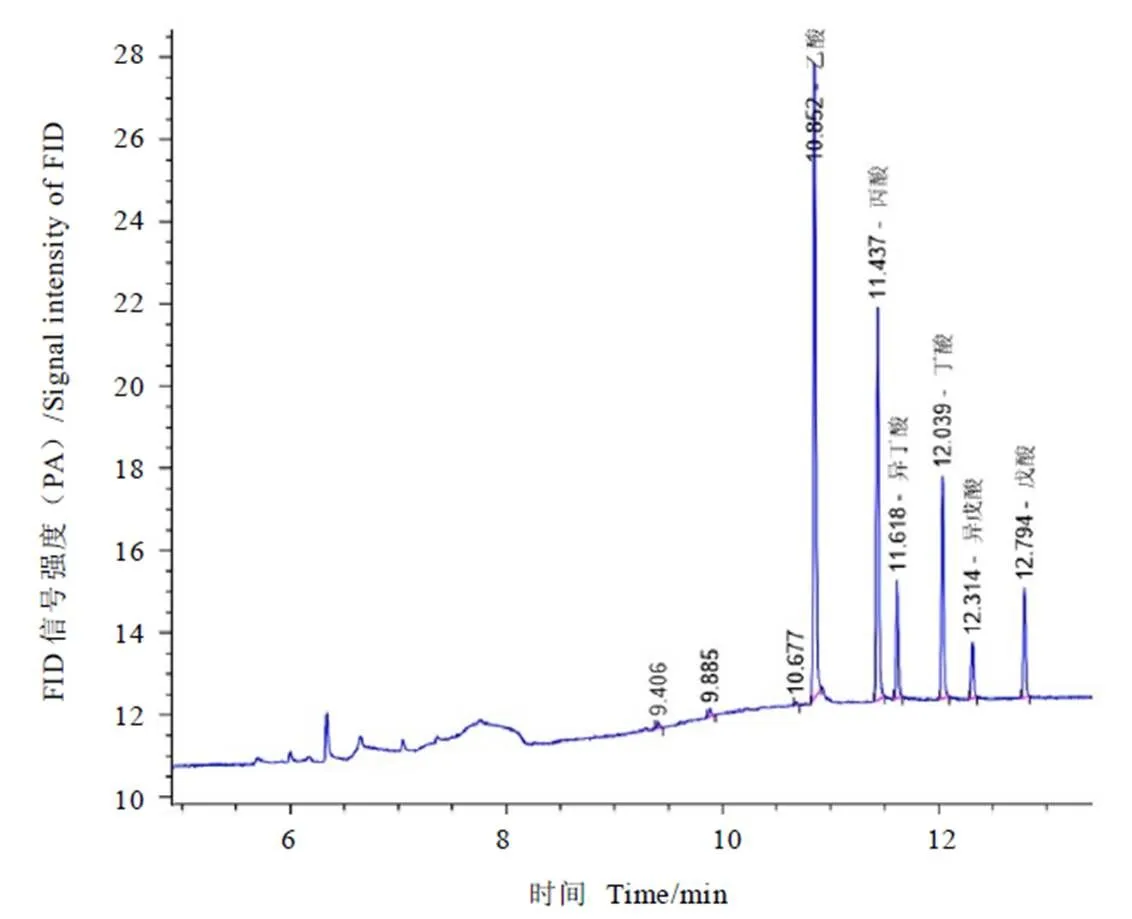
图1 标准样品GC图谱
由表2可知,总短链脂肪酸在24 h体外发酵过程中随着时间的延续含量持续增加。其中体外发酵过程的前12 h,总短链脂肪酸含量FD-T>BL-T>GR-T>Control,而在24 h时总短链脂肪酸含量则变成GR-T>BL-T>FD-T>Control。跟对照组相比,说明绿茶、红茶和茯砖茶水提物都会在肠道内被微生物降解利用生成大量短链脂肪酸,短链脂肪酸是影响发酵体系pH大小的主要因素之一,其含量不断增加导致发酵体系pH不断下降,进而调节肠道菌群结构与组成。同时,发现前12 h发酵体系中FD-T组的短链脂肪酸增幅最大,增速最快,红茶次之,绿茶最慢。分析原因可能是茯砖茶制作经过渥堆、发花,茶叶中生长了大量微生物,特别是“金花菌”,这些微生物已经把茶叶中部分大分子化合物分解成了小分子的中间产物,肠道微生物更容易利用这些小分子的中间产物;红茶制作也经过了发酵,但发酵程度不如茯砖茶完全,绿茶制作未经过发酵;因此FD-T组的短链脂肪酸含量在体外发酵前期生成量大,生成速度快,红茶稍慢,而绿茶最慢。但在后期,由于绿茶水提物中大分子营养物质不断被肠道微生物分解利用,短链脂肪酸持续在体外发酵系统中大幅增多;而红茶和茯砖茶水提物中的大分子营养物质在茶叶制作过程中就因微生物发酵被消耗了部分,随着其中间产物不断被消耗,后期可供肠道微生物利用吸收的大分子物质明显不如绿茶,因此在24 h时,绿茶的短链脂肪酸含量最大。
由表2可知,对照组和3组试验组主要产生的短链脂肪酸都是乙酸、丙酸和丁酸,这个结果与张鑫等[20]的研究结果相一致。其中,乙酸是各组中含量最高的短链脂肪酸,其变化规律与总短链脂肪酸的一致,发酵结束后,绿茶、红茶和茯砖茶组的乙酸含量分别达到了:(1 060.79±1.47) μg·mL-1,(966.25±3.07) μg·mL-1和(791.92±1.86) μg·mL-1,都远远高于对照组[(505.11±0.48) μg·mL-1]。丙酸是各组中仅次于乙酸含量的短链脂肪酸,其变化规律与总短链脂肪酸、乙酸略有不同,发酵结束后绿茶、红茶和茯砖茶组的丙酸含量分别达到了(608.31±1.73) μg·mL-1,(602.85±1.68) μg·mL-1和(414.98±0.69) μg·mL-1,都远远大于对照组[(271.24±0.77) μg·mL-1];但茯砖茶组最高含量出现在发酵12 h阶段[(474.04±1.39) μg·mL-1],说明发酵后期,茯砖茶组的部分丙酸作为碳源被肠道微生物吸收利用了。丁酸是各组中含量第三的短链脂肪酸,发酵结束后各组丁酸含量变化规律为FD-T>GR-T>BL-T>Control,绿茶、红茶和茯砖茶组分别达到(116.18±0.77) μg·mL-1、(115.07±1.57) μg·mL-1和(133.05±0.88) μg·mL-1,都远远高于对照组的(73.81±0.22) μg·mL-1,但绿茶组和红茶组之间的差异不大。异丁酸、异戊酸和戊酸各组含量都较小,但各试验组异丁酸、异戊酸和戊酸含量较对照组也有较大提升,发酵结束后,其中异丁酸和戊酸含量的大小规律是GR-T>FD-T>BL-T>Control,异戊酸含量的大小顺序为GR-T>BL-T>FD-T>Control。

表2 各发酵体系不同发酵时间短链脂肪酸浓度表 μg·mL-1
备注:不同小写字母表示同列的数据差异显著,<0.05
Note: Mean value with different lowercase letters in the same column was significantly different (<0.05)
由此可以得出,绿茶、红茶和茯砖茶不仅都能提高发酵体系中总短链脂肪酸含量,还能分别提高乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸的含量。发酵结束时,绿茶对乙酸、丙酸、异丁酸、异戊酸、戊酸和总短链脂肪酸的提高效果最佳,而茯砖茶对丁酸的提高效果最好。
2.3 不同时间段发酵液中肠道微生物的变化
2.3.1 主要肠道微生物菌群数量的变化
本研究根据益生元指数PI值和B/E值的计算公式,采用传统选择性培养基,对两公式涉及的肠道微生物进行分别培养计数,即体外发酵过程中的双歧杆菌、乳酸杆菌、拟杆菌、梭状芽孢杆菌、肠杆菌和总厌氧菌,这6类菌数量变化规律如图2-A—F所示。
由图2可知,与肠杆菌、乳杆菌和梭状芽孢杆菌数相比,拟杆菌和双歧杆菌是主要的优势。总厌氧菌数量不等于肠杆菌、乳杆菌、梭状芽孢杆菌、拟杆菌和双歧杆菌之和,因为肠道菌群种类丰富,且很多种类无法通过传统方法进行培养。
由图2-A可知,添加茶叶水提物的发酵体系中双歧杆菌数量都在12 h时达到最高,绿茶、红茶、茯砖茶的分别为(7.83±0.04) lgCFU·mL-1、(7.31±0.05) lgCFU·mL-1、(7.96±0.10) lgCFU·mL-1,随后缓慢下降;而对照组的双歧杆菌数量最大值出现在8 h阶段为(6.16±0.04) lgCFU·mL-1,随后大幅度下降。发酵结束时,试验组中绿茶组、红茶组、茯砖茶组的双歧杆菌数分别为(7.56±0.02) lgCFU·mL-1、(7.27±0.04) lgCFU·mL-1、(7.61±0.08) lgCFU·mL-1,均远远高于空白对照组的(5.68±0.05) lgCFU·mL-1。由此看出3种茶水提物对双歧杆菌的生长有明显的促进增殖的作用,且能延长双歧杆菌的对数生长期。同时,不同茶水提物对双歧杆菌生长的影响作用存在显著性差异,发酵12~24 h阶段对双歧杆菌生长促进作用的大小规律为:FD-T>GR-T>BL-T,该规律与丁酸产量的规律一致。
由图2-B可知,与对照组相比,整个发酵过程中,红茶组乳杆菌数在前8h阶段迅速增长,12 h略有回落,但红茶组始终促进乳杆菌的生长,大于对照组的乳杆菌数;绿茶组在发酵前8 h均促进乳杆菌生长,但12 h阶段乳杆菌数小于对照组,在24 h时又大幅度高于其他3组;茯砖茶组发酵过程中一直呈上升趋势,没有出现回落现象,但直到发酵结束的24 h,其乳杆菌数还比对照组小。由此得出,在24 h体外互作的过程中,红茶、绿茶总体呈促进乳杆菌增长的趋势,而茯砖茶不能促进乳杆菌生长。
由图2-C可知,与对照组相比,整个发酵过程中所有试验组都能抑制拟杆菌的生长,其抑制作用的大小规律为GR-T>BL-T>FD-T,其与发酵结束后总短链脂肪酸、乙酸和异戊酸含量大小规律一致。由图2-D可知,与对照组相比,整个发酵过程中所有试验组都能抑制肠杆菌的生长,其抑制作用的大小规律为FD-T>GR-T>BL-T。由图2-E可知,与对照组相比,整个发酵过程中所有试验组都能抑制梭状芽孢杆菌的生长,其抑制作用的大小规律为FD-T>GR-T>BL-T,与对肠杆菌的抑制作用一致。由图2-F可知,各茶的水提物对总厌氧菌在各时间段呈现的抑制或促进作用不一样,但在发酵结束时均呈促进作用,其中促进作用大小规律为FD-T>BL-T>GR-T。
综上所述,不同茶水提物都可以明显增加体外厌氧发酵体系中双歧杆菌的数量,其中茯砖茶的促进作用最大;都能明显抑制拟杆菌、肠杆菌和梭状芽孢杆菌的数量,绿茶对拟杆菌的抑制作用最大,而茯砖茶对肠杆菌和梭状芽孢杆菌的抑制作用最大;但对乳杆菌红茶和绿茶组呈促进作用,茯砖茶呈抑制作用;3种茶水提物对总厌氧菌不同时间段呈现出不同的促进或抑制作用。因此,绿茶、红茶和茯砖茶水提物都能调节肠道菌群的结构组成,促进肠道菌群平衡。
2.3.2 PI和B/E
将图2中的数据带入益生元指数PI和B/E的计算公式,将计算结果做成直观的折线图,PI值如图3所示,B/E值如图4所示。
Palframan等[18]提出益生元指数(Prebiotic index,PI),其是用作衡量低聚果糖益生元作用的指标,借此避免因取样接种不均衡、初始菌数量和总菌数量不一致所导致的试验结果偏差。本研究借鉴使用益生元指数PI,用以评价不同茶叶水提物的益生作用。由图3可知,试验组的益生元指数PI均在12 h阶段达到最大值,且空白组益生元指数在体外发酵过程的各个时间段显著低于试验组,说明3种茶叶水提物的添加,都在体外发酵系统中表现出益生作用。其中4 h阶段茯砖茶组的益生元指数最大,而发酵8、12、24 h阶段益生元指数绿茶组最大。
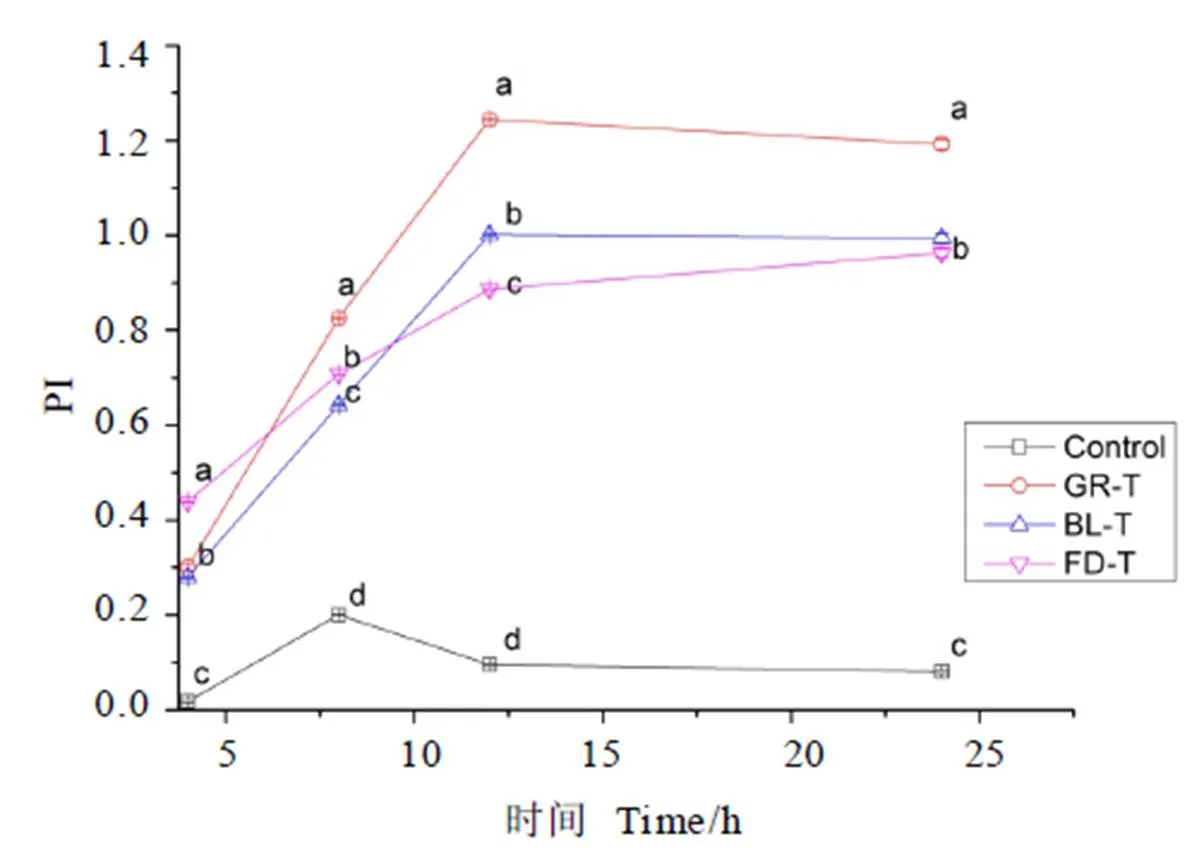
注:不同小写字母表示同一时间数据差异显著,P<0.05
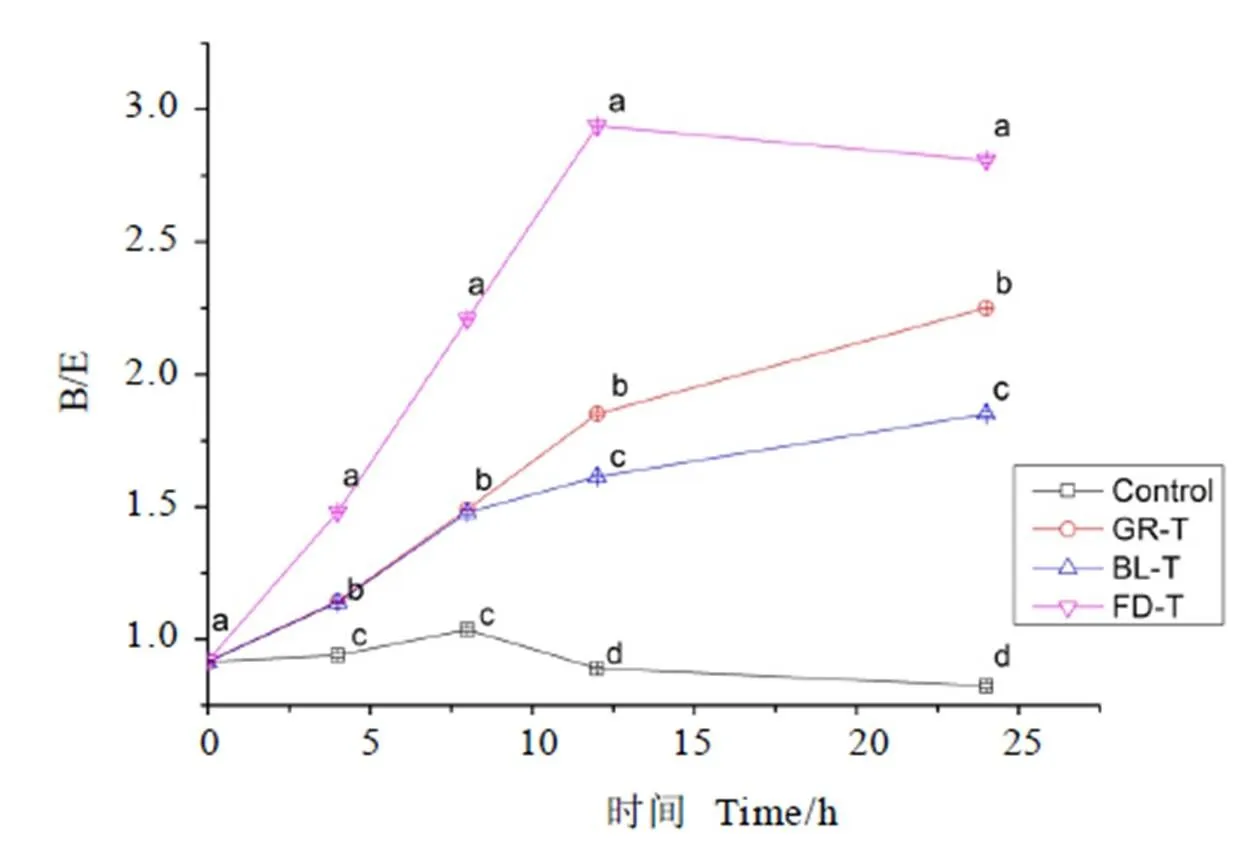
注:不同小写字母表示同一时间数据差异显著,P<0.05
B/E>1表示该肠道菌群体系中双歧杆菌数量高于肠杆菌,可改善肠道菌群结构,有利肠道有益菌定殖;B/E<1表示该肠道菌群体系中双歧杆菌数量低于肠杆菌,无特殊改善肠道菌群作用。由图4可知,空白组的B/E值均小于1,说明没有添加茶叶水提物的基础发酵液体系中双歧杆菌没能形成优势菌。而所有试验组的B/E值在同一发酵时间远大于空白组,B/E值在各发酵体系的大小规律为:FD-T>GR-T>BL-T>Control,说明3种茶均能够改善肠道菌群结构。
3 讨论
茶叶中含有大量活性物质,长期以来,茶叶的减肥、降血糖、增强免疫、抑制癌细胞增殖,甚至是调节相关代谢性疾病等功能活性受到人们的广泛关注[21-23]。随着研究的深入,学者们逐渐发现茶叶中多酚和多糖对肠道微生物的调节可能是茶叶发挥其活性主要作用的靶点之一[24]。研究发现,3种茶的水提物都能大幅度提高短链脂肪酸的产量,促进有益菌的生长,同时抑制有害菌的生长,但绿茶、红茶和茯砖茶由于制作工艺的差异,其营养物质成分也有差异,因此其功效上也有着各自的特点,这一研究结果与刘平等[25]、傅冬和等[22]、岳随娟等[26]和郭虹雯等[27]的研究结论一致。
24 h体外发酵过程中,绿茶、红茶和茯砖茶3种茶水提物都能显著降低发酵体系的pH值,其中FD-T组茯砖茶发酵体系下降幅度显著大于GR-T组绿茶发酵体系和BL-T组红茶发酵体系。绿茶、红茶和茯砖茶3种茶水提物都能显著提高发酵体系中总短链脂肪酸的含量,发酵前12 h的总短链脂肪酸含量变化与pH值变化规律相符;但24 h阶段FD-T组茯砖茶发酵体系中pH值最低,而此时总短链脂肪酸含量却远小于GR-T组绿茶发酵体系和BL-T组红茶发酵体系,出现这一矛盾,可能在茯砖茶发酵体系中存在有机酸等代谢产物,如乳酸等有机酸的存在也会影响发酵体系的pH值,谢旻皓等[28]就同时研究了苦丁茶发酵体系中乳酸的含量,因此本研究各发酵体系中的有机酸含量值得进一步研究探讨。同时,发现3种茶叶水提物发酵体系中的主要短链脂肪酸都是乙酸、丙酸和丁酸,且3种茶叶水提物都不仅能明显提高乙酸、丙酸和丁酸含量还能提高异丁酸、异戊酸和戊酸含量。乙酸能作为周边组织的能源,参与肌肉、心脏、肝脏和脑内的代谢活动,还是胆固醇合成的主要底物,有着重要的生理功能[29]。丙酸也有着重要的生理功能,研究表明其能抑制胆固醇的合成,降低血糖和胰岛素水平,调节碳水化合物和脂肪代谢[30]。丁酸被誉为最重要短链脂肪酸之一,被充分证实的还有抗炎证、抗癌变效果,基于丁酸在维持肠道健康过程中所起的作用,甚至有研究者认为新型益生元的设计要寻找可以提高丁酸产量的营养物质[31]。说明3种茶叶水提物都能提高短链脂肪酸的含量,有利于调节人体身体健康,但绿茶对乙酸、丙酸、异丁酸、异戊酸、戊酸和总短链脂肪酸的提高效果最佳,而茯砖茶对丁酸的提高效果最好。
此外,本研究采用健康青年人体粪便作为菌源能真实反映人体肠道微生物结构组成,模拟肠道环境的体外发酵系统这种模式快捷、方便,能在一定程度上反映肠道菌群的变化规律,且这种方法也逐渐成为人们研究肠道微生物与膳食因子互作的常用方法,如Palframan等[18]、Vernazza等[32]、Sanchez-Patan等[33]、吴根梁等[24]、Zhang等[20]和谢旻皓等[28]国内外学者都采用了体外发酵系统的模式。本研究发现3种茶水提物都可以明显增加体外厌氧发酵体系中双歧杆菌的数量,特别是茯砖茶的促进作用最大,这与其发酵体系中pH值最低的结果相符。3种茶叶水提物都能明显抑制拟杆菌、肠杆菌和梭状芽孢杆菌的数量;绿茶对拟杆菌的抑制作用最大,而茯砖茶对拟杆菌的抑制效果有限;但茯砖茶对肠杆菌和梭状芽孢杆菌的抑制作用最大;这些结果与吴根梁等[24]、刘平等[25]对茯砖茶的研究结果一致。值得特别关注的是,我们发现红茶和绿茶组对乳杆菌呈促进作用,但茯砖茶则呈一定的抑制作用,一方面与茯砖茶发酵体系中双歧杆菌和拟杆菌的数量较多有关,另一方面可能与茯砖茶水提物中含有金花菌相关成分有关,还值得进一步探究。
资料显示,人的胃肠道栖息着约30多个属500多种细菌,主要由厌氧菌和兼性厌氧菌组成,其中专性厌氧菌占99%以上[34]。因此,本研究PI指数公式中的总菌数以总厌氧菌数计。通过计算PI值,说明3种茶的水提物对人体都有明显的益生作用,4 h阶段茯砖茶组的益生元指数最大,而发酵8、12、24 h阶段益生元指数绿茶组最大。通过计算B/E值,说明3种茶水提物对人体都有明显的益生作用,但茯砖茶组的B/E最大,益生效果最明显。此外,膳食益生效果的评价还有其他指标,如郭虹雯等[27]通过F/B值(厚壁菌门/拟杆菌门)研究绿茶对肥胖的影响作用,Jelena等[35]以益生元效果指数(Measurement of prebiotic effect,MPE)评价膳食因子的益生效果,这些指数我们都可以借鉴。同时,由于传统培养方法本身的局限,粪便中还存在大量未被培养的肠道微生物,且传统培养计数操作繁琐,工作量大,培养效率和精准性都有待提高,且各种茶水提物对肠道微生物多样性的影响作用无法体现,后续还可进一步通过高通量测序来探究3种茶水提物与肠道微生物的互作效应。
因此,通过以上研究和分析得出,青年人适当饮用绿茶、红茶和茯砖茶都可以调节身体健康,3种茶水提物与对照组相比均会引起肠道环境pH值的大幅下降;都能显著增加短链脂肪酸的产量,调节肠道微生物的结构组成,促进双歧杆菌的增长,抑制拟杆菌、肠杆菌和梭状芽孢杆菌的生长;且通过分析PI值和B/E值,发现绿茶、红茶和茯砖茶组都具有良好的益生作用。但由于3种茶叶的制作工艺和营养物质成分的差异,其与肠道微生物互作效应又有各自特点;其中茯砖茶组pH值下降幅度最大,对短链脂肪酸中丁酸的提高效果最佳,对双歧杆菌的促进作用最好,对肠杆菌和梭状芽孢杆菌的抑制效果最明显,发酵4 h阶段的益生元指数PI值最大,且整个发酵过程的B/E均保持最大;绿茶组对乙酸、丙酸、异丁酸、异戊酸、戊酸和总短链脂肪酸的提高效果最佳,对拟杆菌的抑制效果最好,发酵8、12、24 h阶段的益生元指数PI值最大;但绿茶组和红茶组都能促进乳杆菌的增殖,茯砖茶组却表现出抑制作用。本研究模拟肠道系统进行体外厌氧发酵,使不同茶的水提物直接与粪便微生物作用,而实际饮茶过程,茶叶部分营养成分会在小肠段被吸收利用,因此在人体中是否出现同样的功效还有待进一步深入研究和验证。
[1] Clemente J C, Ursell L K, Parfrey L W, et al. The impact of the gut microbiota on human health: an integrative view [J]. Cell, 2012, 148(6): 1258-1270.
[2] 朱莹莹, 李春保, 周光宏. 饮食,肠道微生物与健康的关系研究进展[J]. 食品科学, 2015, 36(15): 234-239.
[3] Cotillard A, Kennedy S P, Kong L C, et al. Dietary intervention impact on gut microbial gene richness [J]. Nature, 2013, 500(7464): 585-588.
[4] Tremaroli V, Bäckhed F. Functional interactions between the gut microbiota and host metabolism [J]. Nature, 2012, 489(7415): 242-249.
[5] 刘月新, 叶良金. 茶多糖的研究进展[J]. 茶业通报, 2016(1): 38-43.
[6] Chen G, Yuan Q, Saeeduddin M, et al. Recent advances in tea polysaccharides: Extraction, purification, physicochemical characterization and bioactivities [J]. Carbohydrate Polymers, 2016, 153: 663-678.
[7] David L A, Maurice C F, Carmody R N, et al. Diet rapidly and reproducibly alters the human gut microbiome [J]. Nature, 2014, 505(7484): 559-563.
[8] 陈卫. 肠道菌群: 膳食与健康研究的新视角[J]. 食品科学技术学报, 2015, 33(6): 1-6.
[9] 翟齐啸, 田丰伟, 王刚, 等. 肠道微生物与人体健康的研究进展[J]. 食品科学, 2013, 34(15): 337-341.
[10] 李娟, 活泼, 杨海燕. 茶叶功效成分研究进展[J]. 浙江科技学院学报, 2005(4): 285-289.
[11] 管曦, 杨江帆, 谢向英, 等. 基于CKB数据的中国茶叶消费行为研究[J].茶叶科学, 2018, 38(3): 287-295.
[12] 李家华, 卢晓慧, 蒋梦瑶, 等. 高校大学生茶叶消费情况与消费观念的调查分析[J]. 安徽农业科学, 2012, 40(34): 16903-16905.
[13] 蓝婷, 屠幼英. 在杭大学生对茶及茶产品的消费与剖析[J]. 中国茶叶加工, 2008(1): 13-16.
[14] 杜佩, 姜爱芹, 姜仁华, 等.基于城市视角的年轻群体茶叶消费意愿与引导策略[J].中国茶叶加工, 2017, 3(4): 21-27
[15] 支梓鉴, 俞邱豪, 程焕, 等. 肠道微生物体外发酵模型研究进展及其在食品中的应用[J]. 食品工业科技, 2016, 37(14): 353-358.
[16] Macfarlane G T, Hay S, Gibson G R. Influence of mucin on glycosidase, protease and arylamidase activities of human gut bacteria grown in a 3-stage continuous culture system [J]. Journal of Applied Microbiology, 1989, 66(5): 407-417.
[17] Olano-Martin E, Mountzouris K C, Gibson G R, et al.fermentability of dextran, oligodextran and malt odextrin by human gut bacteria [J]. Br J Nutr, 2000, 83(3): 247-255.
[18] Palframan R, Gibson G R, Rastall R A. Development of a quantitative tool for the comparison of the prebiotic effect of dietary oligosaccharides [J]. Letters in Applied Microbiology, 2003, 37(4): 281-284.
[19] Van der Waaij D, Berghuisde Vries J M, Lekkerkerk L. Colonization resistance of the digestive tract in conventional and antibiotic-treated mice [J]. Journal of Hygiene, 1971, 69(3): 405-411.
[20] Xin Zhang, Xiuling Zhu, Yongkang Sun, et al. Fermentationof EGCG GCG and EGCG3"Me isolated from Oolong tea by human intestinal microbiota [J]. Food Research International, 2013, 54(2): 1589-1595.
[21] 陈晓阳. 茯砖茶的生产与传播[J]. 茶叶通讯, 1997(1): 41-42.
[22] 傅冬和, 余智勇, 黄建安, 等. 不同年份茯砖茶水提物的抑菌效果研究[J]. 中国茶叶, 2011, 33(1): 10-12.
[23] 郭虹雯, 许翔雨, 陈莹, 等. 绿茶茶汤对肥胖相关肠道菌群的影响[J]. 茶叶科学, 2016, 36(4): 354-362.
[24] 吴根梁, 侯爱香, 李珂, 等. 陈年茯砖茶多酚类对老年人肠道菌群的影响研究[J]. 茶叶科学, 2018, 38(3): 319-330
[25] 刘平, 李宗军, 许爱清. 茯砖茶水提物对大肠杆菌感染小鼠的免疫调节作用[J]. 湖南农业大学学报(自然科学版), 2011, 37(5): 537-539.
[26] 岳随娟, 刘建, 龚加顺. 普洱茶茶褐素对大鼠肠道菌群的影响[J]. 茶叶科学, 2016, 36(3): 261-267.
[27] 郭虹雯, 许翔雨, 陈莹婕, 等. 绿茶茶汤对肥胖相关肠道菌群的影响[J]. 茶叶科学, 2016, 36(4): 354-362.
[28] 谢旻皓, 王晴川, 徐冬兰, 等. 苦丁茶冬青苦丁茶提取物与3,5-双咖啡酰奎尼酸对肠道微生物体外发酵的影响[J]. 食品科学, 2015, 36(17): 124-129.
[29] Lesmes U, Emma J B, Gibson G R, et al. Effects of resistant starch type Ⅲ polymorphs on human colon microbiota and short chain fatty acids in human gut models [J]. Journal of Agricultural and Food Chemistry, 2008, 56(13): 5415-5421.
[30] Bloemen J G, Venema K, van de Poll M C, et al. Short chain fatty acids exchange across the gut and liver in humans measured at surgery [J]. Clin Nutr(Edinburgh,Scotland), 2009, 28(6): 657-661.
[31] Kim CH, Park J, Kim M. Gut microbiota-derived short-chain Fatty acids, T cells, and inflammation [J]. Immune Netw, 2014, 14(6): 277-288.
[32] Vernazza C L, Gibson G R, Rastall R A.fermentation of chitosan derivatives by mixed cultures of human faecal bacteria [J]. Carbohydrate Polymers, 2005, 60(4): 539-545.
[33] Sanchez-Patan F, Cueva C, Monagas M, et al.fermentation of a red wine extract by human gut microbiota: changes in microbial groups and formation of phenolic metabolites [J]. Journal of Agricultural and Food Chemistry, 2012, 60(9): 2136-2147.
[34] 郭贵海, 王崇文. 肠道菌群调节剂的研究进展[J]. 临床内科杂志, 2002, 19(2): 88-90.
[35] Jelena Vulevic, Robert A Rastall, Glenn R Gibson. Developing a quantitative approach for determining the in vitro prebiotic potential of dietary oligosaccharides Short communication [J]. FEMS Microbiology Letters, 2004, 236(1): 153-159.
Effects of Green, Black and Fu Brick Tea AqueousExtracts on the Characteristics of Intestinal Microbiota duringFermentation
HOU Aixiang1,3, YAN Daomin2, SUN Jingwen4, ZHENG Xu1, LI Saidan4*, XIAO Runhua4, BEI Shuang4
1. Food Science and Technology College of Hunan Agricultural University, Changsha 410128, China; 2. International College of Hunan Agricultural University, Changsha 410128, China; 3. National Engineering Center of Plant Functional Components Utilization, Changsha 410128, China; 4. Orient Science and Technology of Hunan Agricultural University, Changsha 410128, China
In order to demonstrate the interaction effect of different tea aqueous extracts and intestinal microorganisms, anaerobic fermentationby the intestinal bacteria from healthy college students’ feces were conducted in this study. Traditional culture techniques and gas chromatography technology were employed to study the changes of pH, short-chain fatty acids and intestinal microbes in different tea aqueous extracts (green, black and Fu brick tea) during 24 h offermentation, and calculate the prebiotic index PI and B/E values ().The results show that the tea aqueous extracts significantly decreased the pH value compared with the blank control group, and the biggest drop was identified in the Fu brick tea group. Besides, the tea aqueous extracts significantly increased the production of short-chain fatty acids. Green tea had the largest increase in acetic acid, propionic acid, isobutyric acid, iso-pentanoic acid, pentanoic acid and total short-chain fatty acids, while Fu brick tea had the largest increase in butyric acid. All three kinds of tea aqueous extracts could affect the composition of intestinal microorganisms, promoted the growth ofand inhibited the growth of,and. Fu brick tea group had the largest promoting effect on, had the most obvious inhibiting effect onand, and green tea group had the largest inhibiting effect on. However, both green and black tea groups could promote the growth of, while Fu brick tea group showed inhibition ofgrowth. In addition, by analyzing PI value and B/E value, It was found that green, black and Fu brick teas had the function as probiotics. The largest PI value at the 4 h stage appeared in fu brick tea, while the largest PI value at the 8 h, 12 h and 24 h stages appeared in green tea. the largest B/E value throughout the fermentation process appeared in Fu brick tea group. This study provided basic data and scientific basis for the further expansion and promotion of different teas in the youth consumption market.
green tea, black tea, Fu brick tea,fermentation, short-chain fatty acid, intestinal microbiota
TS272
A
1000-369X(2019)04-403-12
2018-07-04
2018-09-07
国家自然科学基金(31701606)
侯爱香,女,博士研究生,主要从事食品生物技术研究。*通信作者:1758231594@qq.com

