早期大肠癌中DTL核蛋白表达及其意义
周瑾, 蔡红兵, 吴秀梅
南方医科大学中西医结合医院护理部(广东广州 510315)
大肠癌(colorectal cancer)是常见的恶性肿瘤,包括结肠癌和直肠癌。其病因与遗传、生活方式、大肠腺瘤等关系密切[1]。DTL(denticleless E3 ubiquitin protein ligase homolog )为无齿E3泛素蛋白连接酶同源物,最初在视黄酸诱导分化的人胚胎肿瘤细胞系NT2中被克隆[2]。DTL参与调控多种分子的泛素化降解,进而影响细胞周期的进程、DNA损伤修复等多种生理活动[3]。在进一步研究中,DTL在在多种肿瘤组织中特异性高表达,发挥了候选癌基因的作用,包括了肝癌、胃癌、Ewing肉瘤和乳腺癌[3-7]。与大肠组织相比,DTL基因mRNA水平在大肠癌组织中明显升高,并能被miR-30a-5p抑制,参与大肠癌的发病过程[8-9]。然而,作为一个核表达蛋白,目前还没有任何研究报导其与大肠癌临床参数和预后之间的关系。在本研究中,我们通过免疫组化的方法探讨DTL核蛋白在大肠癌与大肠组织中的表达,并分析DTL蛋白核表达与大肠癌临床病理参数和预后的关系。本研究表明,DTL蛋白核表达作为不利的因素参与了大肠癌的发病过程。
1 资料与方法
1.1 一般资料 于2014年2月至2017年3月收集南方医科大学中西医结合医院139例手术I~Ⅱ期大肠腺癌和35例存档大肠石蜡组织标本。纳入标准:(1)临床资料完整;(2)符合WHO中的诊断标准;(3)患者或家属签属知情同意书。排除标准:(1)有肠道手术史;(2)有肠道疾病手术史;(3)大肠癌术后复发;(4)术前有放化疗史。患者年龄19~79岁,其中男93例,女46例。
1.2 主要试剂 免疫组化采用SP法,其试剂盒购自福建迈新公司。
1.3 免疫组化 将石蜡切片置于60℃烤箱烘烤2 h后将切片按顺序浸入二甲苯中各脱蜡。进一步在不同梯度酒精中水化2 min;将切片放入盛有柠檬酸盐抗原修复液的孵育槽中,高温高压修复2 min,室温自然冷却;进一步按照SP试剂盒进行免疫组化检测:简要地,滴加卵白素后加入d-生物素溶液,进而内源性过氧化物酶阻断剂阻断。在加入10%山羊血清封闭,室温孵育10 min后弃血清;滴加1∶100稀释DTL兔抗人抗体(美国Abcam公司),4℃孵育过夜;滴加二抗(生物素标记的羊抗兔IgG)后滴加链霉素抗生物素蛋白-过氧化物酶溶液,室温孵育10 min;PBS冲洗后滴加新鲜配制的DAB液于切片中显色,中性树胶封片,显微镜下观察染色效果。
1.4 免疫组化结果判定 免疫染色评分以胞核单独进行。每张切片DTL表达水平采用公式:胞核评分=表达强度(0:无着色;1分:弱着色;2:着色;3:强着色)+着色细胞数(0分≤10%;1分≤50%;2≤70%;3>75%);高表达:≥4分;低表达:<4分。
1.5 统计学方法 实验数据采用SPSS 20.0统计软件进行处理。DTL蛋白在大肠癌与大肠组织以及其蛋白表达与临床参数相关性采用2检验。生存预后分析采用Mann WhitneyU检验,Cox模型用于评估DTL表达作为影响患者生存的独立预后因素。P<0.05为差异有统计学意义。
2 结果
2.1 DTL蛋白在大肠癌中核浆共表达 运用免疫组化染色检测了139例大肠癌和35例大肠组织中DTL蛋白表达。结果显示,DTL蛋白在正常大肠组织中低表达,但在大肠癌组织中,可出现低表达和高表达两种不同的情况(图1)。

A:DTL在大肠癌中高表达;B:DTL在大肠癌中低表达;C:DTL在大肠组织中低表达
图1 DTL在大肠癌和大肠组织中表达(免疫组化,×400)
2.2 DTL在大肠癌中的表达 分析139例大肠癌组织和35例正常大肠组织之间DTL蛋白高表达比率差异。数据分析显示,与正常大肠组织相比,DTL蛋白在大肠癌中表达明显升高(P<0.001)。见表1。
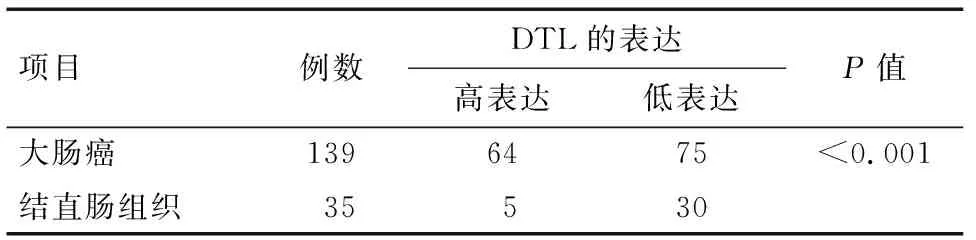
表1 DTL蛋白在不同大肠组织中的表达 例
2.3 DTL过表达与临床参数和预后之间相关性 虽然增加的DTL蛋白表达与大肠癌患者年龄、性别及T分期无关,见表2。但DTL蛋白表达水平与患者预后相关,其过表达明显不利于大肠癌患者的预后。结果表明,DTL表达越高,患者综合生存时间越短(P=0.014)。见图2。
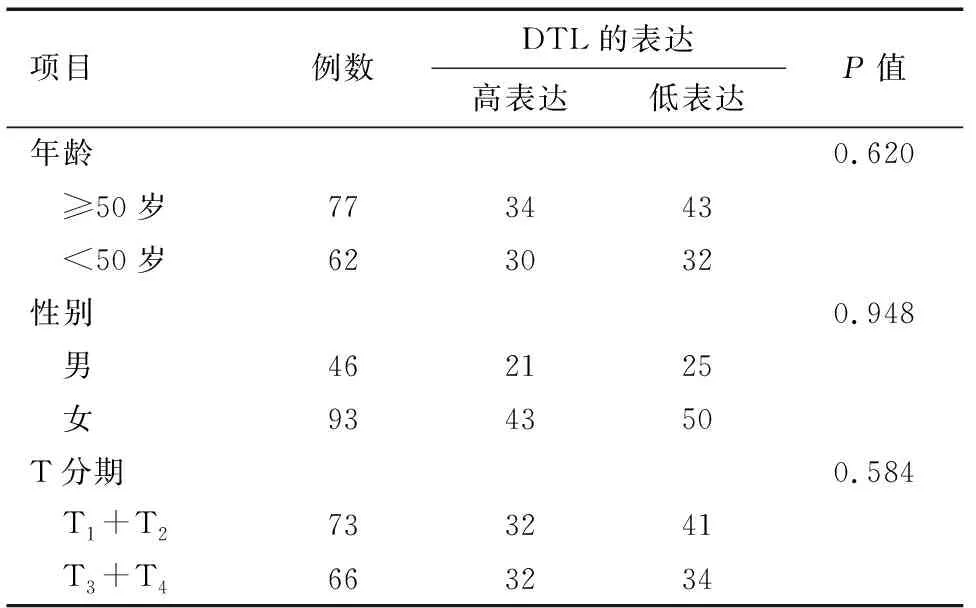
表2 大肠癌DTL表达与临床特征的相关性 例
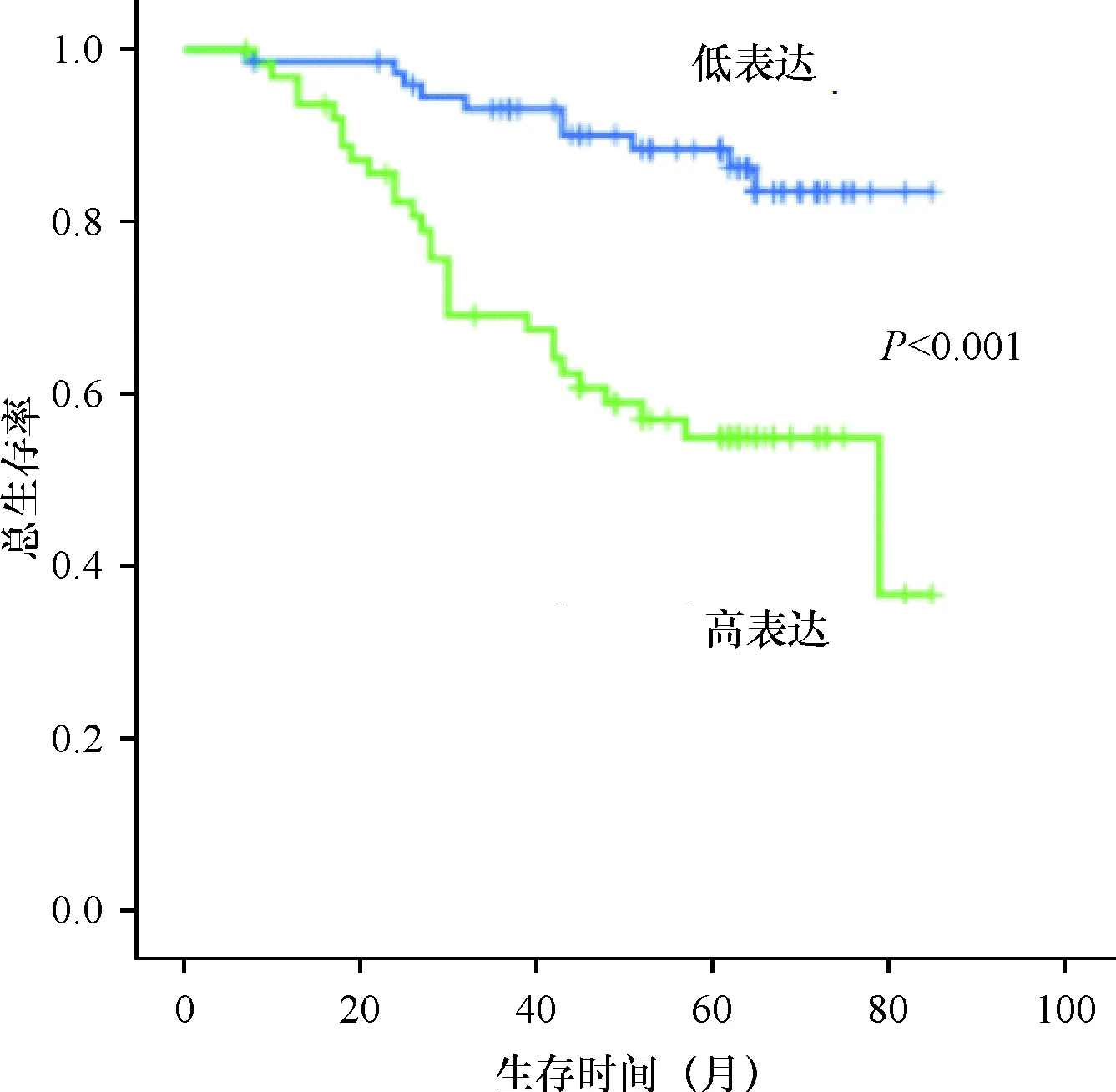
图2 DTL蛋白的表达与大肠癌患者预后的关系
2.4 DTL蛋白水平是大肠癌患者生存的独立预后因子 利用Cox模型评估DTL在大肠癌中作为独立预后因子的可能性。单变量和多变量分析结果都显示,DTL表达水平可作为判断大肠癌患者预后的独立性因素(P=0.019)。见表3。
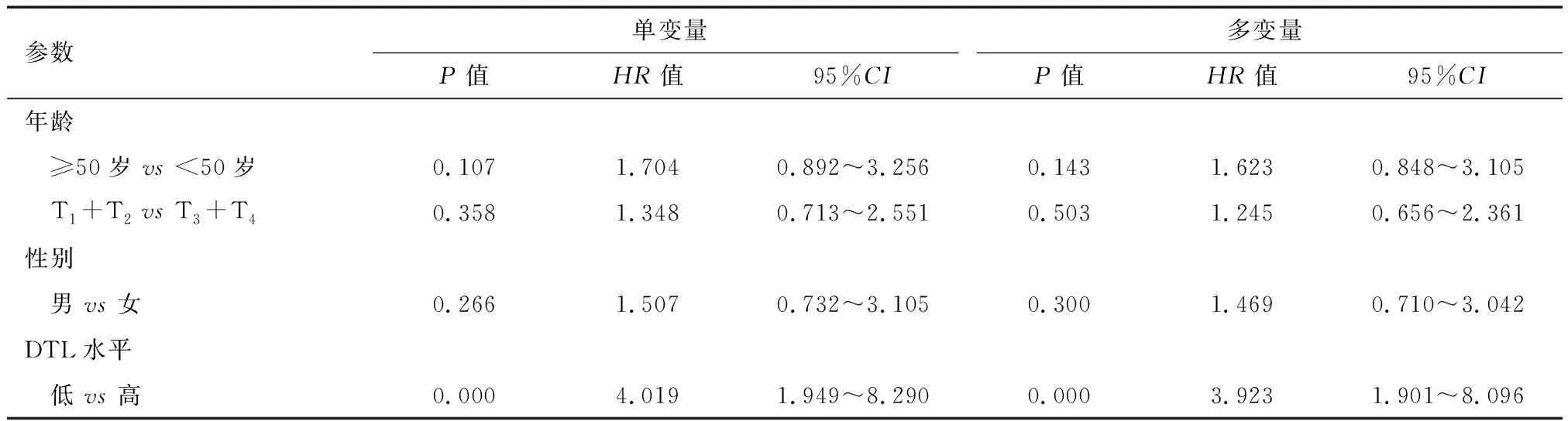
表3 总生存期单变量和多变量的Cox回归分析
3 讨论
DTL基因,又名RAMP/DCAF2/L2DTL,编码了一个推测性730氨基酸的蛋白,包含了6个高度保守的5个WD40-重复区域,能与DDB1/CULLIN4相互作用。除此之外,DTL是CRL4底物特异的适配子,介导多聚泛素化降解CDT1和P21等,这些机理的研究表明DTL发挥了关键性的生理性角色[10-12]。对于DTL在细胞内发挥的生理机能,前期有研究报道DTL-/-纯合子小鼠胚胎在2~4周细胞死亡,且细胞核形态异常,这提示DTL对细胞增殖和生长是必需的,可能其参与染色质复制有关[13]。DTL定位在染色体1q32。在这个区域,多个肿瘤存在着高频率扩增[14]。越来越多的研究表明,DTL在一些肿瘤中高表达,包括了Ewing肉瘤[7]和胃癌[2]等。而在大肠癌中,也有相关的研究表明,与大肠黏膜相比,DTL mRNA在大肠癌中表达明显升高,这提示DTL在大肠癌发病过程中发挥了重要作用。然而,其蛋白在大肠中的表达与临床参数和预后的关系尚未见报道。
DTL是泛素连接酶CRL4的一种底物接头蛋白。CRL4泛素连接酶是公认的细胞周期调节关键蛋白,在有丝分裂和S期过程中具有重要作用。CRL4-DTL可以促进细胞周期蛋白依赖激酶抑制剂p21发生泛素化降解,进而调控细胞的死亡[15]。在本研究中,我们首先观察到,DTL是一个核表达为主的蛋白。与大肠组织相比,DTL蛋白在大肠癌中表达明显上调。该结果与外国学者分别在乳腺癌[6]、Ewing肉瘤[7]和胃癌[2]等肿瘤结果相似,同时也验证了Baraniskin等[8]报道DTL mRNA水平在大肠癌中表达升高的可靠性。为了明确DTL蛋白表达与大肠癌临床进展之间的关系,我们统计分析了DTL蛋白表达与大肠癌临床病理参数的相关性。结果显示,虽然增高的DTL表达与大肠癌的发病年龄、性别及T分期无关,该结果类似于Baraniskin等[8]的研究,提示DTL高表达与大肠癌的增殖关系不是很明确。
在以往的研究[3-4,6-7]中,DTL高表达作为不利的预后因子参与了多种肿瘤的发病过程。我们分析了DTL蛋白在大肠癌中的高表达与临床预后的关系。结果显示,DTL的表达与大肠癌的预后呈明显负相关。DTL蛋白表达越高,大肠癌患者综合生存时间越短,反之,DTL表达越低,患者综合生存时间越长。该数据与其在胃癌[2]和Ewing肉瘤[7]相一致,提示DTL高表达是大肠癌预后不良的重要因素。最后,我们单变量和多变量分析发现,DTL表达可以作为评估大肠癌预后的一个独立影响因子。
总之,我们研究发现DTL蛋白在大肠癌中表达上调,其促进了大肠癌临床进展,并可作为大肠癌一个独立不良预后因子。结果提示DTL是大肠癌预后判断的一个重要分子标志,其亦可能作为大肠癌分子治疗靶标。本研究结果为后续相关研究提供了一定的前期基础和理论支持。

